KimyaKongreleri.org
advertisement

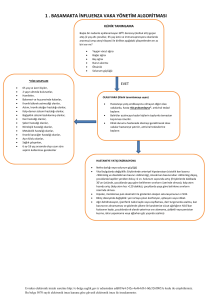
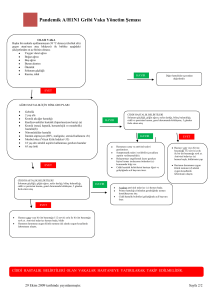
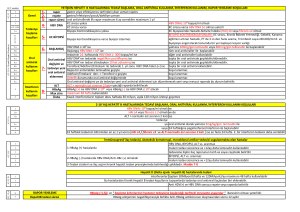
BP-TR-010 İnsan RIG-1 Cards Domainlerinin ve Bu Domainlerin Ubiquitilasyonunda Rol Oynayan Çeşitli E3 Enzimlerinin Yapısal Çalışmalar için Üretilmesi Gül Demir, Çağdaş Dağ, E. Sonay Elgin Muğla Üniversitesi Fen Fakültesi Kimya Bölümü Ubiquitin, ökaryotik organizmaların hemen hemen bütün dokularında bulunan regülatör bir proteindir. Ubiquitin ile protein modifikasyonu ubiquitilasyon olarak adlandırılır. Ubiquitilasyon sistemi; gen transkripsiyonu, hücre döngüsünün devamlılığı, DNA tamiri, apoptoz (programlan mış hücre ölümü ), protein kararlığı, viral enfeksiyon, immün yanıtı ve endositoz gibi birçok biyolojik prosesi düzenlemektedir. Ubiquitinin hedef proteinlere konjugasyonu E1 aktive edici,E2 konjuge edici ve E3 ligazlar olarak adlandırılan bir dizi enzimlerin aktiviteleri ile gerçekleşmektedir [1]. Ubiquitilasyon sisteminin düzenlediği hedef proteinlerden birisi RIG-1 (Retinoic-acid-inducible gene-1) proteinidir. Sitozolik RIG-1 reseptörü, sitoplazmada 5' trifosfatlar içeren viral RNA’yı tanır ve antiviral sinyal kaskatını başlatır. Böylece interferonlar ve sitokin üretimi ile doğal bağışıklık yanıtı aktive edilir. RIG-1 proteini üç domainden oluşmaktadır. Bunlar; regulatör domain (RD ), helikaz domain ve kaspaz aktivasyon (caspase activation and recruitment, CARD) domainleridir [2]. İnsan RIG-1 ubiquitilasyonunun işlevi, ubiquitilasyonu gerçekleştiren E3 enzimine ve ubiquitilasyonun çeşidine bağlı olarak farklılık gösterir. RIG-1’in TRIM25 E3 enzimi tarafından CARD domainlerinin ubiquitilasyonu, bu domainlerin aktivasyonu ve viral savunma sistemindeki bir alt basamak olan MAVS’a (mitokondrial antiviral sinyal) yönlendirilmesi ile sonuçlanır. Böylece antiviral kaskat başlatılmış olur. Buna karşın, RIG-1’in bir diğer E3 enzimi RNF125 aracılıklı ubiquitilasyonu onu degredasyon için proteozoma yönlendirir ve bunun sonucunda RIG-1 seviyesi düşer. RIG-1’in ubiquitilasyon ile regülasyonunun anlaşılmasında yapısal çalışmaların rolü büyüktür. RIG -1 CARD domainlerinin üç boyutlu yapılarının, farklı E3 enzimleri ile etkileşim yüzeylerinin belirlenmesi ve aynı şekilde E3 enzimleri üzerinde RIG-1 CARDs etkileşiminde rol oynayan bölgelerin belirlenmesi, bu karmaşık sistemin anlaşılmasına yardımcı olacaktır. Bizde bu çalışmada, NMR ile yapısal çalışmalara zemin hazırlamak amacıyla, RIG-1 CARD-1 ve CARD-2 domainlerini ve bu domainlerin ubiquitilasyonunda rol alan E3 enzimlerinden RNF125’in çinko parmak (ring finger) ve TRIM25’in SPRY domainlerini miligram miktarlarda ve izotopik işaretli olarak üretmeyi hedefledik. Bu amaçla, hedef protein domainlerini kodlayan genler PCR ile çoğaltıldı ve pQE-30 ekspresyon plazmiti içerisine klonlandı. Hedef genleri içeren plazmitler daha sonra uygun E.Coli ekspresyon suşlarına transfrom edilerek, hedef domainlerin yüksek miktarlarda ekspresyonu gerçekleştirildi. Tüm hedef domainlerin bakteriyel sistemde çözünmeyen agregatlar şeklinde üretildikleri tespit edildi ve renatürasyon için uygun yöntem ve koşulların belirlenmesi için çalışıldı. Renatürasyonu başarıyla gerçekleştirilen protein domainleri çeşitli kromatografik yöntemler ile saflaştırıldı. Son olarak, proteinlerin 15 N işaretli olarak üretilmesi için M9 minimal besiyeri kullanıldı. 15 N-işaretli örneklerin doğal üç boyutlu yapılarına katlanıp katlanmadıkları 1 H-15 N HSQC spektrumları kaydedilerek kontrol edildi. KAYNAKLAR [1] Herrmann J, Lerman LO, Lerman A. Ubiquitin and ubiquitin-like proteins in protein regulation. Circ Res 100: 1276-1291, 2007. [2] Pothlichet J, et al. Study of human RIG-I polymorphisms identifies two variants with an opposite impact on the antiviral immune response. Plos One 4: e7582, 2009. 64 KimyaKongreleri.org BP-EN-010 Production of Human RIG-1 Cards and Various E3 Enzymes Involved in Ubiquitylation of These Domains for Structural Studies Gül Demir, Çağdaş Dağ, E. Sonay Elgin Muğla Üniversitesi Fen Fakültesi Kimya Bölümü Ubiquitin is a regulatory protein found in almost all tissues of eukaryotic organisms.. Modification of eukaryotik proteins by ubiquitin is called ubiquitylation Ubiquitylation is involved in regulation of numerous biological processes such as regulation of gene expression, cell cycle, DNA repair, apoptosis, protein stability, immun response to viral infection and endocytosis. Conjugation of ubiquitin to target proteins requires activities of three enzyme classes; E1 activating enzymes, E2 conjugating enzymes and E3 ligases [1]. One of the target proteins regulated by ubiquitin is called retinoic acid inducible gene -1 (RIG-1 Cytosolic RIG-1 receptor recognizes the 5’ triphosphate containing viral RNA in cytoplasm and initiates the antiviral signal cascade. RIG-1 consists of three domains; regulatory domain (RD ), helicase domain, and caspase activation and recruitment domains (CARDs) [2]. The function of human RIG-1 ubiquitylation is determined by the E3 enzyme that carries out ubiquitylation and the type of ubiquitylation For example, TRIM25 mediated ubiquitylation of RIG-1 CARDs results in activation these domains whics directs them to next component, mitochondrial antiviral signal (MAVS ), in the viral defence system which leads to the activation of antiviral cascade. On the other hand, RNF125 mediated ubiquitylation of RIG-1 CARDs directs it to proteosome for degredation which results in reduction of RIG-1 levels. Structural studies plays an important role in understanding of regulation of RIG -1 ubiquitylation.. Determination of three dimensional structures of RIG-1 CARDs and their interaction surfaces with various E3 enzymes will enhance our understandi ng of this complex signaling In this study, we aimed to produce milligram amounts of isotopically labeled RIG-1 CARD-1, and CARD-2 domains and domains of E3 enzymes, namely RNF125 ring finger and TRIM25-SPRY domains, involved in ubiquitylation of RIG-1 CARDs to use in structural studies. For this, first the genes coding target domains were amplified by PCR and cloned into pQE-30 expression vector. Then plasmids containing target genes were transformed into E. Coli expression strains and overexpressed. All the target genes were expressed as insoluble inclusion bodies in bacterial expression system. Studies were carried out to determine the suitable renaturation method and conditions. Successfully refolded protein domains were purified using various chromatogrphic techniques. M9 minimal media was used for the production of 15N labeled protein domains. 1 H-15 N HSQC spectra was recorded to check the proper folding. REFERENCES [1] Herrmann J, Lerman LO, Lerman A. Ubiquitin and ubiquitin-like proteins in protein regulation. Circ Res 100: 1276-1291, 2007. [2] Pothlichet J, et al. Study of human RIG-I polymorphisms identifies two variants with an opposite impact on the antiviral immune response. Plos One 4: e7582, 2009. 65 KimyaKongreleri.org