Örnek
advertisement
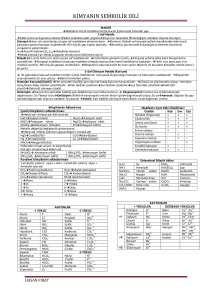
Özhan ÇALIŞ ELEMENT VE BİLEŞİKLER ELEMENT : Aynı cins atomlardan meydana gelmiş saf maddelere denir. ÖZELLİKLERİ: 1.Yapılarında aynı cins atom bulundururlar. Demir elementi Demir atomları Demir elementinin yapısında başka atomlar bulunursa o bir karışım olur. Fe Özhan ÇALIŞ Co 2.Saf maddelerdir. Aynı cins atom yada molekül içeren maddelere saf madde denildiğini biliyoruz. Elementlerde aynı tür atomlardan oluştuklarına göre elementlerde saf maddelerdir. S Cu Özhan ÇALIŞ 3.Belli erime ve kaynama noktaları vardır. Tüm saf maddelerin belli erime ve kaynama noktaları vardır. Ayrıca erime ve kaynama süresince sıcaklıkları sabittir. Sıcaklık (0oC) K.N E.N I. Bölge II. Bölge III. Bölge IV. Bölge V. Bölge Isı (kal) Grafikte ilgili yerlere, istenilen elementlere ait erime ve kaynama noktaları yazılarak, gerekli grafik oluşturulur. Özhan ÇALIŞ 4.Fiziksel ve kimyasal yöntemlerle atomlarından daha basit birimlerine ayrıştırılamazlar. Ancak, atomlar nükleer yöntemlerle parçalana bilirler. Özhan ÇALIŞ 5.Sembollerle gösterilirler. Elementlerin sembolleri Latince ismine bakılarak belirlenir. Latince isimlerinin ilk harfi büyük harfle gerekiyorsa diğer harflerden birisi küçük harfle yazılarak belirlenir. LATİNCE İSMİ SEMBOLÜ Carbon C Calcıum Ca Clour Cl Cobalt Co Cadmıum Cd Cubrum Cu Diğer elementlerde benzer şekilde sembolize edilmişlerdir. Özhan ÇALIŞ 6.Elementler; -Metaller -A metaller -Yarı metaller -Soygazlar olmak üzere; 4 bölümde incelenirler. Mg Cl Özhan ÇALIŞ Rn METALLER: Periyodik tabloda; 1A (H hariç), 2A, Tüm B grubu elementleri, 3A (B, Hariç), 4A’da Sn ve Pb, 5A’da Bi metaller sınıfında incelenirler. METALLERİN ÖZELLİKLERİ: 1. Cıva hariç hepsi, oda şarlarında (25 0C) katı halde bulunurlar. (Hg’nın EN:-39 0C) 2. Metalik parlaklık gösterirler. 3. İşlene bilirler. (Tel ve levha haline getirilirler.) 4. Isı ve elektrik akımını iletirler. (Metallerde elektrik iletkenliği serbest elektronları sayesine gerçekleşir. Sıcaklığın artırılması metalik iletkenliği azaltır.) 6. Elektron almazlar. (Kendi aralarında bileşik oluşturmazlar. Ancak homojen olarak karışarak alaşımları oluştururlar.) 7. Asitlerle tepkimeye girerek çıkartırlar. (Cu, Hg, Ag, Pt, Au hariç) Özhan ÇALIŞ H2 gazı açığa AMETALLER: Periyodik tabloda; 1A ‘da H, 4A’da C, 5A’da N ve P, 6A’da O,S ve Se , 7A’da F, Cl, Br, I Ametaller sınıfında incelenirler A METALLERİN ÖZELLİKLERİ: 1. Oda şarlarında (25 0C) katı, sıvı ve gaz hallerinde bulunurlar. Örnek: (KATI: C,P,S,I; SIVI: Br; GAZ: N2, O2, F2,Cl2 ) 2. Mattırlar. 3. Erime ve kaynama noktaları düşüktür. 4. Kırılgandırlar. 5. Elektrik akımını iletmezler. ( Grafit hariç ) 6.Metallerle tepkimelerinde, elektron alarak - yükle yüklenirler, indirgenirler, yükseltgendirler. 7. Kendi aralarında, kovalent bağlı bileşik oluştururlar. 8. Ametallerin oksitleri genellikle asidik özellik gösterirler. Özhan ÇALIŞ YARI METALLER: Periyodik tabloda; 3A ‘da B, 4A’da Si ve Ge, 5A’da As ve Sb, 6A’da Te ve Po , 7A’da At yarı metaller sınıfında incelenirler. ÖZELLİKLERİ: Bu elementlere yarı metaller denilmesinin sebebi; metalik özelliklerle beraber a metalik özelliklerde göstermelerindendir. Si B Özhan ÇALIŞ SOYGAZLAR: Periyodik tabloda; 8A grubu elementlerine elementler; He, Ne, Ar,Kr,Xe, Rn dur. denir. Bu ÖZELLİKLERİ: 1. Oda şartlarında hepsi tek atomlu tanecikler halinde bulunurlar 2. Değerlik elektron sayıları 8’dir. (He:2) 3. Elektron dizilişleri, nS2nP6 ile biter. (He:1S2) 4. İyonlaşma enerjileri yüksektir. 5. Elektron ilgileri yok kabul edilir. 6. Kimyasal aktiflikleri olmadıklarından soy yada asal gazlar diye bilinirler. He Ne Özhan ÇALIŞ Ar BİLEŞİKLER İki ya da daha fazla maddenin belli oranda kimyasal olarak birleşmeleri sonucu oluşturdukları yeni, saf maddeye bileşik denir. Özhan ÇALIŞ ÖZELLİKLERİ: 1. Yapılarında iki ya da daha fazla madde bulundururlar. Yukarıdaki örnekte de görüldüğü gibi, Karbon monoksit iki maddeden, karbon dioksit üç maddeden oluşmuştur. Örnek: Co ve CO arasındaki farkları açıklayınız? Co = Kobalt elementini ifade eder. Tek bir atomdan oluştuğu için, elementtir. Co bir sembol dür. CO= Karbon monoksit bileşiğini ifade ediyor. C ve O2 elementlerinden meydana gelmiştir. Yani yapısında iki farklı madde bulundurduğu için, bilşiktir. CO bir formüldür. Özhan ÇALIŞ 2. Belli oranda birleşirler. Yine yukarıdaki örnekten anlaşılacağı gibi bire bir birleşseler CO oluşması için, 1 C ve 1O atomu tepkimeye girmelidir. Bir CO2 molekülü oluşabilmesi için 1 C ve 2 O atomu gereklidir. Kısaca anlaşılacağı gibi bileşikleri oluşturan elementlerin kütleleri arasında belli bir oran olmak zorundadır. Özhan ÇALIŞ 3. Kimyasal olarak birleşirler. Bir bileşik oluşurken atomlar ya elektron alırlar ya verirler ya da ortaklaşa kullanırlar. Metal-ametal bileşiklerinde, metaller elektron verir, ametaller elektron alır. Ametal-ametal bileşiklerinde elektronlar ortaklaşa kullanılır. Metal-metal bileşik oluşturmazlar. Homojen olarak karışarak alaşımları oluştururlar. Kısaca bileşikler oluşurken kimyasal olay olmak zorundadır. H 2( g ) + 1 2 O2( g ) → H 2O( S ) Özhan ÇALIŞ 4.Kendini oluşturan maddelerin özelliklerini taşımazlar. Bileşikler kendini oluşturan elementlerden farklı özelliklere sahiptirler. Bunu hepimizin bildiği bir örnekle açıklayalım: H 2( g ) + 1 2 O2( g ) → H 2O( S ) Tepkimesinde; H2:Yanıcı O2:Yakıcı H2O: söndürücü özelliği gösterirler. Yani su elementlerinden farklı bir özellik gösterir. Özhan ÇALIŞ 5. Kendini oluşturan maddelere ancak kimyasal yöntemlerle ayrıştırıla bilirler. -Zayıf bağlı bileşikler ısı enerjisi yöntemiyle atomlarına ayrıştırıla bilirler. CuO( k ) 1 → Cu( k ) + O2( g ) 2 -Kuvvetli bağlı bileşikler ise ancak elektrolizle bileşenlerine ayrıştırıla bilirler. elektroliz H 2O( S ) → H 2 + 1 O2 2 -Bazı bileşiklerde geri dönüşüm mümkün değildir. tümyöntem CO2 ( g ) → CO2 ( g ) Özhan ÇALIŞ 6. Saftırlar. Tüm elementler olduğu gibi, tüm bileşiklerde saf maddelerdir. 7. Belli erime ve kaynama noktaları vardır. Tüm saf maddelerin belli bir erime ve kaynama noktaları vardır. o Sıcaklık (0 C) K.N E.N I. Bölge II. Bölge III. Bölge IV. Bölge V. Bölge Isı (kal) Özhan ÇALIŞ 8.İyonik yapılı maddeler iyonlardan, kovalent yapılı maddeler moleküllerden oluşmuşlardır. Bu konu ileriki derslerde anlatılacaktır. Özhan ÇALIŞ 9. Formüllerle gösterilirler. Tüm bileşikler, oluştuğu sembollerin yan yana yazılmasıyla, oluşturulan formüllerle gösterilirler. Mesela: X ve Y elementlerinden oluşmuş bir bileşiği XmYn gibi bir formülle gösterirsek. Burada; m=X’in mol sayısı Ya da sayısı. n= Y’nin mol sayısı ya da sayısıdır. Benzer biçimde; H2SO4 bileşiği: 2 tane H atomu, 1 tane S atomu,4 tane O atomundan oluşmuştur. Özhan ÇALIŞ Kütlenin Korunumu: Bileşiklerin, kimyasal bir olay sonucu oluştuğunu öğrenmiştik. Kimyasal tepkimelerde, tepkimeye giren maddelerin kütleleri toplamı, tepkime sonunda oluşan maddelerin kütleleri toplamına eşittir. Bu kurala; Kütlenin Korunumu Kanunu denir. Örnek: elektroliz H 2O( S ) → H 2 + 1 O2 2 18 g 2g 16g Örnekten de anlaşıldığı gibi, 18 gram suyu analiz ettiğimizde, 2 g hidrojenle, 16 g oksijen elde ederiz. Yani tepkimeye giren ve çıkan maddelerin kütleleri eşit olacaktır. Özhan ÇALIŞ Sabit Oranlar Korunumu: Bir bileşik hangi yolla elde edilirse edilsin, bileşiği oluşturan atomların kütleleri arasında basit tam sayılarla ifade edilen sabit bir oran vardır. Bu orana Sabit Oranlar ya da Belirli Ağırlık Oranı Kanunu denir. Örnek: H2O bileşiğinde sabit oranları nedir ? H:1 O:16 ÇÖZÜM: 2 mH 1 = = mO 16 8 Yani su bileşiği oluşurken, 1 g H2 ile 8 g O2 tepkimeye girmektedir. Özhan ÇALIŞ Katlı Oranlar Kanunu: İki element bir biriyle birden fazla bileşik oluşturuyorsa, bu elementlerden birinin sabit miktarına karşılık gelen diğer elementin değişen kütleleri arasında bait tam sayılarla ifade edilen sabit bir ora vardır. Bu orana Katlı Oranlar Kanunu denir. Özhan ÇALIŞ Formül : Bileşikleri kısaca ifade eden şekle, formül denir. Bileşiği oluşturan atomların sembollerinin yan yana yazılması ve kaçar tane atomdan oluştuğunu da, sağ alt köşesine yazılmasıyla oluşur. ÖRNEK: C6H12O6 formülüyle gösterilen, çay şekeri; 1.C,H ve O atomlarından oluşmuştur. 2. 1 molekülü, 6 tane C, 12 tane H ve 6 tane O atomu içerir. 3. C/H =1/2 H/O=2 Özhan ÇALIŞ ÖNEMLİ ANYONLAR - 1 YÜKLÜ -1 Florür F Cl-1 Klorür Br-1 Bromür Iyodür I-1 OH-1 Hidrohsil NO3-1 Nitrat CN-1 Siyanür HCO3- 1 Bikarbonat MnO4- 1 Pernanganat - 2YÜKLÜ -2 O S-2 SO4-2 SO3-2 CO3-2 Oksit Sülfür Sülfat Sülfit Karbonat -2 C2 O4 Oksalat CrO4-2 Kromat Cr2 O7- 2 Dikromat MnO4-2 Manganat Özhan ÇALIŞ - 3 YÜKLÜ -3 N P-3 PO3-3 PO4-3 Nitrür Fosfür Fosfit Fosfat ÇAPRAZLAMA KURALI Bileşiği oluşturan katyon ve anyonlar yan yana yazılır. Katyon ve anyonların yükleri diğerinin sağ alt köşesine gelecek şekilde çaprazlanır. +m X -n Y Xm Yn NOT: Bu kural, ametal-ametal bileşikleri için uygun değildir. Özhan ÇALIŞ Bileşiklerin İsimlendirilmesi: 1.METAL-AMETAL BİL. İSİMLENDİRİLMESİ METALİN ADI + AMETALİN ADI + ÜR ÖRNEK: CaF2 : Kalsiyum Florür NaCl : Sodyum Klorür AlBr3 : Alüminyum Bromür MgI2 : Magnezyum İyodür. CaO : Kalsiyum Oksit CaS : Kalsiyum Sülfür Eğer metal değişik değerlik alabiliyorsa; METALİN ADI +METALİN YÜKÜ+ AMETALİN ADI + ÜR CuCl : Bakır –I-klorür CuCl2 : Bakır –II-klorür FeO :Demir –II-oksit Fe2O3 :Demir –III-oksit Özhan ÇALIŞ 2.METAL-KÖK BİL. İSİMLENDİRİLMESİ METALİN ADI + KÖKÜN ADI ÖRNEK: CaSO4 NaNO3 AlPO4 Mg(ClO3)2 CaCr2O7 CaCO3 FeSO4 Fe2(SO4)3 : Kalsiyum Sülfat : Sodyum Nitrat : Alüminyum Fosfat : Magnezyum Klorat : Kalsiyum di Kromat : Kalsiyum Karbonat : Demir-II- Sülfat : Demir-III- Sülfat Özhan ÇALIŞ 3. KÖK–KÖK BİL. İSİMLENDİRİLMESİ KÖKÜN ADI+ KÖKÜN ADI ÖRNEK: NH4NO3 : Amonyum Nitrat (NH4)3 PO4 : Amonyum Fosfat (NH4)2SO4 : Amonyum Sülfat NH4ClO3 : Amonyum klorat 4. KÖK - AMETAL BİL. İSİMLENDİRİLMESİ KÖKÜN ADI + AMETAL ADI ÖRNEK: NH4Cl : Amonyum Klorür (NH4 )2S : Amonyum Sülfür (NH4)3N : Amonyum Nitrür (NH4)3P : Amonyum Fosfür Özhan ÇALIŞ 5. AMETAL -AMETAL BİL. İSİMLENDİRİLMESİ SAYI EKİ + ELEMENT ADI + SAYI EKİ + ELEMENT ADI + ÜR ÖRNEK: NO :Azot Monoksit N2O :Di Azot Monoksit NO2 : Azot Di Oksit N2O4 : Di Azot Tetra Oksit N2O5 : Di Azot Penta Oksit OF2 : Oksijen Di Florür SF6 : Kükürt Hekza Florür ClF7 : Klor Hepta Florür 1: Mono 2:Di 3:Tiri 4:Tetra 7:Hepta 8:Okta 9: Nona Özhan ÇALIŞ 5:Penta 6:Hekza 10:Deka Özhan ÇALIŞ