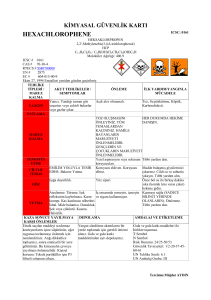
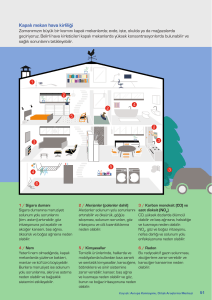
Untitled
advertisement

FARELERDE DİASETİLİN SİTOKİN SALINIM PROFİLLERİNİN İNCELENEREK SOLUNUM SENSİTİZASYON POTANSİYELİNİN ARAŞTIRILMASI Aylin ELKAMA YÜKSEK LİSANS TEZİ FARMASÖTİK TOKSİKOLOJİ ANABİLİM DALI GAZİ ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ NİSAN 2015 27/04/2015 iv FARELERDE DİASETİLİN SİTOKİN SALINIM PROFİLLERİNİN İNCELENEREK SOLUNUM SENSİTİZASYON POTANSİYELİNİN ARAŞTIRILMASI (Yüksek Lisans Tezi) Aylin ELKAMA GAZİ ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ Nisan 2015 ÖZET İşyeri ortamında sensitizan kimyasallara maruziyet solunum yoluyla ilgili çok ciddi mesleki hastalıklara yol açmaktadır. Son yıllarda gıdalarda katkı maddesi olarak kullanılan Diasetil maddesinin bronşiyolitis obliterans ve astım gibi hastalıklarla ilişkili olduğu ve bu nedenle üretim yerinde çalışan işçi sağlığı için tehlike oluşturduğu düşünülmektedir. Tez çalışmamızda bu tehlikenin boyutunu değerlendirmek üzere Diasetil’in sensitizan karakteristiğini ortaya koymayı amaçladık. Negatif, pozitif ve çözücü kontrol gruplarıyla birlikte Diasetil’in sensitizasyon potansiyelinin belirlenmesi için hayvan refahının gözetildiği ve radyoaktif olmayan ex vivo Lokal Lenf Düğümü Testi (LLNA):BrdU-ELISA yöntemi kısa süreli ve kronik maruziyet protokolleri ile yürütülmüştür. İmmün reaksiyonlarda sitokinlerin ve antikorların başlıca rolünün olmasından ve bu zamana kadar Diasetil’in tüm sitokin profili aydınlatılmadığından, sitokin profilleme ve fare IgE testi çalışmaya dahil edilmiştir. Deneylerimiz sonucunda Diasetil’in %10 (ağırlık/hacim) konsantrasyonda çözücü kontrole kıyasla lenfosit poliferasyonunu anlamlı şekilde indüklemediği, aynı konsantrasyonda her iki maruziyet süresinde de anlamlı IgE antikoru artışına neden olduğu gözlenmiştir. Bu çalışmanın Diasetil’in işçi sağlığına yönelik taşıdığı riskin değerlendirilmesine ve sağlık otoritelerince gerekli düzenlemelerin yapılmasına katkı sağlayacağı düşünülmektedir. Bilim kodu Anahtar kelimler Sayfa adedi Danışman : 1021 : Sensitizasyon, diasetil, ex vivo LLNA:BrdU-ELISA yöntemi, hayvan refahı, sitokin profilleme, fare IgE testi, bronşiyolitis obliterans, astım : 112 : Prof. Dr. Ali Esat KARAKAYA v INVESTIGATION OF RESPIRATORY SENSITIZATION POTENCY OF DIACETYL BY DETERMINING CYTOKINE RELEASE PROFILES IN MICE (M.Sc. Thesis) Aylin ELKAMA GAZI UNIVERSITY INSTITUTE OF HEALTH SCIENCES January 2015 ABSTRACT Exposure to chemical sensitizers in workplace settings leads to significant occupational diseases related to respiratory tract. In recent years diacetyl, which is used as a food additive, is considered to be associated with various diseases such as bronchiolitis obliterans and asthma and therefore diacetyl is thought to be as an important hazard for worker’s health. With this thesis study we aimed to characterize the sensitization potency of diacetyl for the purpose of its hazard evaluation. For determining the sensitization potency of diacetyl with negative, pozitive and vehicle control groups, animal welfare caring and non-radioactive ex vivo Local Lymph Node Assay (LLNA):BrdU-ELISA method with short term and chronic exposure protocols was performed. Due to significant role of cytokines and antibodies in immune reactions and with limited knowledge about the whole cytokine profile of diacetyl up to now, cytokine profiling and Mouse IgE test were incorporated into research. As a consequence of our experiments, lymphocyte proliferation induced with a concentration of 10% (w/v) of diacetyl was not found as statistically significant in comparison with vehicle control. The same concentration of the test material induced statistically significant IgE antibody levels in comparison with vehicle control group in both exposure protocols. In conclusion this research supports the studies in the field of risk assessment of diacetyl for occupational safety and contibutes to health authorities to adopt new regulations. Science Code Key words Page number Supervisor : 1021 : Sensitization, diacetyl, ex vivo LLNA:BrdU-ELISA method, animal welfare, cytokine profiling, mouse IgE test, bronchiolitis obliterans, asthma : 112 : Prof. Dr. Ali Esat KARAKAYA vi TEŞEKKÜR Çalışmalarım boyunca değerli yardım ve katkılarıyla beni yönlendiren, kıymetli tecrübelerinden faydalandığım danışmanım Prof. Dr. Ali Esat KARAKAYA ve Ankara Üniversitesi Eczacılık Fakültesi Farmasötik Toksikoloji Anabilim Dalı öğretim üyesi Prof. Dr. Asuman KARAKAYA’ya, deneylerim boyunca tecrübelerini paylaşan ve yardımlarını esirgemeyen Ankara Üniversitesi Eczacılık Fakültesi Farmasötik Toksikoloji Anabilim Dalı öğretim üyesi Dr. Özge CEMİLOĞLU ÜLKER’e teşekkür ederim. Hayvan deneylerimde yardımları ve tecrübeleriyle kolaylık sağlayan Gazi Üniversitesi Laboratuvar Hayvanları Yetiştirme ve Deneysel Araştırmalar Merkezi (GÜDAM) Araştırma Sorumluları Vet. Hek. Dr. Elvan ANADOL ve Vet. Hek. Dr. Elif ERGÜVEN KAYA’ya ve üretim bölümü personellerine teşekkür ederim. Tez çalışmamın her aşamasına tanık olan, motivasyonumu her daim yüksek tutmamı sağlayan yüksek lisans tezimin hayatıma kazandırdığı sevgili arkadaşım Ankara Üniversitesi Eczacılık Fakültesi Farmasötik Toksikoloji yüksek lisans öğrencisi Erim TEKER’e ve tezimi yazma aşamasında mesafelere karşın beni yalnız bırakmayıp telefonun diğer ucundan desteğini ve sohbetini esirgemeyen sevgili arkadaşım Ali Osman SUİÇMEZ’e teşekkür ederim. Manevi destekleri ile beni hiçbir zaman yalnız bırakmayan, en umutsuz olduğum anlarda umut ışığım olan, benimle gülüp benimle ağlayan Canım anneannem Nesrin OĞUZ, Canım annem Güleren ELKAMA, Canım babam Aydın ELKAMA, Canım ablam Aygül ELKAMA PAK ve Canım eniştem Oktay PAK’a tüm kalbimle teşekkür ederim. Değerli ailem iyi ki varsınız… vii İÇİNDEKİLER Sayfa ÖZET ......................................................................................................................... iv ABSTRACT .............................................................................................................. v TEŞEKKÜR .............................................................................................................. vi İÇİNDEKİLER .......................................................................................................... vii ÇİZELGELERİN LİSTESİ ........................................................................................ xi ŞEKİLLERİN LİSTESİ ............................................................................................. xvi 1. GİRİŞ .................................................................................................................. 1 2. GENEL BİLGİLER .......................................................................................... 5 2.1. Aşırı Duyarlılık Reaksiyonları ........................................................................ 5 2.1.1. Temas aşırı duyarlılığı ve klinik sonucu alerjik temas dermatiti ............. 7 2.1.2. Solunum sensitizasyonu ........................................................................ 11 2.2. Alerjik Temas Dermatiti ve Solunum Sensitizasyonunda Sitokinlerin Rolü ..... 14 2.3. Kimyasalların Sensitizasyon Potansiyellerinin Ölçüm Yöntemleri .................. 18 2.3.1. Standart fare lokal lenf düğümü testi (LLNA) ....................................... 21 2.3.2. Standart LLNA yöntemine alternatif in vivo BrdU yöntemi ................... 23 2.3.3. Standart LLNA yöntemine alternatif ex vivo BrdU yöntemi................... 24 2.3.4. rLLNA (reduced LLNA) ....................................................................... 24 2.4. LLNA’nın Kimyasalların Solunum Sensitizasyon Potansiyellerinin Ölçümüne Uyarlanması.................................................................................................... 25 2.5. Sitokin Profillemesi ........................................................................................ 26 2.6. Fare IgE Testi ................................................................................................. 27 2.7. Çalışmamızda Kullanılan Radyoaktif Olmayan ex vivo LLNA Yöntemi ile Sensitizasyon Potansiyelleri Tespit Edilecek Olan Kimyasal Maddeler ........... 29 2.7.1. 2,4-dinitroklorobenzen (DNCB) ............................................................ 29 2.7.2. Trimellitik anhidrit (TMA) .................................................................... 29 viii Sayfa 2.7.3. Diasetil.................................................................................................. 30 2.8. Alternatif in vitro ve in siliko Yöntemler ......................................................... 33 2.8.1. İn siliko testler ....................................................................................... 34 2.8.2. İn chemico testler .................................................................................. 34 2.8.3. Hücresel testler...................................................................................... 34 3. GEREÇ VE YÖNTEM .................................................................................... 37 3.1. Kimyasallar .................................................................................................... 37 3.1.1. Topik uygulanan negatif kontrol ............................................................ 37 3.1.2. Topik uygulanan pozitif kontrol ............................................................ 37 3.1.3. Topik uygulanan test materyali .............................................................. 37 3.1.4. Diğer kimyasallar .................................................................................. 37 3.2. Kullanılan Alet ve Malzemeler........................................................................ 38 3.3. Deney Hayvanı ............................................................................................... 38 3.4. Lenfosit Proliferasyonunun Lenf Düğümü Hücrelerinde BrdU ile ex vivo Ölçümü ........................................................................................................... 39 3.4.1. Kısa süreli maruziyet ............................................................................. 39 3.4.2. Kronik maruziyet .................................................................................. 39 3.5. ELISA Yöntemi ile Sitokin ve IgE Antikoru Analizlerinin Temel Prensibi...... 41 3.6. Ex vivo BrdU Katım Yöntemi Uygulanarak Elde Edilen Lenfosit Kültürlerinde Sitokin Düzeylerinin Ölçümü .................................................... 41 3.6.1. IFN-γ ölçümü ........................................................................................ 41 3.6.2. IL-2 ölçümü .......................................................................................... 42 3.6.3. IL-4 ölçümü .......................................................................................... 43 3.6.4. IL-5 ölçümü .......................................................................................... 44 3.6.5. IL-10 ölçümü ........................................................................................ 45 3.6.6. IL-13 ölçümü ........................................................................................ 46 3.7. Kardiyak Ponksiyon İşlemi ile Elde Edilen Kanda IgE Ölçümü....................... 47 ix Sayfa 3.8. İstatistiksel Analizler ...................................................................................... 48 4. BULGULAR ve YORUM .............................................................................. 49 4.1. Radyoaktif Olmayan ex vivo LLNA Yöntemi ile Kimyasalların Kısa Süreli Maruziyet Sonrası Alerji Potansiyellerinin Ölçülmesi ile İlgili Deney Sonuçları ........................................................................................................ 49 4.1.1. DNCB için stimülasyon indeksinin (SI) hesaplanması ........................... 51 4.1.2. TMA için stimülasyon indeksinin (SI) hesaplanması ............................. 51 4.1.3. Diasetil için stimülasyon indeksinin (SI) hesaplanması .......................... 51 4.2. DNCB, TMA ve Diasetil Uygulanan Farelerin Kısa Süreli Maruziyet Sonrası Kulak Arkası Lenf Düğümlerinden Elde Edilen Lenfosit Hücre Kültürlerinde Sitokin Düzeylerinin Ölçümü .......................................................................... 52 4.2.1. IFN-γ ölçümü ........................................................................................ 52 4.2.2. IL-2 ölçümü .......................................................................................... 55 4.2.3. IL-4 ölçümü .......................................................................................... 56 4.2.4. IL-5 ölçümü .......................................................................................... 59 4.2.5. IL-10 ölçümü ........................................................................................ 61 4.2.6. IL-13 ölçümü ........................................................................................ 62 4.3. DNCB, TMA ve Diasetil Uygulanan Farelerin Kısa Süreli Maruziyet Sonrası Total Serum IgE Konsantrasyonunun Ölçümü ................................................ 64 4.4. Radyoaktif Olmayan ex vivo LLNA Yöntemi ile Kimyasalların Kronik Maruziyet Sonrası Alerji Potansiyellerinin Ölçülmesi ile İlgili Deney Sonuçları ........................................................................................................ 67 4.4.1. DNCB için stimülasyon indeksinin (SI) hesaplanması ........................... 69 4.4.2. TMA için stimülasyon indeksinin (SI) hesaplanması ............................. 69 4.4.3. Diasetil için stimülasyon indeksinin (SI) hesaplanması .......................... 69 4.5. DNCB, TMA ve Diasetil Uygulanan Farelerin Kronik Maruziyet Sonrası Kulak Arkası Lenf Düğümlerinden Elde Edilen Lenfosit Hücre Kültürlerinde Sitokin Düzeylerinin Ölçümü .......................................................................... 70 4.5.1. IFN-γ ölçümü ........................................................................................ 70 4.5.2. IL-2 ölçümü .......................................................................................... 72 x Sayfa 4.5.3. IL-4 ölçümü .......................................................................................... 74 4.5.4. IL-5 ölçümü .......................................................................................... 76 4.5.5. IL-10 ölçümü ........................................................................................ 78 4.5.6. IL-13 ölçümü ........................................................................................ 80 4.6. DNCB, TMA ve Diasetil Uygulanan Farelerin Kronik Maruziyet Sonrası Total Serum IgE Konsantrasyonunun Ölçümü ................................................ 82 5. TARTIŞMA ....................................................................................................... 85 6. SONUÇ ve ÖNERİLER .................................................................................. 97 KAYNAKLAR .......................................................................................................... 99 EKLER ...................................................................................................................... 109 EK-1. Hayvan deneyleri yerel etik kurul onayı ........................................................... 110 ÖZGEÇMİŞ ............................................................................................................... 112 xi ÇİZELGELERİN LİSTESİ Çizelge Sayfa Çizelge 4.1. DNCB’ye kısa süreli maruziyet sonucu ex vivo yöntemle tespit edilen OD450 sonuçları....................................................................................... 49 Çizelge 4.2. TMA’ya kısa süreli maruziyet sonucu ex vivo yöntemle tespit edilen OD450 sonuçları ...................................................................................... 49 Çizelge 4.3. Diasetile kısa süreli maruziyet sonucu ex vivo yöntemle tespit edilen OD450 sonuçları ...................................................................................... 50 Çizelge 4.4. Çözücüye kısa süreli maruziyet sonucu ex vivo yöntemle tespit edilen OD450 sonuçları ...................................................................................... 50 Çizelge 4.5. DNCB’ye kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IFN-γ düzeyleri ............ 53 Çizelge 4.6. TMA’ya kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IFN-γ düzeyleri ............ 53 Çizelge 4.7. Diasetile kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IFN-γ düzeyleri ............ 53 Çizelge 4.8. Çözücüye kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IFN-γ düzeyleri ............ 54 Çizelge 4.9. DNCB’ye kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-2 düzeyleri .............. 55 Çizelge 4.10. TMA’ya kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-2 düzeyleri ............ 55 Çizelge 4.11. Diasetile kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-2 düzeyleri ............ 55 Çizelge 4.12. Çözücüye kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-2 düzeyleri .............................................................................................. 56 Çizelge 4.13. DNCB’ye kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-4 düzeyleri .............................................................................................. 57 Çizelge 4.14. TMA’ya kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-4 düzeyleri ............ 57 Çizelge 4.15. Diasetile kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-4 düzeyleri ............ 57 xii Çizelge Sayfa Çizelge 4.16. Çözücüye kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-4 düzeyleri .............................................................................................. 58 Çizelge 4.17. DNCB’ye kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-5 düzeyleri .............................................................................................. 59 Çizelge 4.18. TMA’ya kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-5 düzeyleri ............ 59 Çizelge 4.19. TMA’ya kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-5 düzeyleri ............ 60 Çizelge 4.20. Çözücüye kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-5 düzeyleri .............................................................................................. 60 Çizelge 4.21. DNCB’ye kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-10 düzeyleri .............................................................................................. 61 Çizelge 4.22. TMA’ya kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-10 düzeyleri .......... 61 Çizelge 4.23. Diasetile kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-10 düzeyleri .......... 61 Çizelge 4.24. Çözücüye kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-10 düzeyleri .............................................................................................. 62 Çizelge 4.25. DNCB’ye kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-13 düzeyleri .............................................................................................. 63 Çizelge 4.26. TMA’ya kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-13 düzeyleri .......... 63 Çizelge 4.27. Diasetile kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-13 düzeyleri .......... 63 Çizelge 4.28. Çözücüye kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-13 düzeyleri .............................................................................................. 64 Çizelge 4.29. DNCB’ye kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IgE düzeyleri .............................................................................................. 65 xiii Çizelge Sayfa Çizelge 4.30. TMA’ya kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IgE düzeyleri ............. 65 Çizelge 4.31. Diasetile kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IgE düzeyleri ............. 65 Çizelge 4.32. Çözücüye kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IgE düzeyleri .............................................................................................. 66 Çizelge 4.33. DNCB’ye kronik maruziyet sonucu ex vivo yöntemle tespit edilen OD450 sonuçları..................................................................................... 67 Çizelge 4.34. TMA’ya kronik maruziyet sonucu ex vivo yöntemle tespit edilen OD450 sonuçları............................................................................................... 67 Çizelge 4.35. Diasetile kronik maruziyet sonucu ex vivo yöntemle tespit edilen OD450 sonuçları............................................................................................... 68 Çizelge 4.36. Çözücüye kronik maruziyet sonucu ex vivo yöntemle tespit edilen OD450 sonuçları..................................................................................... 68 Çizelge 4.37. DNCB’ye kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IFN-γ düzeyleri .......... 70 Çizelge 4.38. TMA’ya kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IFN-γ düzeyleri .......... 70 Çizelge 4.39. Diasetile kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IFN-γ düzeyleri .......... 71 Çizelge 4.40. Çözücüye kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IFN-γ düzeyleri .......... 71 Çizelge 4.41. DNCB’ye kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-2 düzeyleri ............ 72 Çizelge 4.42. TMA’ya kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-2 düzeyleri ............ 72 Çizelge 4.43. Diasetile kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-2 düzeyleri ............ 73 Çizelge 4.44. Çözücüye kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-2 düzeyleri ............ 73 Çizelge 4.45. DNCB’ye kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-4 düzeyleri ............ 74 xiv Çizelge Sayfa Çizelge 4.46. TMA’ya kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-4 düzeyleri ............ 74 Çizelge 4.47. Diasetile kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-4 düzeyleri ............ 75 Çizelge 4.48. Çözücüye kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-4 düzeyleri ............ 75 Çizelge 4.49. DNCB’ye kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-5 düzeyleri ............ 76 Çizelge 4.50. TMA’ya kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-5 düzeyleri ............ 76 Çizelge 4.51. Diasetile kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-5 düzeyleri ............ 77 Çizelge 4.52. Çözücüye kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-5 düzeyleri ............ 77 Çizelge 4.53. DNCB’ye kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-10 düzeyleri .......... 78 Çizelge 4.54. TMA’ya kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-10 düzeyleri .......... 78 Çizelge 4.55. Diasetile kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-10 düzeyleri .......... 79 Çizelge 4.56. Çözücüye kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-10 düzeyleri .......... 79 Çizelge 4.57. DNCB’ye kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-13 düzeyleri .......... 80 Çizelge 4.58. TMA’ya kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-13 düzeyleri .......... 80 Çizelge 4.59. Diasetile kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-13 düzeyleri .......... 81 Çizelge 4.60. Çözücüye kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-13 düzeyleri .......... 81 Çizelge 4.61. DNCB’ye kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IgE düzeyleri ............. 82 Çizelge 4.62. TMA’ya kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IgE düzeyleri ............. 82 xv Çizelge Sayfa Çizelge 4.63. Diasetile kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IgE düzeyleri ............. 82 Çizelge 4.64. Çözücüye kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IgE düzeyleri ............. 83 xvi ŞEKİLLERİN LİSTESİ Şekil Sayfa Şekil 3.1. ELISA yöntemi ile sitokin ve antikoru ölçümü. .......................................... 41 Şekil 3.2. IFN-γ miktarının ölçümünde kullanılan standart doğru denklemi ................ 42 Şekil 3.3. IL-2 miktarının ölçümünde kullanılan standart doğru denklemi .................. 43 Şekil 3.4. IL-4 miktarının ölçümünde kullanılan standart doğru denklemi .................. 44 Şekil 3.5. IL-5 miktarının ölçümünde kullanılan standart doğru denklemi .................. 45 Şekil 3.6. IL-10 miktarının ölçümünde kullanılan standart doğru denklemi................. 46 Şekil 3.7. IL-13 miktarının ölçümünde kullanılan standart doğru denklemi................. 47 Şekil 3.8. IgE miktarının ölçülmesinde kullanılan standart doğru denklemi ................ 48 Şekil 4.1. Kısa süreli maruziyet sonucu lenfosit proliferasyonu ölçümü (OD450) ....... 51 Şekil 4.2. Kısa süreli maruziyet sonrası kimyasallar tarafından indüklenen IFN-γ miktarı........................................................................................................ 54 Şekil 4.3. Kısa süreli maruziyet sonrası kimyasallar tarafından indüklenen IL-2 miktarı........................................................................................................ 56 Şekil 4.4. Kısa süreli maruziyet sonrası kimyasallar tarafından indüklenen IL-4 miktarı........................................................................................................ 58 Şekil 4.5. Kısa süreli maruziyet sonrası kimyasallar tarafından indüklenen IL-5 miktarı........................................................................................................ 60 Şekil 4.6. Kısa süreli maruziyet sonrası kimyasallar tarafından indüklenen IL-10 miktarı........................................................................................................ 62 Şekil 4.7. Kısa süreli maruziyet sonrası kimyasallar tarafından indüklenen IL-13 miktarı........................................................................................................ 64 Şekil 4.8. Kısa süreli maruziyet sonrası kimyasallar tarafından indüklenen IgE miktarı........................................................................................................ 66 Şekil 4.9. Kronik maruziyet sonucu lenfosit proliferasyonu ölçümü (OD450) ............. 69 Şekil 4.10. Kronik maruziyet sonrası kimyasallar tarafından indüklenen IFN-γ miktarı ..................................................................................................... 71 Şekil 4.11. Kronik maruziyet sonrası kimyasallar tarafından indüklenen IL-2 miktarı. 73 Şekil 4.12. Kronik maruziyet sonrası kimyasallar tarafından indüklenen IL-4 miktarı. 75 xvii Şekil Sayfa Şekil 4.13. Kronik maruziyet sonrası kimyasallar tarafından indüklenen IL-5 miktarı. 77 Şekil 4.14. Kronik maruziyet sonrası kimyasallar tarafından indüklenen IL-10 miktarı ..................................................................................................... 79 Şekil 4.15. Kronik maruziyet sonrası kimyasallar tarafından indüklenen IL-13 miktarı ..................................................................................................... 81 Şekil 4.16. Kronik maruziyet sonrası kimyasallar tarafından indüklenen IgE miktarı .. 83 1 1. GİRİŞ İşyeri ortamında alerji potansiyeli taşıyan kimyasallara maruziyet önemli bir mesleki aşırı duyarlılık hastalığı nedenidir. Endüstriyel sektördeki çeşitli kimyasallar arasında yer alan koku verici bileşenler, metal tuzları, halojenli aromatik bileşikler gibi düşük molekül ağırlığına sahip kimyasalların T lenfositleri aracılı gecikmiş tip aşırı duyarlılık reaksiyonu olan alerjik temas dermatitini indükleme kapasitesine sahip olduğu bilinmektedir (Goutet, Pépin, Langonné, Huguet ve Ban, 2012). Yaklaşık 4000 adet kimyasalın temas sensitizasyonu oluşturma potansiyeline sahip olduğu kabul edilir ve bu kimyasallardan sadece 100 kadarı insan yama testlerinde verdiği pozitif yanıta göre teşhis edilmektedir. Temas sensitizasyonu bireyin yaşam kalitesini ve çalışma performansını ciddi derecede etkilemektedir. Son 100 yılda temas sensitizasyon problemi alerjen özellikteki kimyasalların tüketiciye sunulması ve mesleki ürünlere sokulması ile ciddiyet kazanmıştır (Thyssen, Giménez-Arnau, Lepoittevin, Menné, Boman ve Schnuch, 2012). Amerika Birleşik Devletleri’nde kapalı iş yeri ortamlarında çalışan 89 milyon işçiden 60 milyonu göz, burun ve boğaz irritasyonu, baş ağrısı ve yorgunluk gibi belirtiler göstermektedir. Hastalık ve performans kayıplarına bağlı tahmini yıllık tutar 20-70 milyar dolar aralığındadır. Bu şikayetlerin nedeni hem biyolojik hem de kimyasal (uçucu organik bileşikler) maruziyetine atfedilmiştir. Bu nedenle, kapalı mekanda bulunan gaz halindeki kimyasallara maruziyetin araştırılmasına yönelik çalışmalar hız kazanmıştır (Anderson, Wells, Fedorowicz, Butterworth, Meade ve Munson, 2007). Bilinen çok sayıda temas sensitizanı ile kıyaslandığında, genellikle IgE aracılı Th2 solunum alerjisine yol açtığı bilinen kimyasalların listesi oldukça kısadır. Ancak endüstriyel ülkelerde asit anhidritler ve izosiyanatlar gibi düşük molekül ağırlığındaki kimyasallar mesleki astım vakalarının %40’ından sorumludur. Dahası, astımın zaman geçtikçe ölümcül olabilen akciğer hasarına yol açması nedeniyle işçiler için büyük bir risk teşkil etmektedir (Goutet ve diğerleri, 2012). Klinik araştırmalar yetişkin astım vakalarının %20’sinin mesleki etmenlerden kaynaklandığını, bunların da %90’ının immünolojik mekanizmaları içerdiğini göstermektedir. Ayrıca, mesleki astım gelişmiş ülkelerde en yüksek prevalansa sahip mesleki akciğer hastalıklarının başında gelir. Bu nedenle, solunum veya dermal alerji potansiyeli taşıyan kimyasalların tam olarak belirlenmesi ve bunların karakterizasyonu endüstriyel toksikoloji alanında mesleki güvenlik adına önemli bir 2 araştırma konusunu oluşturmaktadır (Boverhof, Billington, Gollapudi, Hotchkiss, Krieger, Poole, Wiescinski ve Woolhiser, 2008; Goutet ve diğerleri, 2012). Diasetil (2,3-bütandion) gıdalara tereyağı tadı ve kokusu vermek amacıyla kullanılan hoş koku verici kimyasal bir maddedir (Parmet ve Von Essen, 2002). Diasetilin tehlike olarak görülmesi ilk olarak 2000 yılında ABD’deki bir mikrodalga patlamış mısır üretim tesisinde çalışan işçilerin yüksek miktarda diasetile maruz kalması ile gerçekleşmiştir. Diasetil inhalasyonu sonucu işçilerde geri dönüşümsüz, bronşiyollerde inflamasyon ve yaralara neden olan akciğer hastalığı (Potera, 2012) bronşiyolitis obliterans semptomları gözlenmiştir. Ayrıca epidemiyolojik çalışmalar diasetile maruz kalan işçilerde astımın iki kat daha fazla görüldüğünü ortaya koymuştur (Anderson ve diğerleri, 2007). Bunun üzerine National Institute for Occupational Safety and Health (NIOSH) tarafından patlamış mısırda kullanılan tereyağı tatlandırıcısı ile oluşabilecek akciğer hastalığının araştırılması sonucu düzenleyici otoriteler tarafından işyeri ortamı havasındaki diasetilin güvenilir seviyeleri için kısıtlama getirilmesi amaçlanmıştır (Shibamoto, 2014). Kimyasalların sahip olduğu temas alerjisi potansiyelinin belirlenmesine yönelik valide edilmiş Lokal Lenf Düğümü Testi (LLNA) kullanılırken, solunum sensitizasyonunu indükleyen kimyasalların ileriye dönük belirlenmesi için bir model henüz bulunmamaktadır (Vangosa, Braun, Cookman, Hofmann, Kimber, Loveless, Morrow, Pauluhn, Sorensen ve Niessen, 1994). LLNA’nın dermal temasla ilgili olmasına karşın solunum alerjenleri için uygulanabilir olduğu gösterilmiştir (Kimber, Agius, Basketter, Corsini, Cullinan, Dearman, Gimenez-Arnau, Greenwell, Hartung, Kuper, Maestrelli, Roggen ve Rovida, 2007; 7. Arts, De Jong, Van Triel, Schijf, De Klerk, Van Loveren ve Kuper, 2008; Isola, Kimber, Sarlo, Lalko ve Sipes, 2008). Diğer hayvan deneyleri ile kıyaslandığında daha az deney hayvanı ile çalışılması, hem alerjik reaksiyonların çok şiddetli olmaması hem de uygulama süresince hayvanlara daha az acı verilmesi, hayvan deneylerine ait mevzuatlara ve test rehberlerine (OECD Organization for Economic Cooperation and Development, ICATM - International Cooperation on Alternative Test Methods) giren 3R yaklaşımı açısından LLNA alternatif bir yöntem olarak kabul görmüştür. Sensitizasyon için günümüzde valide olan tek yöntem LLNA’dır (ICCVAM, 1999; Rovida, 2011). Son zamanlarda bu metod, Avrupa 3 Birliği’ndeki yeni REACH regülasyonu ile ilk ihtiyaç duyulan sensitizasyon testi haline gelmiştir (Anderson ve diğerleri, 2011). Ancak LLNA sonuçları immün yanıtların tetiklenip tetiklenmediğini gösterirken, solunum veya temas alerjisine ait spesifik mekanizmaları birbirinden ayırt edemez (Vanoirbeek et al, 2003; Boverhof et al, 2008). Bu nedenle LLNA ile birlikte kimyasalların indüklediği sitokin profillerinin de ortaya konması ile solunum sensitasyonunun alerjik temas dermatitinden ayırt edilmesi sağlanmaktadır (Vandebriel ve diğerleri, 2011). Diasetilin toksisitesine ve risk değerlendirmesine ilişkin yeterli sayıda inceleme mevcut değildir (Shibamoto, 2014). Kimyasal alerjenlerin sitokin salım profillerine göre sınıflandırılmasının mümkün olduğu öne sürülmektedir. Bu gerekçelerle çalışmamızda dermal maruziyet ile solunum sensitizasyonu potansiyeline sahip olduğu düşünülen diasetilin, kontrol gruplarını oluşturan solunum sensitizanı trimellitik anhidrit ve temas sensitizanı 2,4-dintiroklorobenzenin eş zamanlı uygulaması sonucu indüklenen sitokin profilleri ile karşılaştırmalı olarak (Kimber, Hilton, Basketter ve Dearman, 1996) T hücre yanıtını ve sitokin profilini ortaya koyma ihtiyacı duyduk. Bu yaklaşımın sınırlı sayıda sensitizanla denenmiş olmasına karşın (Goutet ve diğerleri, 2012) kimyasal solunum alerjenlerinin karakterizasyonunu sağlayacağı gibi, bu alerjenlerin işçi sağlığına yönelik taşıdığı riskin değerlendirilmesi adına güvenilir bir yaklaşım olduğunun göz ardı edilmemesi ve yöntemin validasyonu için daha fazla araştırmanın yapılması gerektiğini düşünüyoruz. Kimyasalların sensitizasyon özelliklerinin bilinmesi, kamu ve sanayiye yönelik güvenli ürünlerin pazarlanmasına imkan tanır. Ayrıca ürünlerin sınıflandırılması ve etiketlenmesinde bilimsel basamağı oluşturmaktadır (Thyssen ve diğerleri, 2012). Çalışmamızda son yıllarda hem işçi sağlığı hem de tüketici sağlığı açısından oluşturduğu riskler göz önünde bulundurulduğunda gıda katkı maddesi olarak kullanılması tartışılan diasetilin sensitizasyon potansiyelini hayvan refahı gözetilerek modifiye edilen LLNA yöntemi ile araştırmayı, farelerde tutarlı ve kıyaslanabilir sitokin sentezi yanıtlarının indükleyip indüklemediğini değerlendirmeyi ve olası indüklenmiş sitokin üretiminin diasetilin sensitizan karakterinin aydınlatılması için gerçekçi bir yaklaşım olup olmadığını ortaya koymayı amaçladık. 4 5 2. GENEL BİLGİLER 2.1. Aşırı Duyarlılık Reaksiyonları Bağışıklık sistemi enfeksiyonlara karşı savunmada konak için gerekli iken, immün yanıtın kendisi de doku hasarına ve hastalıklara neden olabilmektedir. Aşırı duyarlılık reaksiyonları immün yanıtın yol açtığı bu bozukluklar arasında yer alır (Abbas ve Lichtman, 2007). Alerji, antijene karşı verilen immün yanıtın ardından ortaya çıkan advers durum olup, doku hasarıyla sonuçlanan aşırı duyarlılık reaksiyonlarının bir çeşididir (Boverhof ve diğerleri, 2008). İmmünotoksikoloji açısından alerji, ilaçlara ve kimyasallara karşı gelişen spesifik immün yanıttan kaynaklanmaktadır (Van Loveren ve Vos, 2011). Alerjik reaksiyonlar çok çeşitli şekillerde oluşum gösterirler. Aşırı duyarlılık hastalıkları, doku hasarı ve hastalıktan sorumlu olan temel immünolojik mekanizmalara göre sınıflandırılırlar. Aşırı duyarlılık yanıtları Tip I, II, III ve IV olmak üzere başlıca dört sınıf altında incelenir (Abbas ve Lichtman, 2007). Kimyasalların yol açtığı alerjik reaksiyonlar iki aşamada gerçekleşir. Doğuştan duyarlı bireyde uygun maruziyet yolu aracılığı ile uygun miktarda kimyasal alerjenle ilk karşılaşmayı takiben “sensitizasyon” ile sonuçlanan edinilmiş immün yanıtlar oluşacaktır. Bu şekilde duyarlanmış bireyin, aynı kimyasal alerjene (miktar ve maruziyet bölgesine bağlı olarak) bir sonraki maruziyetinde, klinik açıdan alerjik reaksiyon olarak tanımlanan inflamasyonla sonuçlanan daha şiddetli sekonder immün yanıtlar tetiklenir. Duyarlılaştırılmış bireyde alerjenle indüklenen inflamatuar reaksiyonların gelişimi “ortaya çıkma” fazı olarak tanımlanır (Kimber, Basketter, Gerberick, Ryan ve Dearman, 2011). Bir kimyasalın bireyleri duyarlı hale getirme kabiliyeti genellikle bu kimyasalların vücut proteinlerine kovalent olarak bağlanması ile ilişkilidir (Van Loveren ve Vos, 2011). Çevremizde karşılaştığımız birçok madde immün yanıtı tetikleyebilmektedir. Bu maddeler için en önemli gereksinim proteinlerle kompleks oluşturma ihtiyacıdır (Kimber ve Dearman, 2005). Polen, enzimler gibi çevreden veya mesleki ortamdan maruz kalınan proteinleri içeren 1000 Dalton’dan (Da) büyük molekül ağırlığına sahip bileşikler immün 6 sistemle etkileşerek doğrudan immün yanıtı uyarabilirler. 1000 Da’dan küçük molekül ağırlığına sahip kimyasallar ise doğrudan immün sistem tarafından tanınmak için çok küçük yapıdadırlar ve hapten olarak etki ederler. Haptenler immün yanıt oluşturmak için öncelikle doğrudan veya dolaylı yoldan proteinlerle etkileşmek zorundadırlar (Holsapple, Jones, Kawabata, Kimber, Sarlo, Selgrade, Shah ve Woolhiser, 2006). Kimyasal alerjenler için ikinci gereksinim uygun doku kompartmanına geçişleridir. Hem temas hem de solunum alerjenleri için varsayım, hedef dokunun epitelyum olduğudur. Temas alerjenleri için epidermis iken, solunum alerjenleri için epidermis veya solunum epitelyumudur. Canlı epidermise erişim stratum korneumun başarılı bir şekilde geçişini gerektirirken, solunum bölgesinin epitelyumunu koruyan böyle bir bariyer mevcut değildir (Kimber and Dearman, 2005). Düşük molekül ağırlığındaki kimyasal alerjenlerin immün sistem tarafından yabancı olarak tanınıp immün yanıtı başlatmaları için protein-kimyasal kompleksi oluşturmaları gerekmektedir (Roggen ve diğerleri, 2008). Bu kompleksler immün sistemin diğer hücrelerine antijen sunan hücreler tarafından sunulmak üzere işlenir. Primer immün yanıtları başlatan en etkili hücreler dendritik hücrelerdir (Viola ve diğerleri, 1999). Antijene cevaben, spesifik B lenfositleri bölünerek spesifik IgE antikoru salgılayan plazma hücrelerine farklılaşmak üzere stimüle edilirler. Alerjik reaksiyonlar gibi immün yanıtların gelişimi CD4+ yardımcı T (Th) lenfositlerin ve bu hücrelerin sitokin ürünlerinin aktivitesi ile yönetilir. İmmün yanıtta Th1 ve Th2 olarak gösterilen iki tip Th hücre fenotipi baskındır ve salgıladıkları sitokinlerin fonksiyonlarına göre ayrılırlar (Abbas, Murphy ve Sher, 1996). Her iki hücre popülasyonu da granülosit/makrofaj-koloni stimüle edici faktör (GM-CSF) salgılarken, Th1 hücreleri interferon-γ (IFN-γ) ve tümör nekroz faktör-β (TNFβ) eksprese eder. Th2 hücreleri ise interlökin 4 (IL-4), IL-5, IL-10 ve IL-13 eksprese eder. Th hücrelerinin fonksiyonel alt grupları, farklı nitelikte immün yanıtların gelişmesinde etkilidir (Dearman, Betts, Humphreys, Flanagan, Gimour, Basketter ve Kimber, 2003a). Th1 hücreleri hücre aracılı bağışıklığın sağlanmasından sorumlu iken, Th2 hücreleri hümoral immün fonksiyonunda önemli olan B lenfositlerin kostimülasyonunu ve farklılaşmasını başlatan sitokinleri üretirler (Abbas ve diğerleri, 1996). Th hücrelerinin bu fonksiyonel ikililiği alerjik hastalıkların gelişimi ve ortaya çıkması ile bağlantılıdır (Dearman ve diğerleri, 2003a). 7 Temas duyarlılığı veya deri alerjisi ve solunum bölgesinin alerjisi mesleki sağlıkla yakından ilişkili kimyasal alerjilerin iki tipini oluşturmaktadır. Özellikle alerjik astım ve alerjik temas dermatiti gibi aşırı duyarlılık reaksiyonları endüstrileşmiş ülkelerde önemli mesleki sağlık problemleri arasındadır (Van Loveren ve Vos, 2011). Temas alerjenleri deri sensitizasyonunu ve alerjik temas dermatitini indüklerken, solunum alerjenleri solunum bölgesinin sensitizasyonunu stimüle ederler (Kimber ve diğerleri, 2011). Sensitizasyonun bu heterojenliği sadece maruziyet yolu farklılığına atfedilemez. Alerjenik kimyasallar, elektrofilik ve düşük molekül ağırlığında olmaları gibi pek çok bakımdan benzerlik gösterirlerken farklı tiplerde alerjik sensitizasyon oluşturabilirler (Kimber and Dearman, 2002, 2005). Deri sensitizanı kimyasalları ve solunum bölgesinin sensitizasyonuna neden olan kimyasallara ilişkin düşünülen, CD4+ T lenfosit alt gruplarının yanıtları ile karakterize farklı nitelikte immün yanıtları ortaya çıkardıklarıdır. Özellikle fareler üzerinde yapılan deneylerle temas alerjenlerine tekrarlayan maruziyetin Th1 tipi immün yanıtlara neden olduğu, solunum alerjenlerin ise Th2 tip yanıtlarla ilişkili olduğunun gösterilmesi bu teoriyi desteklemiştir (Kimber and Dearman, 1998; Dearman, Humphreys, Skinner, ve Kimber, 2005; Kimber, Basketter, Thyssen, Dearman ve McFadden, 2014). 2.1.1. Temas aşırı duyarlılığı ve klinik sonucu alerjik temas dermatiti Alerjik hastalıklar günümüzde çok ciddi çevresel ve mesleki sağlık sorunu olarak göze çarpmaktadır. Alerjik temas dermatiti en sık bildirilen mesleki rahatsızlıklarda ikinci sırada yer alıp tüm mesleki hastalıkların %10-15’ini oluşturmaktadır. İşçi üretkenliğinde azalışa neden olan mesleki dermal hastalıklar yılda yaklaşık 1 milyar dolar sosyoekonomik kayba yol açmaktadır (Anderson ve diğerleri, 2011). Temas dermatiti dış ortamdaki ajanlar tarafından indüklenen deri inflamasyonudur. Deri insan vücudunun en dış bariyeri olmasından dolayı çevreden gelen kimyasal ve fiziksel faktörlerle karşılaşan ilk organdır (Saint-Mezard, Rosieres, Krasteva, Berard, Dubois, Kaiselian ve Nicolas, 2004). Bariyer fonksiyonunun yanında immünolojik açıdan aktif doku olarak da görev yapar. Langerhans hücreleri epidermisteki hücre popülasyonunun %2-5’ini oluşturan kemik iliği kaynaklı dendritik hücrelerdir ve deride başlıca antijen 8 sunan hücrelerdir. Keratinositler ise epidermiste bulunan başlıca hücre tipi olup özgül olmayan eksojen uyaranları sitokin moleküllerinin üretimine dönüştürerek sinyal dönüştürücüsü olarak görev yapar (Van Och, 1971). Deri sensitizasyonu mesleki ve çevresel sağlık kapsamında kimyasalların yol açtığı en önemli alerjik hastalıklardan biridir ve temas aşırı duyarlılığı olarak da bilinir. Temas aşırı duyarlılığı çeşitli kimyasal ve ilaçlar, kozmetikler ve çeşitli metallere maruziyet sonucu oluşabilmektedir (Van Och, Van Loveren, De Jong ve Vandebriel, 2002). Temas aşırı duyarlılığı doğuştan kaynaklanmaz; fakat her zaman için önceden kutanöz bir temas sonucu gerçekleşir. Temas aşırı duyarlılığına sahip bireylerde alerjene birkaç gün içinde doğrudan maruziyet sonucu dermatit gelişir ve epidermisteki mononükleer hücrelerin perivasküler inflamatuar infiltrasyonu ile karakterizedir. Sertlik ve ödem oluşumu ile birlikte artan damar geçirgenliği ve kızarıkla sonuçlanan vazodilatasyon inflamasyonun belirtilerindendir (Van Och ve diğerleri, 2002). Temas aşırı duyarlılığı, deri immün sisteminin anormal yanıtının neden olduğu gecikmiş tip IV aşırı duyarlılık reaksiyonudur ve T lenfositlerin dermis ve epidermise infiltrasyonu ile karakterizedir. Tip IV gecikmiş aşırı duyarlılık yanıtları maruziyeti takip eden 24-72 saat içerisinde daha önceden duyarlanmış bireylerde gözlenir (Manetz ve Meade, 1999). Temas alerjenleri genellikle oldukça düşük molekül ağırlığına sahip (>500 Da), yağda çözünebilen ve immün sistem tarafından doğrudan tanınmayan hapten yapısındadırlar (Van Och ve diğerleri, 2002). Temas aşırı duyarlılığın oluşması için üç eleman gereklidir: Antijen sunan dendritik hücreler (Langerhans hücreleri), haptene özgü T lenfositleri ve haptenin kendisi (SaintMezard ve diğerleri, 2004). Deride uyarılmış immün cevapların gelişebilmesi için kimyasal alerjenin öncelikle epidermise ulaşması gereklidir. Bu durum kimyasalın stratum korneumdan geçebilmesini gerektiren fizikokimyasal özelliklerine bağlıdır. Epidermise geçiş gerçekleştikten sonra protein-kimyasal kompleksleri oluşur. Bu epidermal Langerhans hücrelerinin sorumluluğundadır. Langerhans hücrelerinin edinilmiş immün sistemdeki görevleri antijeni tanımak, afferent lenf kanalları ile bölgesel lenf düğümlerine antijeni taşımaktır. 9 Langerhans hücrelerinin deriden hareketi ve lenf düğümleri içine lokalizasyonu epidermal sitokinler tarafından başlatılır ve kontrol edilir (Cumberbatch, Dearman, Griffiths ve Kimber, 2000; Kimber ve diğerleri, 2000). Langerhans hücrelerinin yer değiştirilmesinde rol oynayan sitokinler tümör nekroz edici faktör alfa (TNF-α) ve IL-1β’dır (Cumberbatch ve diğerleri, 2000). Ayrıca IL-10’un zıt regülasyonda rol oynadığı ve Langerhans hücrelerinin göçünü inhibe ettiğine dair veriler bulunmaktadır (Wang, Zhuang, Fujisawa, Shinder, Feliciani ve Shivji, 1999). Alerjenin etkili transportu ve sensitizasyonun kazanılması için uygun epidermal sitokinlerin indüklenmesini sağlayacak yeterli miktarda kimyasalın deriye uygulanması gerekir. İndüklenen inflamasyonun derecesi deri sensitizasyonun etkinliği, alerjenin gücü ve deri yüzeyine uygulanan kimyasalın miktarına bağlıdır. Bütün bu değişkenler uygun ise immünojenik stimülasyon, Langerhans hücrelerinin lenf düğümlerine hareketi ve T lenfositlerin cevabı ile gerçekleşir. Deri sensitizasyonun kazanılması özgül T lenfosit cevabının uyarılması ile olur. Topik uygulanan kimyasallar tarafından indüklenen lenf düğümlerinin proliferatif cevabının kuvveti ile sensitizasyonun geliştiği alan arasında korelasyon vardır (Dearman ve Kimber, 1991). Böylece daha sonra bahsedileceği üzere indüklenmiş lenf düğümü hücrelerinin proliferatif cevabının büyüklüğü ölçülerek alerjenlerin reaktif güçlerini tespit etmek mümkündür. Alerjik hastalıkların bütün tiplerinin genel bir özelliği olarak, temas alerjisi de iki fazda gerçekleşir. Bunlardan ilki alerjenle ilk teması içeren ve herhangi bir klinik belirti görülmeyen sensitizasyon fazı olup, ikincisi tekrar maruziyet sonrası insan ve farede sırasıyla 72. ve 24. saatte pik inflamatuar reaksiyonu ile dermatitle sonuçlanan ortaya çıkma fazıdır (Dhingra, Shemer, Da Rosa, Rozenblit, Suárez-Fariñas, Fuentes-Duculan, Gittler, Finney, Czarnowicki, Zheng, Xu, Estrada, Cardinale, Krueger ve Guttman-Yassky, 2014): 1.faz: Sensitizasyon (indüksiyon) fazı: Derinin hapten ile ilk temasını oluşturur ve lenf düğümlerinde haptene özgül T hücrelerinin oluşumuna ve bunların tekrar deriye göçüne sebep olur. Deriye giren antijenik özellik kazanan haptenler, epidermisteki doku makrofajları olan Langerhans hücreleri (antijen sunan hücreler) tarafından fagosite edilir. Lenf damarları ile dermise ve bölgesel lenf düğümlerine göç eden bu hücreler, antijenik molekülü, dermiste ve lenf bezlerinin parakortikal bölgesindeki naif T lenfositlere (Th0) 10 MHC (majör histocompatibilite kompleks) molekülleri aracılığı ile sunarlar (Saint-Mezard ve diğerleri, 2004). Naif T lenfositleri yabancı antijenleri arayıp bulmak için periferik lenfoid organlarda devamlı olarak dolaşırlar. Naif T hücreleri antijen tanımada rol oynayan antijen reseptörlerini eksprese ederler. Ancak naif T hücrelerinin fonksiyon gösterebilmeleri için efektör hücrelere dönüşmesi gerekir, bu süreç antijen tanınması ile başlamaktadır. Antijenik uyarım sonucu antijene özgül T hücreleri sitokinler salgılamaya başlar (Abbas ve Lichtman, 2007). Böylece lenfositlerde proliferasyon başlar ve deriye giren antijene özgül T lenfositler (klonlar) oluşur. Bu duyarlanmış lenfositler dolaşıma karışır, bir kısmı da dermise yerleşir. Bu olaylar zincirine “sensitizasyon fazı” denir. İnsanlarda yaklaşık olarak 2 hafta, farelerde 5-7 gün kadar bir süre içinde gerçekleşir. Haptenin sensitizasyonu indüklemesi iki farklı özelliğine dayanır: Proenflamatuar özelliğinin yanında hapten, derinin doğal bağışıklığını aktive eder ve dendritik hücrelerin olgunlaşmasını ve göçünü indükleyen sinyallerin oluşmasını sağlarlar (Saint-Mezard ve diğerleri, 2004). 2.faz: Ortaya çıkma (aktivasyon) fazı: Duyarlı bireyler aynı haptenle tekrar karşılaşınca, 24-72 saat içerisinde alerjik temas dermatiti oluşur. Hapten deriye difüze olduktan sonra, MHC sınıf I ve sınıf II molekülleri aracılığıyla hapten-peptid kompleksleri deri hücreleri tarafından içeri alınır. Organizma, aynı antijenle ikinci defa karşılaşacak olursa, deride duyarlı lenfositlerle antijenin birleşmesi sonucu sitokinler ortaya çıkar. Sitokinlere bağlı olarak bölgesel doku hasarı ve inflamasyon meydana gelir. Bu sitokinlerin başlıcaları; IL-1 (Langerhans hücrelerince salınır, T lenfositlerden IL-2 salınmasına yol açar), IL-2 (T lenfositlerden salgılanır, diğer T hücrelerini aktive eder), IFN-γ (T lenfositlerden salgılanır, sitotoksik T hücreleri, NK hücreleri ve makrofajları aktive eder). Sonuçta; epidermiste ödem (spongioz) ve vezikülasyon, dermiste ise inflamatuar infiltrat oluşur. Bu safhaya “ortaya çıkma fazı” denir. 24-72 saat içerisinde gerçekleştiğinden dolayı “gecikmiş tip IV alerjik reaksiyon” olarak adlandırılır. İnflamatuar reaksiyon birkaç gün sürer, daha sonra baskılayıcı mekanizmalar ile azalır (Saint-Mezard ve diğerleri, 2004). 11 İNDÜKSİYON FAZI ORTAYA ÇIKMA FAZI Aktive edilmiş T hücreleri LENF DÜĞÜMLERİ Yardımcı T hücreleri (Th) IL-2, IL-3, IL-4, IFN-γ Kemotaksi Damar geçirgenliği Hücresel infiltrasyon Bellek T lenfositleri Şekil 2.1. Temas aşırı duyarlılığın indüksiyon ve ortaya çıkma fazları (Van Och ve diğerleri, 2002) 2.1.2. Solunum sensitizasyonu Solunum sensitizasyonu, belirli bir antijen solunduğu zaman özellikle spesifik IgE antikoru varlığına bağlı olarak gelişen immun durumdur. Solunum alerjisi bu durumun klinik belirtisi olup, en önemli semptomları arasında bronşiyal astım ve yüksek ateşle seyreden rinit bulunur. Solunum alerjisinin bu formu hem yüksek hem de düşük molekül ağırlığına sahip kimyasallar tarafından oluşturulur. (Vangosa ve diğerleri, 1994). Solunum bölgesinin aşırı duyarlılık reaksiyonu terimi, sensitizan ajanların maruziyetinden kaynaklanan erken ve geç alerjik reaksiyonları, solunum yolu inflamasyonu ve solunum yolu aşırı duyarlılığı gibi çok çeşitli yanıtları ifade etmek için kullanılır. Sensitizanın tipi, maruziyet düzeyi ve tetiklenen yanıtın tipine bağlı olarak bu belirtilerin sadece bir kısmı gelişir. Mevcut hayvan modelleri patofizyolojik değişikliklerin sadece bir kısmını yansıtabilmektedir. Dolayısıyla akciğerlerdeki aşırı duyarlılık reaksiyonları çok etkenli olup, ilişkili mekanizmalar tamamıyla anlaşılabilmiş değildir (Roggen ve diğerleri, 2008). 12 İşyerinde düşük molekül ağırlığına sahip kimyasallara maruziyet, alerjik rinit ve mesleki astım gibi solunum bölgesi aşırı duyarlılık reaksiyonları (alerji) ile ilgili hastalıklarla ilişkilendirilmektedir. Mesleki astım dünya genelindeki astım vakalarının % 2-15’ini oluşturmaktadır. Mesleki astım hastane masrafları, işçi tazminatları ve çalışma saati kayıpları ile birlikte ABD’de yılda 400 milyon dolar zarara neden olmaktadır (Dearman ve diğerleri, 2013). Mesleki astım gelişmiş ülkelerde en sık görülen mesleki akciğer hastalıklarındandır. 250’den fazla maddenin mesleki astıma yol açtığı ve daha fazlasının gelecekte belirleneceği bilinmektedir. Mesleki astım işyerinde bulunan ajana maruziyetle ilişkili olarak geri dönüşümlü solunum yolu tıkanıklığı, solunum yolları inflamasyonu ve nonspesifik solunum yolu hiperaktivitesi ile karakterizedir (Vanoirbeek ve diğerleri, 2006). Solunum alerjisine neden olduğu bilinen kimyasallar izosiyanatlar (toluen diizosiyanat), asit anhidritler (trimellitik anhidrit - TMA), reaktif boyalar, platin tuzları ve glutaraldehittir (Vanoirbeek ve diğerleri, 2006). Solunum alerjisinin gelişimi de alerjik temas dermatitinin oluşumu gibi iki aşamadan oluşmaktadır. Bunlardan ilki sensitizasyon evresi olup, immün durumun gelişimini kapsar. İkincisi ise alerjinin klinik dışavurumu ile sonuçlanan ortaya çıkma evresidir. Sonuç olarak, önceden maruz kalmamış (naif) ancak duyarlı bireyler alerjik protein veya kimyasala ilk maruziyet anında alerjik belirtileri göstermezler. En az iki maruziyet gerekirken bazı durumlarda haftalarca veya aylarca süren tekrarlanan maruziyeti de gerektirebilir. Bunu duyarlanmış bireyin sonradan aynı bileşiğe tekrar maruz kalması ile alerjinin gerçek anlamda ortaya çıkması takip eder. Alerjik reaksiyonun yapısı ve ciddiyeti, sensitizasyon ve ortaya çıkma fazı boyunca alerjen maruziyet yolu, süresi ve dozunun yanı sıra bireyin genetik altyapısı, alerjenin özellikleri gibi çok sayıda faktöre bağlıdır (Boverhof ve diğerleri, 2008). Alerjik astım ve rinit genellikle ani tip aşırı duyarlılık reaksiyonlarıdır, 1 saat içinde veya birkaç dakika süren maruziyet ile inflamatuar mediyatörlerin bölgesel salınmasından kaynaklanır. Bu tip reaksiyonlar çoğu zaman IgE antikorundan etkilenir. Solunum sensitizasyonunun indüksiyon fazı sırasındaki en önemli olay immun yanıt oluşumudur, 13 özellikle doku mast hücrelerine bağlanan antikorların üretimidir (Vangosa ve diğerleri, 1994). Tip I ani aşırı duyarlılık reaksiyonlarının regülasyonunda Th1 ve Th2 yanıtları dengesi esas faktördür. Th1 hücreleri immün yanıtı azaltırken, Th2 yanıtları artırır (Goldsby ve diğerleri, 2002). Tip I aşırı duyarlılık olaylar sıralaması, bir antijene karşı IgE antikorunun üretilmesi ile başlar, daha sonra bu IgE antikoru mast hücresi yüzeyindeki Fc reseptörüne bağlanır, antijenle tekrar karşılaşıldığında IgE antikoru mast hücresinden mediyatörlerin salınmasına neden olur. Mast hücre mediyatörleri hızlı bir şekilde damar geçirgenliğini artırıp düz kasları kasarak bu reaksiyonlardaki klinik bulguların oluşmasına yol açar. Bu damarsal ve düz kas reaksiyonu, duyarlı kişilerde antijenle tekrar karşılaşma sonrasında dakikalar içerisinde gelişebilmektedir. Mast hücrelerinin diğer mediyatörleri de ilerleyen saatlerde nötrofil ve eozinofillerin reaksiyon bölgesine toplanmasına neden olan sitokinlerdir. Geç faz reaksiyon denilen ani aşırı duyarlılık inflamatuar bileşeni, tekrarlayan ani aşırı duyarlılık tepkileri sonucu oluşan doku hasarından sorumludur. Alerjiye yatkın bireylerde, bazı antijenlerle karşılaşma Th2 hücrelerinin aktivasyonuna ve IgE antikorların üretimine neden olmaktadır. Normal bireyler ise kuvvetli bir Th2 yanıtını yabancı antijenlerin çoğuna karşı geliştirmezler. (Abbas ve Lichtman, 2007). Th2 hücreleri tarafından salınan IL-4 ve IL-13 sitokinleri B lenfositlerini uyararak antijenlere özgül IgE üreten hücrelere dönüşümlerini sağlarlar. Bu nedenle atopik bireyler, normal kişilerde IgE yanıtına neden olmayan antijenlere karşı fazla miktarlarda IgE antikorları üretirler (Abbas ve Lichtman, 2007). Mast hücre granüllererinden salınan vazoaktif aminler ve proteazlar, araşidonik asit metabolizma ürünleri ve sitokinler en önemli mediyatörlerdir. Bu mediyatörlerin farklı etkileri vardır. Histamin, en önemli amin olup, küçük çaplı kan damarlarında genişlemeye, damar geçirgenliğinde artışa, düz kaslarda geçici kasılmalara neden olur. Proteazlar, dokularda yerel hasara sebebiyet verir. Araşidonik asit metabolitlerinden prostaglandinler, vasküler dilatasyona, lökotrienler ise uzun süreli düz kas kasılmalarına neden olurlar. Sitokinler lokal inflamasyonu başlatırlar. Bu nedenle mast hücre mediyatörleri, ani aşırı duyarlılık temel olayları olan damar ve düz kas reaksiyonlarından ve inflamasyondan sorumludur (Abbas ve Lichtman, 2007). 14 Mast hücreleri tarafından üretilen sitokinler, geç dönem reaksiyona neden olan lökositlerin toplanmasını uyarırlar. Bu reaksiyonda rol alan başlıca lökositler eozinofiller, nötrofiller ve Th2 hücreleridir. Mast hücresi kaynaklı tümör nekroz faktörü (TNF) ve IL-4, nötrofilden ve eozinofilden zengin infalamasyonu artırır. Eozinofiller ve nötrofiller proteazlarını salarak doku hasarına neden olurken, Th2 hücreleri daha fazla sitokin üreterek reaksiyonu artırırlar. Eozinofiller alerjik reaksiyonların en önemli bileşenleri olup, bu reaksiyonlardaki doku hasarının sorumlularıdır. Bu hücreler, mast hücreleri ve Th2 hücrelerince üretilen IL5 sitokini tarafından aktive olurlar (Abbas ve Lichtman, 2007). Astım solunan alerjenlerin bronşlardaki mast hücrelerini uyararak aralarında lökotrienlerin de bulunduğu mediyatörlerin salınımına ve buna bağlı olarak bronşlardaki düz kaslarda kasılma ve solunum yollarında tıkanıklığa yol açabilir. Kronik astımda, bronş mukozasındaki eozinofil ve mukus salgısında artış ve bronş düz kaslarında çeşitli uyaranlara karşı aşırı duyarlılık mevcuttur (Abbas ve Lichtman, 2007). Astım patojenezinde hücre aracılı immün olaylarının da rolünün olduğu görüşü giderek yaygınlık göstermektedir (Corrigan ve Kay, 1992). Astımda kronik inflamasyonun rolü büyüktür ve bronşiyal mukozada lökositlerin akümülasyonu, mukus üretimi ve solunum yolu hücrelerinin hasarı ile ilişkilendirilir. T lenfositler eozinofillerle birlikte bronşiyal inflamasyonun gelişiminde merkezi role sahiptir. Hücre aracılı immün reaksiyonlar, alerjenlere karşı gelişen geç faz solunum reaksiyonların gelişiminde ve astımın uzun süreli ilerleyişinde önemlidir (Vangosa ve diğerleri, 1994). Epidemiyolojik çalışmalar solunum sensitizanlarının kompleks semptomları indüklediğini göstermektedir; bu kimyasallar alerjik astım dışında, eozinofili ve akciğerlerde solunum yolları fonksiyon bozuklukları gibi hastalıkların gelişmesine de neden olmaktadır (Mori ve diğerleri, 2012). 2.2. Alerjik Temas Dermatiti ve Solunum Sensitizasyonunda Sitokinlerin Rolü Sitokinler, immün hücrelerde eksprese edilen spesifik reseptörler aracılığı ile çok küçük konsantrasyonlarda (pikomolar) biyolojik fonksiyonlarını gösteren küçük polipeptid moleküllerdir (Abbas ve Lichtman, 2007). Hücre büyümesi, farklılaşması ve göçü ile immün fonksiyonları içeren hücreye özgü etkilere aracılık etmek üzere, eksojen uyaranlara 15 cevaben kısa süreli ve lokal olarak üretilirler (Van Och ve diğerleri, 2002). Sitokinler, hedef hücrelerin yüzeyleri üzerindeki spesifik reseptörler aracılığı ile hücreden hücreye etkileşimde görev alan çok çeşitli hücre tipi tarafından üretilmektedir (Chung ve Barnes, 1999). Epidermis içerisinde kerotinositler başlıca sitokin kaynağıdır. Sitokinler ayrıca Langerhans hücreleri ve melanositler tarafından da üretilir (Williams ve Kupper, 1996). Sitokinler bütün immun ve inflamatuar yanıtların indüksiyon ve efektör fazına katılır. Bütün sitokinler kendi hedef hücrelerine sinyal iletirken plazma membranındaki spesifik reseptörlerine bağlanır (Kelso, 2000). Farklı immunojenler farklı sitokinlerin sentezini indükler bu da farklı immun efektör mekanizmaları aktive eder. Sitokin sentezini tetikleyen uyaranın yapısı hücre tarafından üretilecek sitokinin belirlenmesinde önemli bir faktördür. Bir sitokinin aynı veya farklı bir sitokinin sentezini stimüle etmesi olarak tanımlanan sitokin kaskatı, ilk yanıtı güçlendirmek ve değiştirmek için önemli bir mekanizmadır (Kelso, 1998). CD4+ T hücreleri sitokin üretimlerinden dolayı neredeyse tüm immün yanıtlarda merkezi düzenleyici role sahiptir. Olgunlaşmış periferal T hücreleri antijen tanınması ve kostimülasyonu sonucu aktive olana kadar sitokin üretmezler, ancak birçok sitokini sentez etme kapasitesine sahiptir (Kelso, 1998). Özelleşme, T hücreleri in vivo immün yanıtlardan sonra (özellikle kronik yanıtlardan) veya in vitro kültür koşulları altında klonal ekspansiyona uğradığında gerçekleşir. Bu özelleşmiş sitokin modellerinden en iyi karakterize edilenleri Th1 ve Th2’dir. Tip 1 ve tip 2 sitokin gurupları efektör mekanizmaların aktivasyonuna ön ayak olur, bu nedenle belirli patojenlere karşı verilen immün reaksiyon ve yanıtların tipleriyle ilişkilendirilir (Kelso, 1998). Sitokin yanıtının belirlenmesinde ilk ve en önemli basamak uygun indükleyici sinyalin ve bu sinyal için fonksiyonel reseptörleri eksprese eden hücrelerin varlığıdır (Kelso, 2000). Öncelikle, derinin temas sensitizanlarına maruz kalmasıyla epidermiste keratinosit ve Langerhans hücreleri tarafından sitokin üretimi hızlı bir şekilde artar ve Langerhans hücrelerinin olgunlaşması ile göçü başlatılmış olunur. Bu süreçte görev alan başlıca sitokinler GM-CSF, IL-1 ve TNF-α’dır (Kimber ve diğerleri, 2000). 16 Antijenlere yanıt olarak, T lenfositleri, özellikle CD4 + T hücreleri hızlıca farklı etkilere sahip farklı sitokinler salgılar. Aktivasyonu takiben 1-2 saat içinde CD4+ T lenfositlerinden üretilen ilk sitokin IL-2’dir. Antijenle uyarılmış T hücreleri tarafından üretilen IL-2 özellikle aynı T hücresine bağlanıp etkisini gösterir. IL-2’nin temel rolü T hücre çoğalmasını uyarmaktır, bu nedenle IL-2 T hücre büyüme faktörü olarak da adlandırılır. T hücreleri IL-2 uyarımı ile hücre döngüsüne girer ve bölünmeye başlar, sonuçta antijene özgül T hücreleri sayısında artış olur (Abbas ve Lichtman, 2007). CD4+ yardımcı T hücreleri değişik sitokinleri üreterek farklı fonksiyonlara neden olan efektör hücre alt gruplarına farklılaşabilirler. Bu alt gruplar Th1 ve Th2 hücreleri olarak adlandırılmıştır. Antijen ile uyarılan yardımcı T hücrelerin hangi alt gruba farklılaşacağı üretilen sitokinler tarafından belirlenir (Goldsby ve diğerleri, 2002). Th1 ve Th2 hücrelerinin gelişimi rastlantısal bir olay değildir, naif CD4 + T hücrelerinin antijenlerle karşılaştığı zaman aldığı uyarı tarafından düzenlenir. Makrofajlar ve dendritik hücreler IL-12 adı verilen bir sitokin üreterek immün yanıt oluştururlar. Naif T hücresi aynı antijen sunan hücreler tarafından sunulan bu antijenleri tanıdığı zaman, T hücreleri aynı zamanda IL-12’ye de maruz kalırlar. IL-12, T hücrelerinin makrofajları aktive eden IFN-γ üreten Th1 alt grubuna farklılaşmasını uyarır. Doğal immün yanıt bu durumda, antijen sunan hücrelerden IL-12 üretimi ile kazanılmış immün yanıtın doğal gidişini etkiler ve Th1 hücrelerine doğru yönlendirir. Eğer antijen, antijen sunan hücreler tarafından IL-12 üretimine neden olmazsa, T hücreleri bu durumda IL-4 üretir. Bu da bu hücrelerin Th2 alt grubuna doğru farklılaşmasını indükler. Th1 ve Th2 farklılaşmasındaki denge öncelikle belirli antijenlere karşı yanıtta dendritik hücrelerin tipleri tarafından etkilenebilir. Farklı dendritik hücre alt grupları, antijenler tarafından aktive olduklarında farklı sitokinleri salgılamaları ve farklı yanıt vermeleri sonucunda efektör T hücrelerini Th1 ve Th2 yönünde indükler (Abbas ve Lichtman, 2007). Th1 hücreleri gecikmiş tip aşırı duyarlılık yanıtları ile ilişkilidir ve bu yanıtlar Th1 sitokinlerinden IFN-γ ile yönetilir. IL-2 üretimi yapan farklılaşmamış yardımcı T hücreler ve doğal öldürücü hücreler (NK) tarafından üretilen ilk sitokin IFN-γ’dır. IFN-γ makrofaj, nötrofil ve doğal öldürücü hücreleri aktive eder, T ve B hücre farklılaşmasını başlatarak IL-1 ve IL-2 sentezini artırır (Van Och ve diğerleri, 2002). 17 Buna karşın, Th2 hücre aktivasyonu IgE antikor yanıtının indüksiyonu ve devamlılığı için gerekli Th2 sitokini IL-4’ün ekspresyonu ile ani tip aşırı duyarlılık reaksiyonlarını başlatır. Th1 hücre sitokini IFN-γ ise IgE üretimini inhibe eder. Ayrıca Th2 sitokinleri, alerjik yanıtın klinik belirtilerinin ortaya çıkmasında önemli rolü olan eozinofil ve mast hücrelerinin gelişimi ve farklılaşması ile eozinofilerin toplanmasının stimülasyonu gibi ani tip reaksiyonları tetiklerler (Kimber ve Dearman, 1997). IL-4, IL-10 ve IL-13 gibi Th2 hücreleri tarafından üretilen sitokinlerin bazıları makrofaj aktivasyonunu inhibe eder ve Th1 hücre aracılı immüniteyi baskılar. Bu nedenle, bir antijene karşı hücre aracılı immün yanıtların etkisi bu antijene yanıtta Th1 ve Th2 hücrelerinin aktivasyonu arasındaki denge ile sağlanabilir (Abbas ve Lichtman, 2007). Şekil 2.2. Th1 ve Th2 hücrelerini birbirinden ayıran sitokin yanıtları ve immun yanıtlardaki farklı rolleri (Selgrade ve diğerleri, 1997) CD4+ T lenfositlerin Th2 alt grubu, eozinofilden zengin inflamasyonu uyarır ve makrofaj aktivasyonunun zarar verici etkilerini kontrol altına almaya çalışır. Farklılaşmış Th2 hücreleri antijeni tanıyınca, bu hücreleri IL-4 ve IL-5 (aynı zamanda birçok başka hücre tarafından da üretilen IL-10) sitokinlerini üretirler. IL-4 IgE antikor üretimini uyarırken, IL-5 eozinofilleri aktive eder (Foster ve diğerleri, 1997; Bousquet ve diğerleri, 2000; Abbas ve Lichtman, 2007; Zhu ve Paul, 2008). IL-4, IL-10 ve IL-13 gibi birçok sitokin üretiminin yanında Th2 hücreleri makrofaj aktivasyonunu da inhibe etmektedir. Bu nedenle Th2 hücreleri, Th1 aracılı gecikmiş tip aşırı duyarlılık reaksiyonlarını yok etmeye yardımcı olmakta ve böylece Th1 hücresel koruyucu bağışıklıkta sıklıkla görülen doku hasarını sınırlamaktadır (Abbas ve Leichtman, 2007; Zhu ve Paul, 2008). 18 IL-4, alerjik inflamasyonun gelişimindeki temel sitokindir. Alerjik inflamasyondaki temel biyolojik aktivitesi naif T yardımcı lenfositlerin (Th0) Th2 lenfositlerine farklılaşmasını yürütmektir. B lenfositlerinden IgE sekresyonu ile ilişkili olup, IgE aracılı immün yanıtlar IL-4 tarafından artırılır. IL-4 diğer inflamatuar sitokinlerin fibroblastlardan ekspresyonunu artırıp inflamasyona ve kronik astıma katılımını sağlar. Ayrıca T lenfosit, monosit, bazofil ve eozinofillerin göçünü yönetir. Eozinofil apoptozunu inhibe edip eozinofilik inflamasyonu başlatır (Steinke ve Borish, 2001). Th2 lenfosit farklılaşması inhibe edildiğinde ve Th2 hücre apoptozu indüklendiğinde, IL4’ün biyolojik aktivitelerinin inhibe edildiği ve IL-5 üretiminin azaldığı gösterilmiştir (Steinke ve Borish, 2001). Alerjik solunum yolu hastalıklarının gelişiminde bir diğer önemli sitokin olan IL-5 solunum yolu hiperaktivitesi, eozinofillerin büyümesi, farklılaşması ve aktivasyonunu stimüle eder (Foster ve diğerleri, 1997). IL-10 ise, Langerhans hücrelerinin Th1 lenfositlerine antijen sunmasını inhibe ederken, Th2 lenfositlerin aktivasyonunu artırır (Selgrade ve diğerleri, 1997). IL-13’ün akciğerlerde inflamasyonu, aşırı mukus sekresyonunu ve fibrozisi indüklediğinin gösterilmesi, alerjik astımda önemli bir mediyatör olduğunu ortaya koyar (Renauld, 2001). Ayrıca diasetilin neden olduğu akciğerlerin inflamasyonlu hastalığı bronşiyolitis obliterans sendromunun, artan IL-13 seviyeleri ile ilişkili olduğu gösterilmiştir (Keane ve diğerleri, 2007). 2.3. Kimyasalların Sensitizasyon Potansiyellerinin Ölçüm Yöntemleri Alerjik hastalıklar günümüzde ciddi bir çevresel ve mesleki sağlık sorunu oluşturmaktadır. Alerjik temas dermatiti mesleki hastalıklar arasında en sık raporlanan olup, bütün mesleki hastalıkların %10-15’ini oluşturmaktadır. Bu durum kamu sağılığı üzerinde ciddi bir mali yük oluşturmaktadır; tıbbi tedavi, işçi tazminatı ve iş kaybı ile birlikte yıllık masrafı 1 milyon dolara mal olmaktadır. Bu nedenle kimyasal sensitizanlarının tehlikelerinin belirlenmesi için hızlı ve hassas yöntemlerin geliştirilmesine ağırlık verilmiştir (Anderson ve diğerleri, 2011). Yıllarca toksikolojideki başlıca hedef bu maddeleri belirlemek ve insan sağlığı için oluşturduğu riskin değerlendirilmesi ve yönetilmesidir (Basketter, 2008). 19 Bu amaçla ilk olarak Kobay Maksimizasyon Testi ve Buehler Testi kullanılmıştır. İnsan yama testinin hala bazı ülkelerde deri alerjenleri için doğrulayıcı test olarak kullanılmasına karşın, etik kaygılar ve daha güvenilir alternatif test prosedürlerinin varlığı insan yama testinin geçerliliğini büyük ölçüde azaltmıştır. Bu testlere alternatif olarak Lokal Lenf Düğümü Testi’nin geliştirilmesi ve 1999, 2000 yıllarında ICCVAM ve ECVAM tarafından valide edilmesi ile birlikte kimyasal deri sensitizanlarının belirlenmesinde Lokal Lenf Düğümü Testi (LLNA) öncelikli yöntem olarak tercih edilmektedir (Anderson ve diğerleri, 2011). Sensitizasyon için günümüzde valide olan tek yöntem LLNA’dır. 1990’lerin başında Kimber ve Basketter tarafından geliştirilmiş olup, yoğun bir validasyon sürecinden geçmiştir. 1999 yılında Birleşik Devletler’in Ulusal Sağlık Enstitüsü (NIH) tarafından validasyon raporu yayınlanmıştır. Bundan 3 yıl sonra Temmuz 2002 yılında OECD tarafından kabul edilmiştir (OECD kılavuzu TG 429). 2010 yılında temel protokolde küçük değişiklikler yapılarak revize edildi (Rovida, 2011). Son zamanlarda bu metod, Avrupa Birliği’ndeki yeni REACH regülasyonu ile ilk ihtiyaç duyulan sensitizasyon testi haline gelmiştir. (Anderson ve diğerleri, 2011). Kobay maksimizasyon testi ve Buehler testi ile kıyaslandığında daha az deney hayvanı ile çalışılması, hem alerjik reaksiyonların çok şiddetli olmaması hem de uygulama süresince hayvanlara daha az acı verilmesi 3R (Reduction, Refinement, Replacement/ Azaltma, iyileştirme, yerine koyma) açısından bu LLNA alternatif bir yöntem olarak kabul görmüştür. Hala in vivo bir yöntem olmasına karşın en büyük önemi taşıyan “R” olan yerine koyma, deney hayvanları yerine daha az gelişmiş organizma veya hücre kullanma) hala erişilmemiştir. Bu nedenle diğer in vivo yöntemler gibi LNNA’da sadece gerekli olduğu zaman uygulanmaktadır (Rovida, 2011). LLNA kobay testleri ile karşılaştırıldığında çok fazla avantaja sahiptir. Kobay testleri kayda değer güvenilirliğe sahip olsa da, yüksek oranda yanlış pozitif veya yanlış negatif sonuç gösterir. LLNA en son verilerin subjektif bir yorumlamadan ziyade enstrümantal ölçüme dayalı olduğu daha iyi standardize edilmiş prosedürün avantajına sahiptir. LLNA sadece evet/hayır yanıtından farklı olarak, test maddesinin etkinliği üzerine değerlendirmede bulunmaya imkan tanıyacak şekilde doz yanıt ilişkisi sunmaktadır. 24 gün süren kobay testlerine kıyasla test süresi daha kısadır. Ayrıca dermal aşırı duyarlılık 20 reaksiyonlarının ortaya çıkışını gerektirmeden, adjuvana ihtiyaç olmaksızın test maddesinin deney hayvanı üzerine uygulanması gibi basit bir işlemi gerektirir. Bu nedenle deney hayvanına verilen acı ve stres büyük ölçüde azaltılmış olur (Rovida, 2011). Standart LLNA’da radyoaktif materyalin kullanılması testin uygulanabilirliğini kısıtlamasından dolayı, radyoaktif madde kullanımını gerektirmeyen alternatifleri geliştirilip valide edilmiştir ve OECD kılavuzuna TG 442A ve 442B olarak dahil edilmiştir. Kısaca bu yöntemler trifosfat içeriğinin biyoluminesans yoluyla, 5-bromo-2deoksiüridinin miktarının (BrdU) ELISA test sistemi ile belirlenmesi suretiyle lenfosit proliferasyonunun ölçülmesine dayanır (Rovida, 2011). Test kimyasal alerjen maruziyetine yanıt olarak lenfositlerin selektif klonal ekspansiyonunun miktar tayinine dayanır. Buna göre auriküler lenf düğümlerindeki proliferasyonu 3 kat ya da daha fazla oranda stimüle eden madde deri sensitizanı olarak tanımlanır (Basketter, 2014). LLNA, sensitizan etkinliğinin kantitatif ve objektif tahmini ile tehlikenin belirlenmesi için ilk gerçek adım olmuştur. LLNA doz yanıt verisinin basit matematiksel interpolasyonu, eşik pozitif yanıt üretmeye yeterli test kimyasalının konsantrasyonunu kantitatif olarak tahmin etmeye yardımcı olur. Ancak bunun doğrudan insan için kesin bir değer olmadığı unutulmamalıdır; insanlarda eşik indüksiyonu ile doğrudan bir ilişkisi yoktur. Bir olası sensitizanın alerjen etki gücünün bir diğeri ile kıyaslanmasına imkan tanınır (Basketter ve diğerleri, 2000). LLNA ile deri ve solunum sensitizasyonununu ayrımının yapılması mümkün olmamasına karşın, bu testle birlikte sitokin yanıtları derinin solunum sensitizasyonundan ayırt edilmesini sağlamaktadır. Ancak solunum aşırı duyarlılığı için valide edilmiş in vivo veya in vitro bir yöntem bulunmamaktadır (Vandebriel ve diğerleri, 2011). Gerçek temas sensitizanlarının belirlenmesinin yanı sıra, klinik alerjik temas dermatiti ile nadiren ilişkilendirilmelerine rağmen solunum sensitizanlarının da LLNA’da pozitif yanıt verdiği yaygın olarak kabul edilmiştir (Holsapple ve diğerleri, 2006; Vanoirbreek ve diğerleri, 2003). Temas aşırı duyarlılık reaksiyonları hücre aracılı (Th1) olduğundan, LLNA’nın temas sensitizanları ile B hücre aracılı IgE üretimi vasıtasıyla hümoral Th2 21 yanıtını yöneten solunum sensitizanları arasında ayrım yapabildiği düşünülmektedir (Vanoirbreek ve diğerleri, 2003). Ancak, bazı güçlü temas sensitizanları ile karma Th1/Th2 yanıtları gözlenmiştir (Kondo ve diğerleri, 1998). Bu nedenle deri sensitizasyonununda temas ve solunum sensitizanları arasındaki fark lenf düğümlerindeki spesifik hücre tiplerinin aktivasyonuna dayanmaktadır. Sitokin profillemesi ve serum IgE seviyeleri (Dearman ve diğerleri, 2003b) gibi alternatif indikatörler temas ve solunum alerjenlerinin ayrımının yapılabilmesi için umut vaat etmektedir. Ancak IgE yanıtındaki farklılıklar ve sitokin parmak izi kontrolünün sınırlı kapasitesi, temas ve solunum sensitizanlarının birbirinden ayırt edilebilmesi için LLNA’nın özgüllüğünü artıracak daha sağlam verilere gereksinim olduğunu göstermektedir (Adenuga ve diğerleri, 2012). Genel kanı LLNA’da negatif yanıt veren kimyasal deri sensitizasyonu potansiyelinden yoksun olduğu gibi solunum sensitizasyonu potansiyelinden de yoksun olduğudur (Roggen ve diğerleri, 2008). Ancak LLNA’daki pozitif yanıt kesinlikle o kimyasalın temas alerjeni olduğunu gösterse de, solunum sensitizasyonu etkinliğine sahip olduğunun kesin kanıtı değildir (Isola ve diğerleri, 2008) Bu fikir baz alınırsa önceden bir LLNA yürütülüp ardından sadece pozitif yanıt veren kimyasallarla sitokin profillerinin çıkarılmasının uygun olacağı düşünülmektedir. Böylece pozitif LLNA yanıtlarını tetikleyen uygulama konsantrasyonların bilinmesine dayanan sitokin profillemesi için uygun dozların seçimi mümkün olacaktır (Dearman ve diğerleri, 2003a). 2.3.1. Standart fare lokal lenf düğümü testi (LLNA) Standart Fare Lokal Lenf Düğümü Testi, temas alerjenine maruziyet bölgesindeki lenf düğümlerinde immün yanıtın başlatılmasına dayanan deri sensitizasyonu ediniminin belirlenmesine dayanır. Lenf düğümü aktivasyonu deriden göç eden dendritik hücreler tarafından taşınan antijenlerin varlığı ile tetiklenir ve lenf düğümü ağırlığı ve hücreselliğindeki artış ve T lenfosit proliferasyonunun stimülasyonu ile ilişkilidir. Daha önceki çalışmalarda lenf düğümü aktivasyonunun çeşitli markerları değerlendirilmiştir, ancak en hassas ve en selektif ölçünün lenf düğümü hücrelerinin miktarının [ 3H] timidin (3H-TdR) katımının fonksiyonu olarak ölçülmesi olduğu kabul edilmiştir (Kimber ve Weisenberger, 1989). 22 Test çok kısa bir şekilde özetlenirse: Test maddelerinin uygun çözücü içerisindeki çeşitli konsantrasyonları ve sadece eş hacimdeki çözücü, CBA ırkı 4’er adet fare gruplarının her iki kulak arkasına topikal olarak uygulanır. Aynı uygulama ardışık 3 gün boyunca tekrarlanır. Maruziyet başlangıcını takip eden beş gün sonra fareler 3H-TdR kaynağı ile iv enjeksiyona tabii tutulur. Beş saat sonra fareler sakrifiye edilir, auriküler lenf düğümleri kesip çıkarılır, her bir deney grubu (veya her bir fare için) için lenf düğümleri bir arada toplanır ve β-sinsilasyon sayıcı ile işlemden geçirilir. Veriler, çözücü kontrol grubunun değerlerine göreceli olarak her bir doz grubu için stimülasyon indekslerinden (SI) elde edilen dakika boşuna bozunma olarak kaydedilir. Deri sensitizanı, eş zamanlı çözücü kontrol grubu ile karşılaştırmalı olarak bir veya daha fazla konsantrasyonda lenf düğümü hücre proliferasyonunda üç katı veya daha fazla artış gösteren (SI ≥3) kimyasal olarak tanımlanır (Kimber ve Dearman, 2002). LLNA doz-yanıt ilişkisinin değerlendirilmesine imkan tanıdığı gibi dermal sensitizasyon etkinliğinin kategorizasyonunda da kullanılmaktadır. Günümüzde, kimyasallar için dozyanıt ilişkisi değerlendirmesini içeren tek yöntem olarak LLNA kabul görmektedir. Avrupa Birliği uzman grubu kimyasalların dermal sensitizasyon oluşturma potansiyellerine göre sınıflandırılmasında LLNA kullanımını uygun görmüştür (Kimber ve diğerleri, 2003; Basketter ve diğerleri, 2005a). Dermal sensitizasyon risk değerlendirmesinde deneysel maruziyetin (belirli ve kontrollü maruziyet koşulları) gerçekte var olan maruziyete (birey tarafından kontrol edilen değişken maruziyet) ekstrapolasyonu gerekmektedir. LLNA’da doz-yanıt ilişkisinden hareketle rölatif etkinliği belirlemede kullanılan EC3 değeri stimülasyon indeksinde 3 kat artışa neden olan kimyasalın etkin konsantrasyonu olarak tanımlanır. Bu değerin etkinlik ölçümünde güvenilir bir değer olduğu ve insanda deri sensitizanı kimyasalların rölatif etkinlikleri ile korelasyon gösterdiği kanıtlanmıştır (Gerberick ve diğerleri, 2005). EC3 değeri insan yama testinde (HRIPT) sensitizasyona neden olmayan düzeyle (hiçbir etki gözlenmeyen düzey, NOEL) uyumludur (Basketter ve diğerleri, 2005b; Gerberick ve diğerleri, 2001). Böylece insan testine gereksinim duyulmaksızın HRIPT NOEL değerlerinin ileriye yönelik belirlenmesi mümkün olacaktır (Van Loveren ve diğerleri, 2008). 23 Anlatılan bu kısaltılmış protokol orijinal olarak geliştirilen ve valide edilen LLNA versiyonu olmasına karşın, bazılarında daha köklü modifikasyonların yapıldığı versiyonları da mevcuttur (Takeyoshi ve diğerleri, 2001; Basketter, 2008; Kimber ve diğerleri, 2011). 2.3.2. Standart LLNA yöntemine alternatif in vivo BrdU yöntemi Son 20 senedir Fare Lokal Lenf Düğümü Testinin, diğer hayvan deri sensitizasyon modellerine alternatif olarak ilaçlar, kozmetik materyaller, pestisitler ve endüstriyel kimyasalların deri sensitizan potansiyellerini değerlendirme ve tehlikelerinin belirlenmesindeki kullanımı artmıştır. Ancak bu standart metod özel bir tesis ve kullanım prosedürlerini içeren radyoizotop temelli bir yöntem olduğundan herhangi bir laboratuarda yürütülmesi güçtür (Ulker ve diğerleri, 2013). Radyoaktivite kullanımından dolayı bazı ülkelerde standart LLNA’da kısıtlamalara gidilmiştir. 1999 yılında ICCVAM alternatif LLNA endpointlerinin geliştirilmesi ve kullanıma geçirilmesi için tavsiyede bulunmuştur. LLNA protokolünün geliştirilmesi amacıyla çalışılan alanlardan biri radyoizotop kullanımını gerektirmeyen bir modifikasyonu içermektedir (Suda ve diğerleri, 2002; Ulker ve diğerleri, 2013). LLNA: BrdU-ELISA yöntemi Takeyoshi ve arkadaşları (2001) tarafından tasarlanıp ve laboratuarlar arası validasyon çalışması Kojima ve ark. (2008) tarafından yapıldıktan sonra ICCVAM tarafından valide edilmiştir (2010). Umut vaat eden bu yaklaşım 3HTdR’nin yerine radyoaktif olmayan analogu 5-bromo-2’-deoksiüridin (BrdU)’in kullanımını içerir. BrdU 3HTdR’ye çok benzer olduğundan, 3HTdR gibi BrdU da hücre siklusunun S-fazı sırasında lokal olarak çoğalan lenf düğümü hücrelerinin DNA’sına katılmaktadır (Williams ve diğerleri, 2015). Bu yöntem aynı zamanda OECD test rehberinde standart test protokolü olarak yerini almıştır (OECD TG 442B LLNA:BrdU-ELISA). Deney protokolüne göre üç gün boyunca test maddesinin topik uygulamasının ardından beşinci gün farelerin peritonları içerisine BrdU enjeksiyonu yapılır. Daha sonra BrdU katılımı ELISA hücre proliferasyon kiti ile ölçülür. Her bir doz grubunun BrdU işaretleme indeksi çözücü grubunkine oranlanır ve stimülasyon indeks (SI) değeri hesaplanır. SI değeri 1,6’dan büyük olan kimyasallar temas sensitizanı olarak kabul edilir (OECD TG 442B). 24 Kojima ve ark. (2010) tarafından yürütülen laboratuarlar arası validasyon çalışmasında LLNA:BrdU-ELISA yöntemi, kobay testi ve standart LLNA ile karşılaştırılmıştır. LLNA: BrdU-ELISA kobay maksimizasyon testi ile kıyaslandığında çok iyi tahmin edilebilirlik sergilemiştir (%100 spesifiklik, duyarlılık ve doğruluk) ancak standart LLNA’ya kıyasla daha düşük spesifiklik ve doğruluk göstermiştir (sırasıyla %75 ve %90) (Mehling ve diğerleri, 2012). 2.3.3. Standart LLNA yöntemine alternatif ex vivo BrdU yöntemi Radyoaktif atığı azaltmak ve hayvan refahını gözetmek amacıyla ICCVAM tarafından valide edilen yöntem üzerinde modifikasyonlar yapılarak ex vivo BrdU ile işaretleme yaklaşımı geliştirilmiş ve yaygın olarak kullanılmaya başlanmıştır. OECD test rehberine giren radyoaktif olmayan LLNA yönteminde beşinci gün BrdU’nun farelerin periton içine enjeksiyonuna karşın, ex vivo yöntem beşinci gün farelerin sakrifikasyonundan sonra izole edilen lenf düğümü hücrelerine BrdU ilavesini içerir (Ulker ve diğerleri, 2014). Kimyasal maddelerin dermal alerji potansiyellerini ölçmek için uygulanan in vivo ortamda BrdU işaretlemesi ve ex vivo ortamda BrdU işaretlemesi ile yapılan deney sonuçlarının birbirleri ile oldukça uyumlu olduğu gözlenmiştir (Ulker ve diğerleri, 2013). 2.3.4. rLLNA (reduced LLNA) LLNA’nın 3 doz grubu ve bir çözücü kontrol grubunun kullanıldığı ve lenfosit proliferasyonunda çözücü kontrolden 3 kat daha fazla artış göstererek doz yanıt ilişkisi oluşturan kimyasalın pozitif temas alerjeni olarak kabul edildiği bir yöntem olarak tasarlandığını biliyoruz. Ancak hayvan deneylerinin azaltılmaya gidilmesine yönelik artan talep ve baskılar, testte iyileştirmelerin yolunu açmıştır. 3 doz grubu yerine tek bir doz grubunun uygulanması valide edilmiş olup (ICCVAM, 2011), OECD TG 429’da temas alerjisi oluşturma potansiyeli bilinmeyen kimyasalların değerlendirilmesine yönelik rutin tarama testi olarak yer almıştır (Thyssen ve diğerleri, 2012). rLLNA, test maddelerinin tek konsantrasyonlarının kullanılmasını içerdiğinden deney hayvanı sayısını standart LLNA’ya göre %40 azaltmaktadır. LLNA’da olduğu gibi her grupta 5 adet fare ile çalışılır. Ancak bu yöntem doz-yanıt ilişkisi değerlendirmesine imkan 25 vermez. Bu nedenle doz-yanıt ilişkisinin incelenmeyeceği, sadece test maddesinin sistemik toksisite veya lokal deri irritasyonu oluşturmayacak maksimum konsantrasyonunda indükleyeceği immün yanıtın değerlendirileceği çalışmalarda tercih edilmelidir (OECD TG 429). 2.4. LLNA’nın Kimyasalların Solunum Sensitizasyon Potansiyellerinin Ölçümüne Uyarlanması Deri sensitizasyonunun aksine, solunum bölgesinin sensitizasyonuna yol açma potansiyeline sahip kimyasalların ileriye yönelik belirlenmesi için yaygın şekilde kabul edilmiş veya valide edilmiş bir yöntem mevcut değildir. Güvenilir ve kestirimci araçların ve yöntemlerin yokluğu kimyasal solunum alerjenlerinin belirlenmesi ve karakterizasyonunda önemli bir boşluk yaratmaktadır. Bu yöntemlerin geliştirilmesindeki en büyük engel solunum sensitizasyonu ile ilişkili immünobiyolojik mekanizmalar hakkındaki belirsizliklerdir. Protein alerjenlerine karşı gelişen ani tip aşırı duyarlılık yanıtları ve astımın IgE aracılı mekanizmalara bağlı olduğunun bilinmesine karşın, kimyasallarla gelişen solunum sensitizasyonunun IgE aracılı olup olmadığında dair fikir birliği oluşturulamamıştır (Kimber ve Dearman, 1998, 2002; Isola ve diğerleri, 2008; Basketter ve Kimber, 2011). Belirsizliğe karşın solunum bölgesinin sensitizasyonunun gelişimi için uygun koşulları sağlayan Th2 tip immün yanıtların indüksiyonu ile ortaya çıktığına dair bulgular mevcuttur (Dearman ve diğerleri, 2013). Kimyasal alerjinin farklı biçimleri arasındaki ilişki oldukça karmaşıktır. Birçok kimyasal solunum alerjeni, alerjik temas dermatiti ile ilişkilidir. Bu kimyasalların dermal maruziyet ihtimaline karşın insanda alerjik temas dermatitine yol açmadığına inanılmaktadır. Ancak kimyasal solunum alerjenleri inhalasyondan başka bir maruziyet yolu denendiğinde, solunum bölgesinin sensitizasyonunu indükleyebilirler. Mesleki sağlık açısından değerlendirildiğinde dermal maruziyetin bu hususta etkili olabileceği düşünülmektedir (Kimber ve Dearman, 2005). Solunum sensitizanlarının hepsi olmasa da büyük bir kısmı deri sensitizanlarının belirlenmesi için kullanılan LLNA gibi fare modellerinde pozitif yanıt vermektedir (Hilton ve diğerleri, 1995; Dearman ve diğerleri, 2000; Gerberick ve diğerleri, 2000). LLNA’da temas alerjisine yönelik testlerde pozitif yanıt oluşturmayan kimyasalların aynı zamanda solunum sensitizan potansiyeline sahip olmadığı kabul edilir 26 (Roggen ve diğerleri, 2008). Ancak LLNA’daki pozitiflik ve temas sensitizan potansiyeli arasındaki ilişkinin benzeri, solunum alerjenleri için resmiyet kazanmamıştır. LLNA sonuçları sensitizanlar tarafından immün yanıtın indüklenip indüklenmediğini gösterirken, solunum veya temas alerjisine ait spesifik mekanizmaları birbirinden ayırt edemez (Manetz ve Meade, 1999; Vanoirbeek ve diğerleri, 2003; Gerberick ve diğerleri, 2005; Boverhof ve diğerleri, 2008; Dearman ve diğerleri, 2013). Deri ve solunum sensitizanlarını birbirinden ayırt etmek için ilave test yöntemleri gerekmektedir. Solunum alerjenlerinin büyük bir kısmı suda çözünür olmadığından hücre temelli testlerde kullanılamayacağından solunum alerjenleri hala hayvan testlerini gerektirmektdir (Manetz ve Meade, 1999). Dermal maruziyet sonrası lenf düğümü hücrelerinde üretilen sitokinlerin solunum sensitizanlarını belirlemede kullanılabileceğine dair veriler mevcuttur (Dearman ve diğerleri, 1996; Vandebriel ve diğerleri, 2000). Kimyasalın tip 2 sitokin yanıtlarını indükleme yeteneğinin solunum sensitizasyon potansiyelinin bir göstergesi kabul edildiği sitokin profillemesi gibi bir yöntemle birlike LLNA yürütülebilir (Dearman ve diğerleri, 2013). 2.5. Sitokin Profillemesi Sitokin profillemesi, farklı tipteki kimyasal alerjenlerin farelerde farklı sitokin salım profilleri ile kalitatif olarak farklılık gösteren immün yanıtların tetiklenmesinin incelenmesine dayanır (Kimber ve diğerleri, 1996). Kimyasal solunum alerjenlerinin bazı özellikleri, deri sensitizasyonu ve alerjik temas dermatitine yol açan diğer kimyasal alerjenlerle benzerlik göstermektedir. Kimyasal solunum alerjenlerini temas alerjenlerinden ayıran benzersiz ve tanımlayıcı özelliği, öncelikle kimyasal solunum alerjenlerinin Th2 immün yanıtların gelişimine neden olurken temas alerjenleri deri sensitizasyonu ile sonuçlanan Th1 immün yanıtları indükler. Temas ve solunum alerjenleri tarafından sırasıyla Th1 ve Th2 olmak üzere farklı nitelikte immün yanıtların ortaya çıkarılması ile ilgili bulgular farelerde yapılan çalışmalar ile anlaşılmıştır (Kimber and Dearman, 2005). 27 Ayrıca sitokinler antikor yanıtlarının regülasyonunda ve antikor izotiplerinden hangisinin üretileceğini belirlemede önemli role sahiptir (Vangosa ve diğerleri, 1994). IL-4 ve IFN-γ IgE antikor regülasyonunda önemli etkilere sahiptir. Farelerde IgE yanıtlarının başlatılması ve sürdürülmesi IL-4 salımına bağlıdır (Dearman ve diğerleri, 2003b). İnsanlarda da IL-4 ve IgE ilişkisinin gösteridiği çalışmalar mevcuttur (Deo ve diğerleri, 2010). Tam tersi şekilde IFN-γ farelerde IgE üretimini inhibe eder (Selgrade ve diğerleri, 1997). Test kimyasallarının immünojenik özellikte olan ve sitokin salımı ölçümü için yeterli şiddette kütanöz immün yanıtları stimüle eden konsantrasyonlarının bilinmesi gerekmektedir. Doz seçimi öncelikle LLNA’nın yürütülmesine dayanır. İlk olarak LLNA’nın yürütülme nedeni test kimyasalının bütün alerjenik özelliklerinin değerlendirilip sonrasında uygulanacak sitokin profillemesi için doz ayarlamasını yapmaktır (Dearman ve Kimber, 2001). Test kimyasallarının sitokin salım profilleri eşzamanlı olarak solunum sensitizasyon potansiyelleri göz önünde bulundurulduğunda sırasıyla negatif ve pozitif kontrol olan 2,4dinitroklorobenzen (DNCB) ve trimellitik anhidrit (TMA) tarafından salınan sitokin profilleri ile karşılaştırılır (Dearman ve Kimber, 2001). 2.6. Fare IgE Testi Fare IgE testi, solunum bölgesinin alerjik sensitizasyonuna neden olan kimyasalların indüklenmiş serum IgE konsantrasyonunun bir fonksiyonu olarak belirlenmesini amaçlamaktadır (Kimber ve diğerleri, 1996). Araştırmalar sonucu kimyasal solunum alerjenine topik yoldan maruz bırakılan farelerde total IgE serum konsantrasyonlarında kayda değer bir artış gözlenmiştir (Dearman ve Kimber, 1991; Hilton ve diğerleri, 1995; Anderson ve diğerleri, 2011). Bu yanıt solunum bölgesi sensitizasyon potansiyelinden yoksun temas alerjenlerine maruziyet sonucu gözlenmemiştir. Bu konsantrasyonundaki gözlemler kimyasal değişikliklerin solunum fonksiyonu desteklemektedir (Kimber ve diğerleri, 1996). sensitizanlarını olarak serum IgE belirlenebileceğini 28 Bu yaklaşımın avantajı haptene özgül antikorun ölçümü yerine serum proteinin ölçülmesidir. Bu fare IgE testinin temelini oluşturmaktadır (Kimber ve diğerleri, 1996). Çalışmalarda bir dizi kimyasal alerjen, paralel olarak yürütülen LLNA’da pozitif yanıt veren ve epikütanöz uygulamayı takiben immünojenik oldukları belirlenen tek konsantrasyonları kullanılarak belirlenmektedir. Temel prensip önceden LLNA test sonuçları doğrultusunda test konsantrasyonlarının seçimidir. BALB/c fareler LLNA’da belirlenen konsantrasyonlarda test maddelerine ve çözücüye vücutlarının tıraşlanmış yan bölgelerinden iki taraflı topik olarak maruz bırakılır. Yedi gün test maddeleri ve çözücü her iki kulağın arkasına uygulanır. Serum IgE ELISA ile ölçülür. Analiz sonuçları sadece solunum sensitizasyonuna ve mesleki astıma neden olduğu düşünülen kimyasalların farelerde serum IgE seviyelerinde artışı indüklediğini teyit etmektedir (Karol, 1994; Kimber ve diğerleri, 1996). Serum IgE konsantrasyonundaki herhangi bir değişikliğin anlamlılığı eşzamanlı uygulanan çözücü kontroller ile elde edilen değerler referans alınarak değerlendirilir. Her bir analizin bütünlüğü sırasıyla pozitif ve negatif kontroller TMA ve DNCB ile sağlanır. Kimyasal solunum alerjenleri, uygun çözücünün uygulandığı kontrol farelerde kaydedilen değerlerle göreceli olarak bir veya daha fazla test konsantrasyonunda serum IgE konsantrasyonunda belirgin artış oluşturan maddeler olarak tanımlanır. Bu kriterin bütün olası kimyasal solunum alerjenlerinin belirlenmesi için uygun sensitivite ve selektivite açısından uygulamadaki pozitifliği henüz kesinleşmemiştir (Kimber ve diğerleri, 1996). Fare IgE testinin kimyasal solunum sensitizanlarının ileriye yönelik belirlenmesi için kullanışlı bir yöntem olduğu ortaya konmuştur. Ancak sadece sınırlı sayıda kimyasal ile değerlendirilmiş olup analizlerin çoğu tek bir laboratuarda yürütülmüştür. Testin geçerliliğinin ve yararlılığının incelenmesi daha geniş aralıktaki kimyasalların ayrı laboratuarlarda analizi ile mümkündür. Bu maksatla son dönemlerde fare IgE testinin uluslar arası laboratuarlar arası değerlendirilmesi başlatılmıştır (Kimber ve diğerleri, 1996). 29 2.7. Çalışmamızda Kullanılan Radyoaktif Olmayan ex vivo LLNA Yöntemi ile Sensitizasyon Potansiyelleri Tespit Edilecek Olan Kimyasal Maddeler 2.7.1. 2,4-dinitroklorobenzen (DNCB) Dinitroklorobenzenin temas sensitizan etki gücü oldukça yüksektir ve birçok tür DNCB’ye topik maruziyet sonrası kolayca sensitizasyon geliştirebilir. Bu nedenle hücre aracılı immün cevap oluşturmak için deneysel temas sensitizanı olarak DNCB tercih edilmektedir (Friedmann, 2006). Ayrıca doğada bulunmayan ve deney hayvanlarının immün sisteminin daha önce karşılaşma ihtimali olmayacağı bir madde seçimi önemlidir. DNCB’nin kullanılması deri teması yoluyla antijenle ilk maruziyeti ve maruziyet sonucu klinik ve selüler immün yanıtların ateşlenmesini sağlar (Newell ve diğerleri, 2013). DNCB Th1 sitokinleri IFN-γ ve IL-12 aracılığı ile temas aşırı duyarlılığına yol açan tipik bir dermal sensitizan olup mesleki astım veya alerjik rinit oluşturmadığı bilinmektedir (Vanoirbeek ve diğerleri, 2006). 2.7.2. Trimellitik anhidrit (TMA) Düşük molekül ağırlığına sahip kimyasallardan asit anhidritlerin, mesleki astımı içeren solunum bölgesi aşırı duyarlılık reaksiyonlarında rol oynadığı daha önceki çalışmalarda gösterilmiştir. Asit anhidritler doğal ve kompleks biyolojik aktivitelerinden ve işyerlerinde maruz kalan işçilerde yaygın mesleki solunum yolu hastalıkları ile ilişkilendirildiğinden araştırmamızda temel mesleki kimyasal ajan olarak seçilmiştir (Boverhof ve diğerleri, 2008). NIOSH yaklaşık 20 bin Amerikan işçisinin çeşitli üretim alanlarında trimellitik anhidrit maruziyeti açısından risk altında olduğunu öngörmüştür. TMA epoksi ve diğer reçineler için kür malzemesi olarak, vinil plastikleştiricilerde, yağlı boya ve kaplamalarda, polimer, polyester, zirai kimyasallar, boya ve pigmentlerde ve farmasötiklerde kullanılmaktadır. TMA sensitizasyonu ilk olarak Zeiss ve arkadaşları tarafından TMA sentezinde çalışan 14 işçinin solunum şikayetleri göstermesi ile kaydedilmiştir. TMA’nın çok düşük konsantrasyonlarında bile işçiler immünojenik sensitizasyon geliştirip, astım benzeri semptomlar gösterebilmektedir (Zeiss ve diğerleri, 1977). 30 TMA’e maruziyetin solunum yolu irritasyonu, rinit ve astım, ateş ve kırıklık gibi sistemik semptomlarla ilişkili geç faz astım ve akciğerde infiltratif bozukluklar gibi çok çeşitli klinik sendrom oluşturduğu gösterilmiştir (Zeiss ve diğerleri, 1977; Zhang ve diğerleri, 2004). TMA maruziyeti aynı zamanda çeşitli histolojik sonuçlara sahip akciğer hastalıklarına neden olmaktadır (Tao ve diğerleri, 1991). TMA ile indüklenen alerjik rinitin başlıca semptomları arasında kaşıntı, öksürük ve burun tıkanıklığı yer alır. TMA’nın indüklediği alerjik rinitin patolojik özellikleri plazma sızıntısı, aşırı mukus sekresyonu ile T ve B lenfositleri, eozinofil ve plazma hücrelerinden oluşan nazal solunum yolunda selüler infiltrasyondur (WHO, 1999). TMA için Occupational Safety and Health Administration (OSHA) maruziyet standartı bulunmamaktadır. TMA’nın işyeri maruziyet seviyesini minimize etmek için solunum sensitizanları için valide edilmiş bir yönteme gereksinim vardır (NIOSH, 1978). TMA’nın insanlarda solunum sensitizasyonuna yol açmasının yanı sıra, hayvanlarda solunum yolları irritasyonuna neden olduğu bilinmektedir. Yüksek doz TMA’nın deriye uygulandıktan sonra lenf düğümü hücrelerinde IL-4, IL-10 ve IL-13 seviyelerindeki artışla birlikte Th2 yanıtlarını ve göreceli olarak düşük seviyede Th1 sitokini IFN-γ’yı indüklediği gösterilmiştir (Vanoirbeek ve diğerleri, 2006). Aynı zamanda TMA ve diğer asit anhidritler ile indüklenen astımla serum IgE seviyesi arasında ilişki bulunmuştur (Sailstad ve diğerleri, 2003; Roggen ve diğerleri, 2008). TMA, IgE antikoru aracılı mekanizma ile mesleki astıma yol açan düşük molekül ağırlığındaki kimyasallar arasında en iyi tanımlanandır (Dykewicz, 2009). Bu nedenle bir kimyasalın solunum sensitizasyon potansiyelinin değerlendirildiği bir çalışmada TMA pozitif kontrol olarak tercih edilmektedir. 2.7.3. Diasetil Diasetil (2,3-bütandion) suda çözünen uçucu di-keton yapısında, ısıtıldığında hızla buhar fazına geçen bir kimyasal madde olup, süt ürünleri, bira, şarap gibi birçok gıdanın bileşiminde doğal olarak bulunur (Lockey ve diğerleri, 2009). Diasetilin aynı zamanda çeşitli gıda ve içeceklere karakteristik tereyağı tadını vermek amacıyla katılan uçucu kimyasallardan biri olduğu bilinmektedir (Shibamoto, 2014). 31 Diasetil GRAS (Generally Regarded as Safe) listesinde olup (FDA, 2001), kendine has tereyağı benzeri tada sahip olduğundan gıda maddelerinin hazırlanmasında 6-9 µg/g düzeylerinde yaygın bir şekilde kullanılır. İlk olarak 1985 yılında diasetilin tatlandırıcı olarak kullanıldığı bir tesiste iki işçide bronşiyolitis obliteransı akla getiren karma obstrüktif akciğer hastalığı görülmüştür. Bronşiyolitis obliterans fibrotik veya inflamatuar prosesler sonucu gelişen bronşiyollerin kısmi veya tam obstrüksiyonu (obliterasyon) olarak tanımlanır. Bronşiyolitis obliterans hastalığında bronşiyoler epitelyumdaki granülasyon dokusunun proliferasyonu küçük havayollarının tıkanıklığına yol açar. Bronşiyeolitis obliterans ve diasetil toksisitesine ait patolojik mekanizmalar tam olarak aydınlatılmamıştır. Fibrozisin sitotoksik hasar veya kronik inflamasyonu takiben mekanizma hasarından kaynaklandığı düşünülür. Bronşiyolitis obliteransa immün aracılı mekanizmalar iştirak eder. Diasetil toksisitesine dair analizler patolojik mekanizma olarak reaktif oksijen türevleri aracılığı ile oksidatif stres oluşumunu göstermektedir. Bu durum metabolik fonksiyon bozukluğu, hücre sinyal etkileri ve protein etkileşimleri aracılığı ile toksik etki kaskatını indükleyerek hücresel aşırı duyarlılık ve fibrozise neden olmaktadır (Egilman ve Schilling, 2012). Diasetil maruziyeti ve bronşiyolitis obliterans arasındaki ilişki, 2000 yılında ABD’nin Missouri eyaletindeki mikrodalga patlamış mısır fabrikasında çalışan sekiz işçide görülen pulmoner fonksiyonlarda zayıflamanın diasetil maruziyetinden kaynaklandığını gösteren çalışma (Kreiss ve diğerleri, 2002) ile kurulmuştur. Bunun üzerine diasetile mesleki maruziyet birkaç gıda üretim ve tatlandırıcı tesisinde incelenmeye başlanmıştır (Parmet ve Von Essen, 2002; Akpinar-Elci ve diğerleri, 2004; Kanwal ve diğerleri, 2006; NIOSH, 2011). Missouri’de yaşanan olaydan sonra tanısı konulan bu hastalık “patlamış mısır hastalığı” olarak da isimlendirilmiştir (Schachter, 2002). Diasetilin deney hayvanlarında solunum toksisitesinin incelendiği kapsamlı çalışmalar yayımlandığından beri, tereyağı tatlandırıcısı üretim tesisleri gibi diasetil buharı ile ilişkili tesislerdeki işçiler arasında görülen mesleki sağlık sorunları sağlık otoritelerinin de dikkatlerini çekmeye başlamıştır. NIOSH, üretim fabrikalarında diasetil buharına maruz kalan işçiler için diasetil maruziyet limitleri önermiştir (Shibamoto, 2014). Ancak halen OSHA tarafından diasetil için kabul edilebilir maruziyet limitleri (PELs) belirlenmemiştir (OSHA, 2010). 32 İlk olarak diasetilin inhalasyon toksisitesi kaydedildiğinden, birçok çalışma fabrika işçileri arasındaki mesleki akciğer hastalığı üzerine odaklanmıştır (Shibamoto, 2014). 2012 yılında GHS (UN Globally Harmonized System of Classification and Labeling of Chemicals) Anderson ve arkadaşlarının (2011) çalışmasına göre diasetili deri sensitizanı olarak sınıflandırmıştır (NIOSH, 2013). Bu çalışmanın diasetilin sensitizasyon potansiyelinin incelendiği tek çalışma olmasından dolayı diasetilin sensitizasyon ile olan ilişkisinin immün mekanizmaları ile birlikte ortaya konmasına ihtiyaç vardır. Ayrıca diasetil yerine önerilen diasetil gibi diketon türevi tatlandırıcıların olası immünojenik etkilerinin de ileriye yönelik belirlenmesi sağlanabilir. Bir gıda katkı maddesinin GRAS olarak sınıflandırılması işçiyi değil tüketiciyi koruyan bir uygulamadır. GRAS sınıflandırması tatlandırıcının tüketici tarafından düşük konsantrasyonda oral yolla maruziyeti ile ilgilidir. Bu sınıflandırma, tatlandırıcıların üretiminin yapıldığı veya gıdaların üretiminde tatlandırıcıların kullanıldığı işyerlerinde inhalasyon maruziyeti gibi farklı bir yolla maruziyet için güvenliliği ifade etmemektedir (Hubbs ve diğerleri, 2002). Bu nedenle düzenleyici otoriteler tarafından işyeri ortamındaki diasetilin işçiler için güvenli seviyelerine yönelik kısıtlama getirilmesinin, risk yönetimi açısından önemi büyüktür. Diasetilin LLNA yöntemi ile sensitizanyon potansiyelinin değerlendirildiği birkaç çalışma bulunmaktadır (Roberts ve diğerleri, 1999; Anderson ve diğerleri, 2007). Roberts ve arkadaşları diasetil için EC3 değerini, Anderson ve arakadaşları tarafından kaydedilen değerden 10 kat daha fazla tespit etmiştir. Bunun nedenini kullandıkları fare ırklarının farklılığına bağlamışlardır (Anderson ve diğerleri, 2007). Anderson ve Roberts’ın yürütmüş olduğu LLNA ile diasetilin T hücre aracılı sensitizan olduğu ihtimaline dayanarak, Dworak ve arkadaşları (2013) tarafından yürütülen QSAR çalışmasında, diasetilin sensitizan potansiyeli değerlendirilmiştir. Bu çalışmadaki temel prensip bir kimyasalın sensitizan olarak belirlenmesi için o kimyasalın yeterli derecede mevcut proteinlerde değişiklik yapması gerektiğidir. Solunum sensitizanlarının protein modifikasyonu eşik düzeyinin deri sensitizanlarından daha yüksek olduğu ortaya konmuştur. Bu eşik, kimyasalların yüksek elektrofiliteye sahip olması ile elde edilebilir. α,β-diketon yapısındaki toluen-2,4-diizosiyanatın (TDI) oldukça yüksek elektrofilik potent deri sensitizanı olduğu bilinmektedir. Diasetilin α,β-diketon yapısından dolayı TDI ile karşılaştırmalı olarak sensitizasyon potansiyeli incelenmiştir. Sonuç olarak diasetilin 33 TDI’dan 400 kat daha az reaktif olduğu ve zayıf sensitizan olarak değerlendirebileceği belirtilmiştir (Dworak ve diğerleri, 2013). Solunum alerjenleri için en yaygın maruziyet yolunun inhalasyon olduğu düşünülse de, dermal uygulamanın da solunum bölgesinin sensitizasyonuna yol açtığın gösteren birçok çalışma mevcuttur. TMA’ya topikal maruziyetin ratlarda sensitizasyon geliştirdiği Zhang ve arkadaşlarının (2004) bir çalışmasında gösterilmiştir. Doğal kauçuk lateksin lateksözgül IgE üretimi artırdığı ve solunum yolu hiperaktivitesine neden olduğu Howell ve arkadaşları (2002) tarafından gösterilmiştir (Anderson ve diğerleri, 2007). Bunlar dışında dermal temas yoluyla klinik semptomların tetiklenebileceği deneysel olarak gösterilmiştir (Kimber ve Dearman, 2002; Ban ve diğerleri, 2006; Dearman ve diğerleri, 2009). Bu literatür örnekleri doğrultusunda, diasetilin dermal maruziyeti sonucu olası sensitizasyon etkinliğini değerlendirmeyi uygun bulduk. Bu zamana kadar diasetilin sitokin salım profilinin tamamının ortaya konduğu bir çalışma mevcut değildir. Çalışmamızda öncelikle LLNA yöntemi ile immün yanıtın göstergesi olarak lenfosit proliferasyonun indüklenip indüklenmeyeceği, ardından solunum sensitizanların gösterdiği Th2 tip sitokin salım profilini yansıtıp yansıtmayacağı araştırılacaktır. 2.8. Alternatif in vitro ve in siliko Yöntemler Deri sensitizasyonun değerlendirmesi günümüzde hayvan testlerine dayanmaktadır. 2013’te EU Kozmetik Yönetmeliği’nde (76/768/EEC) yürürlüğe konan kozmetik bileşenlerinin dermal sensitizasyon potansiyellerinin in vivo test edilmesine yönelik yasağı ile birlikte EU REACH programı, kimyasalların sensitizasyon potansiyellerinin tahmini için in vitro ve in siliko modellerin geliştirilmesi çalışmalarını hızlandırmıştır (Thyssen ve diğerleri, 2012). Bir kimyasalın temas sensitizanı (antijen) olarak etki gösterebilmesi için deriye penetre olması, proteinle etkileşmesi ve immün hücreler tarafından antijenik olarak tanınması gibi çeşitli özelliklere sahip olması gerekmektedir. Alerjideki bu üç temel belirleyici unsurun in vitro test şemasına dahil edilmesi gerekmektedir. Mekanizma temelli in vitro yöntem geliştirilmesine dair farklı alanlarda araştırmalar mevcuttur: 1) kimyasalların canlı 34 epidermis veya dermise deri penetrasyonu modeli; 2) bilgisayar temelli yaklaşımlar (QSAR); 3) peptid veya proteinlerle metabolik aktivasyon ile veya aktivasyona ihtiyaç duymadan kimyasal reaktifliğinin kantitatif ölçümü; ve 4) kimyasal alerjenlerin dendritik hücreler ve T hücreleri tarafından tanınmasını model alan hücre temelli in vitro testler (Ryan, 2008). 2.8.1. İn siliko testler Kimyasalların elektrofilik özelliklerinin belirlenmesi çalışmanın temelini oluşturup, kimyasal yapı ve sensitizasyon yanıtı arasındaki kalitatif ilişki incelenmektedir. Haptenprotein kompleksi oluşumunun deri sensitizasyonu gelişiminin ön koşulu olduğu ilk kez bu çalışma ile ortaya konmuştur (Thyssen ve diğerleri, 2012). Yeni ve mevcut kimyasallar için düzenleyici ve bilim komiteleri arasında fikir birliği sağlanamaması ve hangi sistemin güvenilir olduğu netlik kazanmadığından QSAR kullanımım sınırlandırılmıştır. Kullanılan ticari sistemler arasında Derek for Windows (UK), TopKat (ABD) ve TIMES’tır (Bulgaristan) (Ryan, 2008). 2.8.2. İn chemico testler İn chemico testler sensitizanın kovalent katım yapmak üzere proteinle etkileşme yeteneği ile sensitizasyon oluşturma potansiyeli arasındaki ilişkiye dayanmaktadır. İn siliko yöntemlerdeki hesaplamanın aksine, in chemico yöntemler deneysel ölçüm parametrelerine dayanır (Thyssen ve diğerleri, 2012). Direct Peptide Reactivity Assay (DPRA) ECVAM tarafından pre-validasyon değerlendirmesi aşamasında olan bu test (Thyssen ve diğerleri, 2012), kimyasalın proteine veya peptid molekülüne bağlanma kabiliyetini değerlendiren in chemico bir yöntemdir (Divkovic ve diğerleri, 2005). 2.8.3. Hücresel testler Bu yöntemler izole edilmiş hücreler veya hücre dizilerinin kullanımına dayanır. Kimyasallar tarafından çeşitli antijen sunan hücreler üzerinde indüklenen fenotipik değişikliklerin incelenmesi temel yaklaşımlardan biridir. Antijen sunan hücrelerin deriden 35 izolasyonu güç olduğundan dendritik hücrelerin yerine ticari insan hücre dizileri kullanılmaktadır (Casati ve diğerleri, 2005). İn vitro yöntemlerin birinde temas alerjenlerine maruziyeti takiben THP-1 hücreleri üzerindeki CD86 ve CD54 ekspresyonu incelenmiştir (Ashikaga et al, 2006). U937 hücreleri dendritik hücrelerin yerine kullanılan başka bir hücre hattıdır ve Python ve arkadaşları (2007) tarafından geliştirilmiştir. CD86 hücre yüzey ekspresyonu ile IL-1β ve IL-18 gen ekspresyonu incelenir. MUTZ-3 hücrelerinde hücre yüzey marker’ının ekspresyonundaki değişiklikler kimyasalların sensitizasyon potansiyelinin belirlenmesi amacıyla önerilen diğer bir in vitro yöntemdir (Azam et al, 2006). Human cell activation test (h-CLAT) ve myeloid U937 skin sensitization test (MUSST) pre-validasyon aşamasında ECVAM tarafından incelenmektedir. 36 37 3. GEREÇ VE YÖNTEM 3.1. Kimyasallar 3.1.1. Topik uygulanan negatif kontrol 2,4-dinitroklorobenzen (DNCB) (Sigma, Almanya) Çözücü: Aseton (Riedel-de Haen, Almanya) : zeytin yağı (Sigma-Aldrich, Almanya) (4:1) AOO (hacim/hacim) Uygulanan konsantrasyon: %1 (ağırlık/hacim) 3.1.2. Topik uygulanan pozitif kontrol Trimellitik anhidrit (TMA) (Merck, Almanya) Çözücü: AOO (4:1) (v/v) Uygulanan konsantrasyon: %10 (a/h) 3.1.3. Topik uygulanan test materyali Diasetil (Merck, Almanya) Çözücü: AOO (4:1) (v/v) Uygulanan konsantrasyon: %10 (a/h) 3.1.4. Diğer kimyasallar Fötal Bovine Serum (Biological Industries, İsrail) Penisilin-Streptomisin (Biological Industries, İsrail) Glutaminli RPMI 1640 (Sigma, ABD) PBS (Fosfat Tampon Çözeltisi) (Sigma, ABD) Fitohemaglutinin (PHA) (Biochrom, Almanya) Tripan mavisi (Biological Industries, İsrail) BrdU-hücre proliferasyonu kiti (Merck Millipore, Almanya) Fare IFN-γ ELISA kiti (Bender MedSystems, ABD) Fare IL-2 ELISA kiti (Bender MedSystems, ABD) Fare IL-4 ELISA kiti (Bender MedSystems, ABD) 38 Fare IL-5 ELISA kiti (Bender MedSystems, ABD) Fare IL-10 ELISA kiti (Boster Immunoleader, ABD) Fare IL-13 ELISA kiti (Bender MedSystems, ABD) Fare IgE ELISA kiti (USCN Life Science Inc., Cloud-Clone Corp, ABD) 3.2. Kullanılan Alet ve Malzemeler %5 CO2’li, su ceketli inkübatör (Sanyo, Japonya) Vorteks (Nüve NM110, Türkiye) Otomatik otoklav (Sanyo, Japonya) Doku homojenizatörü (Torrey Pines Scientific, ABD) Laminar air flow (Clean Air, Biohazard EN 12469) Mikroskop (CETİ, Belçika) Soğutmalı santrifüj (Sigma, ABD) Terazi (Sartorius, Almanya) Otomatik pipet (Jencons, ABD) Çok kanallı otomatik pipet (Ependorf, Almanya) Membran filtre (0,2 µm, Sartorius, Almanya) Steril tüpler (Grenier bio-one, Almanya) Steril petri kabı (Grenier bio-one, Almanya) Steril 24 kuyucuklu plak (Grenier bio-one, Almanya) Steril 96 kuyucuklu plak (Grenier bio-one, Almanya) Neubauer lamı (Marienfeld, Almanya) Otomatik mikroplaka yıkayıcısı (Rayko, Çin) ELISA plak okuyucusu (SpectraMAX, Molecular Devices Inc., ABD) 3.3. Deney Hayvanı Gazi Üniversitesi Hayvan Deneyleri Yerel Etik Kurulu’ndan onay aldıktan sonra çalışmalara başlandı. Deney hayvanı olarak 8-12 haftalık dişi BALB/c fareler kullanıldı. Fareler Kobay A.SŞ.’den temin edildi. Gazi Üniversitesi Laboratuvar Hayvanları Yetiştirme ve Deneysel Araştırmalar Merkezi (GÜDAM)’da 23°C’de, %55 nem oranına sahip, 12 saat gece ve 12 saat gündüz koşullarını sağlayan bir ortamda barındırıldı. 39 3.4. Lenfosit Proliferasyonunun Lenf Düğümü Hücrelerinde BrdU ile ex vivo Ölçümü Çalışmamızda, Vandebriel ve arkadaşları (2000) ile Dearman ve arkadaşlarının (2003, 2009) kullandığı protokollerden yola çıkarak deney protokolünü oluşturduk. Buna göre tez çalışmamız 13 günlük kronik maruziyet protokolü ile kısa süreli maruziyet protokolünü içermektedir. 3.4.1. Kısa süreli maruziyet Deney hayvanları pozitif, negatif kontrol grubu ve test materyali grubunda 5’er adet, çözücü grubunda 10 adet olacak şekilde tartılarak gruplandırıldı. Maddelerin belirtilen konsantrasyonları 3 gün boyunca farelerin kulak arkalarına 25 µl olacak şekilde topik olarak uygulandı. 4. gün deney hayvanları dinlendirildi. 5. gün farelerin kardiyak ponksiyon ile kanları alınıp, eppendorf tipi mikrotüplere kondu. Her iki auriküler lenf düğümü steril koşullarda çıkartıldı ve steril petri kaplarına aktarılarak tartıldı. 3.4.2. Kronik maruziyet Deney hayvanları pozitif, negatif kontrol grubu ve test materyali grubunda 5’er adet, çözücü grubunda 10 adet olacak şekilde tartılarak gruplandırıldı. Maddelerin belirtilen konsantrasyonları ilk gün farelerin flank bölgelerine 50 µl olacak şekilde topik olarak uygulandı. 4 ardışık gün dinlendirmeden sonra ilk gün yapılan uygulama 6. gün tekrar edildi. 4 ardışık gün daha fareler dinlendirildikten sonra, 10., 11. ve 12. günlerde kulak arkalarına maddelerin aynı konsantrasyonu 25 µl olacak şekilde topik olarak uygulandı. 13. gün farelerin kardiyak ponksiyon ile kanları alınıp, eppendorf tipi mikrotüplere kondu. Her iki auriküler lenf düğümü steril koşullarda çıkartıldı ve steril petri kaplarına aktarılarak tartıldı. Hem kronik hem de kısa süreli maruziyet sonrası çıkarılan lenf düğümleri soğuk PBS içeren tüplere konuldu. Homojenizatör ile düşük devirde parçalandı. Açığa çıkan hücreler 40 PBS ile iki kez yıkandı ve dipte kalan lenfosit süspansiyonu 100 µl FBS, 10 µl penisilinstreptomisin, 20 µl fitohemaglutinin (PHA) eklenip RPMI-1640 ile1 ml’ye tamamlandı. 1 ml’lik lenfosit çözeltisinden 30 µl alındı ve üzerine 30 µl tripan mavisi eklendi, karıştırıldı. Neubauer sayım lamı üzerine alınan 30 µl lenfosit çözeltisi - tripan mavisi karışımının üzeri lamel ile kapatıldı ve lenfositlerin canlılığını yitirmemesi için hemen sayım yapıldı (dilüsyon faktörü 2’dir). 1 2 3 6 5 4 7 8 9 1, 3, 5, 7 ve 9 numaralı karelerdeki hücreler sayıldı. Sayılan 5 karedeki hücrelerin ortalaması alındı, dilüsyon faktörü ve 104 ile çarpılarak 1 ml’deki hücre sayısı hesaplandı. 96 kuyucuklu hücre kültürü plaklarında 2x105 hücre/kuyucuk olacak şekilde hazırlanan medium ile 100 µl’ye tamamlanarak ekim yapıldı. %5 CO2 içeren 37°C sıcaklıktaki etüve kaldırılıp 48 saat inkübasyona bırakıldı. 48. saat sonunda hücrelerin bulunduğu kuyucuklara BrdU eklendi ve 24 saat inkübe edildi. 24. saatin sonunda etüvden alınıp mediumları aspire edildi. 1000 rpm’de 5 dakika santrifüj edildikten sonra her bir kuyucuğa 200 µl Fixing Solution konuldu. 30 dakika oda sıcaklığında karanlıkta inkübasyona bırakıldı. İnkübasyon sonrası Fixing çözeltisi aspire edildi ve yıkama çözeltisi ile mikroplaka yıkayıcısı ile bir kez yıkama işlemi yapıldı. Kuyucuklara 100 µl Anti-BrdU çözeltisi eklendi, 1 saat oda sıcaklığında inkübe edildi. 1 saat sonunda yıkama çözeltisi ile yıkama yapıldıktan sonra kuyucuklara 100 µl substrat çözeltisi eklendi. Plak oda sıcaklığında karanlıkta 30 dakika bekletildikten sonra kuyucuklara 100µl Stop çözeltisi eklendi ve pozitif kuyucukların renginin maviden parlak sarıya değiştiği gözlendi. Hemen ardından 450 nm’de ELISA mikroplaka okuyucuda okutuldu ve optik dansite değerleri (OD450) ölçüldü. 41 3.5. ELISA Yöntemi ile Sitokin ve IgE Antikoru Analizlerinin Temel Prensibi (1) (2) (3) (4) (5) Şekil 3.1. ELISA yöntemi ile sitokin ve antikoru ölçümü. (1) Plaktaki kuyucuklar uygun bir antikorla kaplanır. (2) Standart ve örnek içindeki ilgili antijen (sitokin) kaplı antikora bağlanır. (3) Biotin konjugatlı ikincil antikor eklenir, antijene bağlanır. (4) Streptavidin-HRP eklenir ve biotin konjugatlı ikincil antikora bağlanır. (5) Standart ve örnek içindeki antijen miktarına göre renklenme (mavi) gözlenir. Durdurma (stop) çözeltisi olarak asit eklenir ve reaksiyon sona erdirilir, mavi renk sarıya döner. Sarı rengin şiddeti spektrofotometrik olarak 450 nm’de okunur. 3.6. Ex vivo BrdU Katım Yöntemi Uygulanarak Elde Edilen Lenfosit Kültürlerinde Sitokin Düzeylerinin Ölçümü Sitokin ölçümü için, lenf düğümleri homojenize edildikten sonra iki kez PBS ile yıkandı. Süpernatantları atıldı ve dipteki lenfosit hücreleri daha önceden hazırlanan RPMI-1640 kültür ortamı ile 1 ml’ye tamamlandı. Tripan mavisi ile boyandıktan sonra Neubauer lamı ile sayım yapılarak ml’deki hücre sayısı hesaplandı. ml’de 5x106 hücre olacak şekilde 24 kuyucuklu hücre kültürü plaklarına ekim yapıldı. %5 CO2 içeren 37°C sıcaklıktaki etüvde 72 saat inkübe edildi. 72. saatin sonunda 24 kuyucuklu plaklar 150 g’de 5 dakika santrifüj edildi. Süpernatantlar 3 farklı eppendorfa bölündü ve ELISA ile yapılacak sitokin analizlerine kadar saklanmak üzere -80°C’lik derin dondurucuya yerleştirildi. 3.6.1. IFN-γ ölçümü Bender MedSystems Mouse IFN-γ ELISA kiti (Katalog no: BMS606) kullanılarak ölçüm yapıldı. Kit protokolüne göre, IFN-γ için spesifik bir antikorla kaplanmış plaklar ilk olarak 400 µl yıkama çözeltisi ile iki kez otomatik ELISA yıkayıcısında yıkandı. Yıkama sırasında plaklar yıkama çözeltisi ile 10-15 saniye bekletildikten sonra aspire edildi. 42 Mikrokuyucukların alt yüzeylerinin aspirasyon sırasında zedelenmemesine dikkat edildi. Yıkamanın hemen ardından 50 µl 7 farklı konsantrasyonda (1000-500-250-125-62,5-31,315,6 pg/ml) hazırlanmış standartlar ve örnekler eklendi. Dublike çalışıldı. 50 µl örnek çözeltisi standart ve örnek bulunan kuyucuklara eklendi. Biotin konjugatı hazırlandı ve 50 µl eklendi. Yapışkanlı film ile kaplandı ve oda sıcaklığında (18-25°C) 2 saat inkübe edildi. 2 saatin sonuna doğru streptavidin-HRP hazırlandı. İnkübasyon süresi bittikten sonra yapışkanlı film kaldırıldı ve kuyucuklar boşaltıldı. Kuyucuklar 3 kez otomatik ELISA yıkayıcısında yıkandı. Ardından 100 µl streptavidin-HRP bütün kuyucuklara eklendi. Yapışkanlı film ile kaplandı ve oda sıcaklığında 1 saat inkübe edildi. 1 saatin sonunda yapışkanlı film kaldırıldı ve kuyucuklar boşaltıldı. Kuyucuklar 3 kez yıkandı. Bütün kuyucuklara 100 µl TMB substrat çözeltisi eklendi. 10 dakika oda sıcaklığında ve karanlıkta inkübe edildikten sonra renk değişimi gözlendi. 100 µl stop solüsyonu eklendi, rengin maviden sarıya değişimi gözlendi ve ELISA okuyucuda 450 nm’de standartların ve örneklerin optik dansiteleri ölçüldü (OD450). Standart eğri grafiği çizildi, doğru denklemi bulundu ve bu denklemden hareketle örneklerin IFN-γ miktarları hesaplandı. 1,4 y = 0,0012x + 0,1122 R² = 0,9967 1,2 1 OD450 0,8 0,6 0,4 0,2 0 0 200 400 600 800 1000 1200 Konsantrasyon (pg/ml) Şekil 3.2. IFN-γ miktarının ölçümünde kullanılan standart doğru denklemi 3.6.2. IL-2 ölçümü Bender MedSytems Mouse IL-2 ELISA kiti (Katalog no:BMS601) kullanılarak ölçüm yapıldı. Kit protokolüne göre, IL-2 için spesifik bir antikorla kaplanmış plaklar ilk olarak 400 µl yıkama çözeltisi ile iki kez otomatik ELISA yıkayıcısında yıkandı. Yıkama sonrası plaklar yıkama çözeltisi ile 10-15 saniye bekletildikten sonra aspire edildi. Mikrokuyucukların alt yüzeylerinin aspirasyon sırasında zedelenmemesine dikkat edildi. Yıkamanın hemen ardından 50 µl 7 farklı konsantrasyonda (1000-500-250-125-62,5-31,3- 43 15,6 pg/ml) hazırlanmış standartlar ve örnekler eklendi. Dublike çalışıldı. 50 µl örnek çözeltisi standart ve örnek bulunan kuyucuklara eklendi. Biotin konjugatı hazırlandı ve 50 µl eklendi. Yapışkanlı film ile kaplandı ve oda sıcaklığında 2 saat inkübe edildi. 2 saatin sonuna doğru streptavidin-HRP hazırlandı. İnkübasyon süresi bittikten soa yapışkanı film kaldırıldı ve kuyucuklar boşaltıldı. Kuyucuklar 3 kez yıkandı. Ardından 100 µl streptavidin-HRP bütün kuyucuklara eklendi. Plak yapışkanlı film ile kaplandı ve oda sıcaklığında 1 saat inkübe edildi. 1 saatin sonunda yapışkanlı film kaldırıldı ve kuyucuklar boşaltıldı. Kuyucuklar 3 kez yıkandı. Bütün kuyucuklara 100 µl TMB substrat çözeltisi eklendi. 10 dakika oda sıcakığında ve karanlıkta inkübe edildikten sonra renk değişimi gözlendi. 100 µl stop solüsyonu eklendi, rengin maviden sarıya değişimi gözlendi ve ELISA okuyucuda 450 nm’de standartların ve örneklerin optik dansiteleri ölçüldü. Standart eğri grafiği çizildi, doğru denklemi bulundu ve bu denklemden hareketle örneklerin IL-2 miktarları hesaplandı. 0,6 y = 0,0004x + 0,08 R² = 0,972 0,5 0,4 OD450 0,3 0,2 0,1 0 0 200 400 600 800 1000 1200 Konsantrasyon (pg/ml) Şekil 3.3. IL-2 miktarının ölçümünde kullanılan standart doğru denklemi 3.6.3. IL-4 ölçümü Bender MedSystems Mouse IL-4 ELISA kiti (Katalog no: BMS613) kullanılarak ölçüm yapıldı. Kit protokolüne göre, IL-4 için spesifik bir antikorla kaplanmış plaklar ilk olarak 400 µl yıkama çözeltisi ile iki kes yıkandı. Yıkama sırasında plaklar yıkama çözeltisi ile 10-15 saniye bekletildikten sonra aspire edildi. Mikrokuyucukların alt yüzeylerinin aspirasyon sırasında zedelenmemesine dikkat edildi. Yıkamanın hemen ardından 50 µl 7 farklı konsantrasyonda (250-125-62,5-31,3-15,6-7,8-3,9 pg/ml) hazırlanmış standartlar ve örnekler eklendi. Dublike çalışıldı. 50 µl örnek çözeltisi standart ve örnek bulunan kuyucuklara eklendi. Biotin konjugatı hazırlandı ve 50 µl eklendi. Yapışkanlı film ile 44 kaplandı ve oda sıcaklığında 2 saat inkübe edildi. 2 saat bittikten sonra yapışkanlı film kaldırıldı ve kuyucuklar boşaltıldı. Kuyucuklar 3 kez yıkandı. Ardından 100 µl streptavidin-HRP bütün kuyucuklara eklendi. Yapışkanlı film ile kaplandı ve oda sıcaklığında 1 saat inkübe edildi. 1 saatin sonunda yapışkanlı film kaldırıldı ve kuyucuklar boşaltıldı. Kuyucuklar 3 kez yıkandı. Bütün kuyucuklara 100 µl TMB substrat çözeltisi eklendi. 10 dakika oda sıcaklığında ve karanlıkta inkübe edildikten sonra renk değişimi gözlendi. 100 µl stop solüsyonu eklendi, rengin maviden sarıya değişimi gözlendi ve ELISA okuyucuda 450 nm’de standartların ve örneklerin optik dansiteleri ölçüldü. Standart eğri grafiği çizildi, doğru denklemi bulundu ve bu denklemden hareketle örneklerin IL-4 miktarları hesaplandı. 2 y = 0,0069x + 0,13 R² = 0,89 1,5 OD450 1 0,5 0 0 50 100 150 200 250 300 Konsantrasyon (pg/ml) Şekil 3.4. IL-4 miktarının ölçümünde kullanılan standart doğru denklemi 3.6.4. IL-5 ölçümü Bender MedSystems Mouse IL-5 ELISA kiti (Katalog no: BMS610) kullanılarak ölçüm yapıldı. Kit protokolüne göre, IL-5 için spesifik bir antikorla kaplanmış plaklar ilk olarak 400 µl yıkama çözeltisi ile iki kes yıkandı. Yıkama sırasında plaklar yıkama çözeltisi ile 10-15 saniye bekletildikten sonra aspire edildi. Mikrokuyucukların alt yüzeylerinin aspirasyon sırasında zedelenmemesine dikkat edildi. Yıkamanın hemen ardından 50 µl 7 farklı konsantrasyonda (500-250-125-62,5-31,3-15,6-7,8 pg/ml) hazırlanmış standartlar ve örnekler eklendi. Dublike çalışıldı. 50 µl örnek çözeltisi standart ve örnek bulunan kuyucuklara eklendi. Biotin konjugatı hazırlandı ve 50 µl eklendi. Yapışkanlı film ile kaplandı ve oda sıcaklığında 2 saat inkübe edildi. 2 saat bittikten sonra yapışkanlı film kaldırıldı ve kuyucuklar boşaltıldı. Kuyucuklar 3 kez yıkandı. Ardından 100 µl 45 streptavidin-HRP bütün kuyucuklara eklendi. Yapışkanlı film ile kaplandı ve oda sıcaklığında 1 saat inkübe edildi. 1 saatin sonunda yapışkanlı film kaldırıldı ve kuyucuklar boşaltıldı. Kuyucuklar 3 kez yıkandı. Bütün kuyucuklara 100 µl TMB substrat çözeltisi eklendi. 10 dakika oda sıcaklığında ve karanlıkta inkübe edildikten sonra renk değişimi gözlendi. 100 µl stop solüsyonu eklendi, rengin maviden sarıya değişimi gözlendi ve ELISA okuyucuda 450 nm’de standartların ve örneklerin optik dansiteleri ölçüldü. Standart eğri grafiği çizildi, doğru denklemi bulundu ve bu denklemden hareketle örneklerin IL-5 miktarları hesaplandı. 1,2 y = 0,0017x + 0,124 R² = 0,9959 1 0,8 OD450 0,6 0,4 0,2 0 0 100 200 300 400 500 600 Konsantrasyon (pg/ml) Şekil 3.5. IL-5 miktarının ölçümünde kullanılan standart doğru denklemi 3.6.5. IL-10 ölçümü Boster Immunoleader Mouse IL-10 ELISA kiti (Katalog no: EK0417) kullanılarak ölçüm yapıldı. Kit protokolüne göre, IL-10 için spesifik bir antikorla kaplanmış plaklara 100 µl 7 farklı konsantrasyonda hazırlanmış standartlar (1000-500-250-125-62,5-31,3-15,6 pg/ml) ve örnekler kuyucuklara eklendi. Dublike çalışıldı. Yapışkanlı film ile kaplandı ve 37°C’de 90 dakika inkübe edildi. Yapışkanlı film kaldırıldı, kuyucuklar boşaltıldı. Her bir kuyucuğa 100 µl biotinlenmiş Anti – fare IL-10 antikoru çalışma çözeltisi eklendi ve 37°C’de 1 saat inkübe edildi. Kuyucuklar 3 kez yıkama çözeltisi ile yıkandı. Yıkama sırasında plaklar yıkama çözeltisi ile 1 dakika bekletildikten sonra aspire edildi. Mikrokuyucukların alt yüzeylerinin aspirasyon sırasında zedelenmemesine dikkat edildi. Ardından her bir kuyucuğa 100 µl ABC (Avidin-Biotin-Peroksidaz Kompleksi) çalışma çözeltisi eklendi ve 37°C’de 30 dakika inkübe edildi. Kuyucuklar yıkama çözeltisi ile 5 kez yıkandı. Yıkama 46 sırasında plaklar yıkama çözeltisi ile 1-2 dakika bekletildikten sonra aspire edildi. Kuyucuklar boşaltıldıktan sonra 90 µl TMB renk geliştirici ajan her bir kuyucuğa eklendi ve 37°C’de karanlıkta 20-25 dakika inkübe edildi. İnkübasyon sonrası 100 µl TMB stop çözeltisi kuyucuklara eklendi. Rengin anında sarıya değiştiği gözlendi. 30 dakika içinde ELISA okuyucuda 450 nm’de standartların ve örneklerin optik dansiteleri ölçüldü. Standart eğri grafiği çizildi, doğru denklemi bulundu ve bu denklemden hareketle örneklerin IL-10 miktarları hesaplandı. y = 0,0019x + 0,24 R² = 0,9723 2,5 2 OD450 1,5 1 0,5 0 0 200 400 600 800 1000 1200 Konsantrasyon (pg/ml) Şekil 3.6. IL-10 miktarının ölçümünde kullanılan standart doğru denklemi 3.6.6. IL-13 ölçümü Bender MedSystems Mouse IL-13 ELISA kiti (Katalog no: BMS6015) kullanılarak ölçüm yapıldı. Kit protokolüne göre, IL-13 için spesifik bir antikorla kaplanmış plaklar ilk olarak 400 µl yıkama çözeltisi ile iki kes yıkandı. Yıkama sırasında plaklar yıkama çözeltisi ile 10-15 saniye bekletildikten sonra aspire edildi. Mikrokuyucukların alt yüzeylerinin aspirasyon sırasında zedelenmemesine dikkat edildi. Yıkamanın hemen ardından 50 µl 7 farklı konsantrasyonda (500-250-125-62,5-31,3-15,6-7,8 pg/ml) hazırlanmış standartlar ve örnekler eklendi. Dublike çalışıldı. 50 µl örnek çözeltisi standart ve örnek bulunan kuyucuklara eklendi. Biotin konjugatı hazırlandı ve 50 µl eklendi. Yapışkanlı film ile kaplandı ve oda sıcaklığında 2 saat inkübe edildi. 2 saat bittikten sonra yapışkanlı film kaldırıldı ve kuyucuklar boşaltıldı. Kuyucuklar 3 kez yıkandı. Ardından 100 µl streptavidin-HRP bütün kuyucuklara eklendi. Yapışkanlı film ile kaplandı ve oda sıcaklığında 1 saat inkübe edildi. 1 saatin sonunda yapışkanlı film kaldırıldı ve kuyucuklar boşaltıldı. Kuyucuklar 3 kez yıkandı. Bütün kuyucuklara 100 µl TMB substrat çözeltisi 47 eklendi. 10 dakika oda sıcaklığında ve karanlıkta inkübe edildikten sonra renk değişimi gözlendi. 100 µl stop solüsyonu eklendi, rengin maviden sarıya değişimi gözlendi ve ELISA okuyucuda 450 nm’de standartların ve örneklerin optik dansiteleri ölçüldü. Standart eğri grafiği çizildi, doğru denklemi bulundu ve bu denklemden hareketle örneklerin IL-13 miktarları hesaplandı. 2,5 y = 0,0035x + 0,179 R² = 0,8964 2 OD450 1,5 1 0,5 0 0 100 200 300 400 500 600 Konsantrasyon (pg/ml) Şekil 3.7. IL-13 miktarının ölçümünde kullanılan standart doğru denklemi 3.7. Kardiyak Ponksiyon İşlemi ile Elde Edilen Kanda IgE Ölçümü Farelerin kalp boşluğundan alınan kandan IgE ölçümü için serum elde edildi. Bu amaçla öncelikle tüpler oda sıcaklığında 1 saat kanın pıhtılaşması için bekletildi. Tüpler 1500 g’de 10 dakika santrifüj edildikten sonra hızlı bir şekilde serumları alındı ve ELISA ile yapılacak total serum IgE miktarı ölçümü yapılana kadar saklanmak üzere -80°C’lik derin dondurucuya yerleştirildi. USCN Life Science Inc., Cloud-Clone Corp. Mouse IgE ELISA kiti (Katalog no: SEA545Mu) kullanılarak ölçüm yapıldı. Kit protokolüne göre, IgE için spesifik antikorla kaplanmış plaklarda ilk olarak 100 µl 7 farklı konsantrasyonda hazırlanmış standartlar (900-600-300-150-75 ng/ml) ve örnekler kuyucuklara eklendi ve 37°C’de 2 saat inkübe edildi. İnkübasyon sonrası kuyucuklar aspire edildi ve 100 µl Detection Reagant A ilave edildi. Plaklar 37°C’de 1 saat inkübe edildikten sonra aspire edildi ve 3 kez yıkama yapıldı. Kuyucuklara 100 µl Detecetion Reagent B eklendi ve 37°C’de yarım saat inkübe edildi. İnkübasyondan sonra aspire edildi ve 5 kez yıkama yapıldı. Yıkamadan sonra 90 µl substrat çözeltisi eklendi ve 37°C’de 15-25 dakika inkübasyona bırakıldı. İnkübasyondan 48 sonra 50 µl stop çözeltisi eklendikten hemen sonra ELISA okuyucuda 450 nm’de standartların ve örneklerin optik dansiteleri ölçüldü. Standart eğri grafiği çizildi, doğru denklemi bulundu ve bu denklemden hareketle örneklerin IgE miktarları hesaplandı. OD450 0,9 0,8 0,7 0,6 0,5 0,4 0,3 0,2 0,1 0 y = 0,0008x + 0,049 R² = 0,938 0 200 400 600 800 1000 Konsantrasyon (ng/ml) Şekil 3.8. IgE miktarının ölçülmesinde kullanılan standart doğru denklemi 3.8. İstatistiksel Analizler Sitokin düzeylerinin ortalama ve standart hata değerleri hesaplanmıştır. İstatiksel olarak anlam bulunduğunda, sadece çözücü uygulanan kontrol grubu ile test kimyasalının uygulandığı her bir grubun kıyaslanması Mann-Whitney test ile yapıldı. Bu testler, “IBM SPPS Statistics 20” programı kullanılarak yapılmıştır. 49 4. BULGULAR ve YORUM 4.1. Radyoaktif Olmayan ex vivo LLNA Yöntemi ile Kimyasalların Kısa Süreli Maruziyet Sonrası Alerji Potansiyellerinin Ölçülmesi ile İlgili Deney Sonuçları Solunum sensitizan potansiyelleri göz önüne alındığında negatif kontrol olan 2,4dinitroklorobenzenin (DNCB) %1’lik konsantrasyondaki çözeltisinin kısa süreli maruziyet sonucu ex vivo yöntemle tespit edilen OD450 sonuçları Çizelge 4.1.’de verilmiştir. Çizelge 4.1. DNCB’ye kısa süreli maruziyet sonucu ex vivo yöntemle tespit edilen OD450 sonuçları Kimyasal OD450 Ortalama Standart hata 0,1061 0,04097163 0,1745 0,0895 %1 DNCB (Çözücü: AOO) 0,087 0,069 0,1105 Solunum sensitizanı olduğu bilinen ve çalışmamızda pozitif kontrol olarak kullandığımız trimellitik anhidritin (TMA) %10’luk konsantrasyondaki çözeltisinin kısa süreli maruziyet sonucu ex vivo yöntemle tespit edilen OD450 sonuçları Çizelge 4.2.’de gösterilmiştir. Çizelge 4.2. TMA’ya kısa süreli maruziyet sonucu ex vivo yöntemle tespit edilen OD450 sonuçları Kimyasal OD450 Ortalama Standart hata 0,0776 0,01461762 0,065 0,083 %10 TMA (Çözücü: AOO) 0,079 0,0985 0,0625 50 Test maddemiz diasetilin %10’luk konsantrasyondaki çözeltisinin kısa süreli maruziyet sonucu ex vivo yöntemle tespit edilen OD450 sonuçları Çizelge 4.3.’te gösterilmiştir. Çizelge 4.3. Diasetile kısa süreli maruziyet sonucu ex vivo yöntemle tespit edilen OD450 sonuçları Kimyasal OD450 Ortalama Standart hata 0,0773 0,01393108 0,0975 0,074 %10 Diasetil 0,0845 (Çözücü: AOO) 0,068 0,0625 Çözücü olarak kullanılan aseton:zeytin yağının (AOO, 4:1) kısa süreli maruziyet sonucu ex vivo yöntemle tespit edilen OD450 sonuçları Çizelge 4.4.’te gösterilmiştir. Çizelge 4.4. Çözücüye kısa süreli maruziyet sonucu ex vivo yöntemle tespit edilen OD450 sonuçları Çözücü OD450 Ortalama Standart hata 0,07475 0,010763696 0,0645 Belirlenememiştir. 0,073 0,0615 AOO 0,0905 (4:1) Belirlenememiştir. 0,0755 0,0905 0,0695 0,073 51 DNCB, TMA VE diasetilin 3 günlük maruziyet sonrası BrdU ELISA kiti ile lenfosit proliferasyonu ölçümü sonrası elde edilen her bir gruba ait ortalama OD 450 değerleri Şekil 4.1.’de sütun grafiği üzerinde gösterilmiştir. 0,16 0,14 OD 450 0,12 0,1 0,08 0,06 0,04 0,02 0 DNCB Diasetil TMA AOO Şekil 4.1. Kısa süreli maruziyet sonucu lenfosit proliferasyonu ölçümü (OD450) 4.1.1. DNCB için stimülasyon indeksinin (SI) hesaplanması DNCB’nin ortalama optik dansite değeri SI = = 2,29 = 1,44 = 1,43 Çözücünün (AOO) ortalama optik dansite değeri 4.1.2. TMA için stimülasyon indeksinin (SI) hesaplanması TMA’nın ortalama optik dansite değeri SI = Çözücünün (AOO) ortalama optik dansite değeri 4.1.3. Diasetil için stimülasyon indeksinin (SI) hesaplanması Diasetilin ortalama optik dansite değeri SI = Çözücünün (AOO) ortalama optik dansite değeri Kimyasallarla indüklenen immün yanıt sonucunda gerçekleşen lenfosit proliferasyonunun göstergesi olan OD450 değerlerinin rölatif olarak değerlendirilip, stimülasyon indeksleri 52 hesaplanmıştır. Her üç kimyasal (DNCB, TMA ve diasetil) için de çözücüye kıyasla OD 450 değerlerinde artış gözlenmiştir. OECD TG 442B’de belirtildiği üzere, stimülasyon indeks (SI) değeri 1.6’dan büyük olan kimyasallar temas sensitizanı olarak kabul edilmektedir. Bu durumda önceki çalışmalardan da beklenildiği üzere (Adenuga ve diğerleri; Dearman ve diğerleri, 2009; Goutet ve diğerleri, 2012) DNCB’nin %1’lik konsantrasyonda alerjik temas dermatitine yol açma potansiyeline sahip olduğu gösterilmiştir. Solunum sensitizanı olduğu bilinen TMA’nın %10’luk konsantrasyonu lenfosit proliferasyonunda anlamlı bir artışa neden olmamıştır. Diasetil konsantrasyon seçimi Anderson ve arkadaşlarının (2007) elde ettiği sonuçları esas alarak yapılmıştır. Bu konsantrasyonda çözücü kontrolüne kıyasla lenfosit proliferasyonunda anlamlı bir sonuç elde edilmemiştir. Bu veriler doğrultusunda TMA’nın ve diasetilin uyguladığımız konsantrasyonlarda temas sensitizasyonu oluşturmadığı söylenebilir. 4.2. DNCB, TMA ve Diasetil Uygulanan Farelerin Kısa Süreli Maruziyet Sonrası Kulak Arkası Lenf Düğümlerinden Elde Edilen Lenfosit Hücre Kültürlerinde Sitokin Düzeylerinin Ölçümü 4.2.1. IFN-γ ölçümü %1’lik DNCB, %10’luk diasetil, %10’luk TMA ve çözücünün (AOO, 4:1) 3 günlük maruziyeti sonrası farelerin kulak arkası lenf düğümlerinden elde edilen lenfositler fitohemaglutininli kültür ortamında ekildikten sonra 72. saatte salınan IFN-γ sitokin düzeyleri, ELISA ile örneklerin optik dansitelerinin ölçümünden hareketle elde edilen standart doğru denkleminden hesaplandı. IFN-γ miktarı ölçümünde kullanılan standart doğru denklemi: y = 0,0012x + 0,1122 53 Çizelge 4.5. DNCB’ye kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IFN-γ düzeyleri Kimyasal %1 DNCB Absorbans (OD450) Konsantrasyon (pg/ml) 2,774 4436,315588 3,454 5569,644388 0,349 394,665088 3,285 5287,978848 3,743 6051,309128 Ortalama (Konsantrasyon) Standart hata 4347,982608 2286,585544 Çizelge 4.6. TMA’ya kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IFN-γ düzeyleri Kimyasal %10 TMA Absorbans (OD450) Konsantrasyon Ortalama (pg/ml) (Konsantrasyon) 3,831 6197,975208 4 6479,640748 3,782 6116,308868 3,662 5916,309668 3,937 6374,641168 6216,975132 Standart hata 220,6503001 Çizelge 4.7. Diasetile kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IFN-γ düzeyleri Kimyasal %10 Diasetil Absorbans (OD450) Konsantrasyon Ortalama (pg/ml) (Konsantrasyon) 0,278 276,332228 0,179 111,332888 0,275 271,332248 0,204 152,999388 0,146 56,333108 173,665972 Standart hata 97,6711109 54 Çizelge 4.8. Çözücüye kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IFN-γ düzeyleri Çözücü AOO (4:1) Absorbans (OD450) Konsantrasyon (pg/ml) 0,151 64,666408 0,155 71,333048 0,13 29,666548 0,146 56,333108 0,194 136,332788 0,159 77,999688 0,178 109,666228 0,152 66,333068 0,168 92,999628 0,171 97,999608 Ortalama (Konsantrasyon) Standart hata 80,333012 30,07386255 Kimyasalların indüklediği IFN-γ miktarları (pg/ml) Şekil 4.2.’deki gibi gösterilmiştir. IFN-γ düzeyi (pg/ml) 8000 ** ** 6000 4000 2000 0 DNCB Diasetil TMA AOO Şekil 4.2. Kısa süreli maruziyet sonrası kimyasallar tarafından indüklenen IFN-γ miktarı ** 0,001≤p<0,01; çözücü kontrol grubuna (AOO) göre istatiksel olarak yüksek anlamlı farklılık (Mann Whitney test). Temas sensitizanı DNCB’nin %1’lik konsantrasyonu kısa süreli maruziyet sonrası IFN-γ miktarında beklediğimiz gibi istatistiksel olarak yüksek derecede anlamlı artışa neden olmuştur. (p<0,01). TMA da IFN-γ düzeyinde AOO grubuna göre anlamlı artış göstermiştir (p<0,01). Diasetilin indüklediği IFN-γ ise istatistiksel anlamlılık sınırında kalmıştır (0,05≤p<0,1). 55 4.2.2. IL-2 ölçümü %1’lik DNCB, %10’luk diasetil, %10’luk TMA ve çözücünün (AOO, 4:1) 3 günlük maruziyeti sonrası farelerin kulak arkası lenf düğümlerinden elde edilen lenfositler fitohemaglutininli kültür ortamında ekildikten sonra 72. saatte salınan IFN-γ sitokin düzeyleri, ELISA ile örneklerin optik dansitelerinin ölçümünden hareketle elde edilen standart doğru denkleminden hesaplandı. IL-2 miktarı ölçümünde kullanılan standart doğru denklemi: y = 0,0004x + 0,08 Çizelge 4.9. DNCB’ye kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-2 düzeyleri Kimyasal %1 DNCB Absorbans (OD450) 0,583 0,096 0,121 0,196 0,125 Konsantrasyon Ortalama (pg/ml) (Konsantrasyon) 2515 80 721 205 580 225 Standart hata 1019,984069 Çizelge 4.10. TMA’ya kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-2 düzeyleri Kimyasal %10 TMA Absorbans (OD450) 0,12 0,134 0,126 0,125 0,17 Konsantrsyon (pg/ml) 200 270 230 225 450 Ortalama (Konsantrasyon) Standart hata 275 100,9950494 Çizelge 4.11. Diasetile kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-2 düzeyleri Kimyasal %10 Diasetil Absorbans (OD450) 0,337 0,257 0,122 0,326 0,14 Konsantrasyon Ortalama (pg/ml) (Konsantrasyon) 1285 885 782 210 1230 300 Standart hata 505,9224249 56 Çizelge 4.12. Çözücüye kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-2 düzeyleri Çözücü Absorbans (OD450) Konsantrasyon (pg/ml) Ortalama Standart hata (Konsantrasyon) 0,324* AOO (4:1) 0,129 245 0,099 95 0,095 75 0,105 125 0,096 80 0,098 90 0,146 330 0,281 166,875 105,5237786 * 0,139 295 * İstatistiksel hesaplamaya dahil edilmemiştir. Kimyasalların indüklediği IL-2 miktarları (pg/ml) Şekil 4.3.’teki gibi gösterilmiştir. IL-2 düzeyi (pg/ml) 2000 * 1500 1000 500 0 DNCB Diasetil TMA AOO Şekil 4.3. Kısa süreli maruziyet sonrası kimyasallar tarafından indüklenen IL-2 miktarı * 0,01≤p<0,05; çözücü kontrol grubuna (AOO) göre istatistiksel anlamlı farklılık (Mann-Whitney test). IL-2 düzeyi, kısa süreli maruziyet sonrası sadece diasetil için çözücü kontrol grubuna göre istatistiksel olarak anlamlı bir artış göstermiştir. 4.2.3. IL-4 ölçümü %1’lik DNCB, %10’luk diasetil, %10’luk TMA ve çözücünün (AOO, 4:1) 3 günlük maruziyeti sonrası farelerin kulak arkası lenf düğümlerinden elde edilen lenfositler fitohemaglutininli kültür ortamında ekildikten sonra 72. saatte salınan IFN-γ sitokin 57 düzeyleri, ELISA ile örneklerin optik dansitelerinin ölçümünden hareketle elde edilen standart doğru denkleminden hesaplandı. IL-4 miktarı ölçümünde kullanılan standart doğru denklemi: y = 0,0069x + 0,13 Çizelge 4.13. DNCB’ye kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-4 düzeyleri Kimyasal %1 DNCB Absorbans (OD450) Konsantrasyon (pg/ml) 0,868 214,02 0,859 211,41 0,188 16,82 1,79 481,4 1,725 462,55 Ortalama (Konsantrasyon) Standart hata 277,24 195,0449 Çizelge 4.14. TMA’ya kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-4 düzeyleri Kimyasal %10 TMA Absorbans (OD450) Konsantrasyon (pg/ml) 2,947 816,93 4 1122,3 3,558 994,12 3,824 1071,26 3,085 856,95 Ortalama (Konsantrasyon) Standart hata 972,312 132,4902 Çizelge 4.15. Diasetile kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-4 düzeyleri Kimyasal %10 Diasetil Absorbans (OD450) Konsantrasyon (pg/ml) 2,618 721,52 0,541 119,19 0,168 11,02 1,023 258,97 0,188 16,82 Ortalama (Konsantrasyon) Standart hata 225,504 294,9606 58 Çizelge 4.16. Çözücüye kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-4 düzeyleri Çözücü AOO (4:1) Absorbans (OD450) Konsantrasyon (pg/ml) 0,179 14,21 0,154 6,96 0,142 3,48 0,149 5,51 0,149 5,51 0,146 4,64 0,162 9,28 0,173 12,47 0,212 23,78 0,388 74,82 Ortalama (Konsantrasyon) Standart hata 16,066 21,52183 Kimyasalların indüklediği IL-4 miktarları (pg/ml) Şekil 4.4.’teki gibi gösterilmiştir. ** 1200 IL-4 düzeyi (pg/ml) 1000 800 600 ** * 400 200 0 DNCB Diasetil TMA AOO Şekil 4.4. Kısa süreli maruziyet sonrası kimyasallar tarafından indüklenen IL-4 miktarı * 0,01≤p<0,05; çözücü kontrol grubuna (AOO) göre istatistiksel anlamlı farklılık (Mann-Whitney test). ** 0,001≤p<0,01; çözücü kontrol grubuna (AOO) göre istatiksel olarak yüksek anlamlı farklılık (Mann Whitney test). IL-4 miktarında, kısa süreli maruziyet sonrası TMA için öngördüğümüz üzere çözücü kontrol grubuna göre yüksek istatistiksel anlamlılık elde edilmiştir (p<0,01). Ayrıca DNCB de kısa süreli maruziyet sonrası IL-4 düzeyini anlamlı derecede artırmıştır (p<0,01). Diasetil, çözücü kontrol grubuna göre IL-4 sitokin artışını anlamlı düzeyde stimüle etmiştir (p<0,05). 59 4.2.4. IL-5 ölçümü %1’lik DNCB, %10’luk diasetil, %10’luk TMA ve çözücünün (AOO, 4:1) 3 günlük maruziyeti sonrası farelerin kulak arkası lenf düğümlerinden elde edilen lenfositler fitohemaglutininli kültür ortamında ekildikten sonra 72. saatte salınan IFN-γ sitokin düzeyleri, ELISA ile örneklerin optik dansitelerinin ölçümünden hareketle elde edilen standart doğru denkleminden hesaplandı. IL-5 miktarı ölçümünde kullanılan standart doğru denklemi: y = 0,0017x + 0,124 Çizelge 4.17. DNCB’ye kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-5 düzeyleri Kimyasal %1 DNCB Absorbans (OD450) Konsantrasyon (pg/ml) 0,237 132,888 0,572 526,848 0,263 163,464 0,354 270,48 0,455 389,256 Ortalama (Konsantrasyon) Standart hata 296,5872 163,4077 Çizelge 4.18. TMA’ya kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-5 düzeyleri Kimyasal %10 TMA Absorbans (OD450) Konsantrasyon (pg/ml) 2,415 2694,216 4 4558,176 3,061 3453,912 3,229 3651,48 3,099 3498,6 Ortalama (Konsantrasyon) Standart hata 3571,277 664,9614 60 Çizelge 4.19. TMA’ya kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-5 düzeyleri Kimyasal %10 Diasetil Absorbans (OD450) 0,401 0,333 0,333 0,326 0,191 Konsantrasyon (pg/ml) 325,752 245,784 245,784 237,552 78,792 Ortalama (Konsantrasyon) Standart hata 226,7328 90,18624 Çizelge 4.20. Çözücüye kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-5 düzeyleri Çözücü AOO (4:1) Absorbans (OD450) Konsantrasyon (pg/ml) 0,179 14,21 0,154 6,96 0,142 3,48 0,149 5,51 0,149 5,51 0,146 4,64 0,162 9,28 0,173 12,47 0,212 23,78 0,388 74,82 Ortalama (Konsantrasyon) Standart hata 16,066 21,52183 Kimyasalların indüklediği IL-5 miktarları (pg/ml) Şekil 4.5.’teki gibi gösterilmiştir. IL-5 düzeyi (pg/ml) 5000 ** 4000 3000 2000 1000 0 DNCB Diasetil TMA AOO Şekil 4.5. Kısa süreli maruziyet sonrası kimyasallar tarafından indüklenen IL-5 miktarı ** 0,001≤p<0,01; çözücü kontrol grubuna (AOO) göre istatiksel olarak yüksek anlamlı farklılık (Mann Whitney test). Sadece TMA çözücü kontrolüne göre kısa süreli maruziyet sonucu IL-5 düzeyinde anlamlı artışa neden olmuştur (p<0,01). 61 4.2.5. IL-10 ölçümü %1’lik DNCB, %10’luk diasetil, %10’luk TMA ve çözücünün (AOO, 4:1) 3 günlük maruziyeti sonrası farelerin kulak arkası lenf düğümlerinden elde edilen lenfositler fitohemaglutininli kültür ortamında ekildikten sonra 72. saatte salınan IFN-γ sitokin düzeyleri, ELISA ile örneklerin optik dansitelerinin ölçümünden hareketle elde edilen standart doğru denkleminden hesaplandı. IL-10 miktarı ölçümünde kullanılan standart doğru denklemi: y = 0,0019x + 0,24 Çizelge 4.21. DNCB’ye kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-10 düzeyleri Kimyasal %1 DNCB Absorbans (OD450) 0,583 1,061 0,432 0,863 1,178 Konsantrasyon (pg/ml) 360,836 863,692 201,984 655,396 986,776 Ortalama (Konsantrasyon) Standart hata 613,7368 330,4809 Çizelge 4.22. TMA’ya kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-10 düzeyleri Kimyasal %10 TMA Absorbans (OD450) 2,59 3,642 2,524 2,762 2,192 Konsantrasyon (pg/ml) 2472,2 3578,904 2402,768 2653,144 2053,504 Ortalama (Konsantrasyon) Standart hata 2632,104 572,2358 Çizelge 4.23. Diasetile kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-10 düzeyleri Kimyasal %10 Diasetil Absorbans (OD450) 0,75 0,321 0,424 0,575 0,363 Konsantrasyon (pg/ml) 536,52 85,212 193,568 352,42 129,396 Ortalama (Konsantrasyon) Standart hata 259,4232 185,0841 62 Çizelge 4.24. Çözücüye kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-10 düzeyleri Çözücü Absorbans (OD450) Konsantrasyon (pg/ml) AOO (4:1) 0,245 5,26 0,382 0,367 0,407 0,48 0,36 0,311 0,292 0,256 0,473 149,384 133,604 175,684 252,48 126,24 74,692 54,704 26,3 245,116 Ortalama (Konsantrasyon) Standart hata 124,3464 85,28744 Kimyasalların indüklediği IL-10 miktarları (pg/ml) Şekil 4.6.’daki gibi gösterilmiştir. IL-10 düzeyi (pg/ml) 4000 ** 3000 2000 1000 ** 0 DNCB Diasetil TMA AOO Şekil 4.6. Kısa süreli maruziyet sonrası kimyasallar tarafından indüklenen IL-10 miktarı ** 0,001≤p<0,01; çözücü kontrol grubuna (AOO) göre istatiksel olarak yüksek anlamlı farklılık (Mann Whitney test). IL-10 düzeyi, DNCB ve TMA stimülasyonu sonucu çözücü kontrol grubuna göre artış göstermiştir (p<0,01). 4.2.6. IL-13 ölçümü %1’lik DNCB, %10’luk diasetil, %10’luk TMA ve çözücünün (AOO, 4:1) 3 günlük maruziyeti sonrası farelerin kulak arkası lenf düğümlerinden elde edilen lenfositler fitohemaglutininli kültür ortamında ekildikten sonra 72. saatte salınan IFN-γ sitokin 63 düzeyleri, ELISA ile örneklerin optik dansitelerinin ölçümünden hareketle elde edilen standart doğru denkleminden hesaplandı. IL-13 miktarı ölçümünde kullanılan standart doğru denklemi: y = 0,0035x + 0,179 Çizelge 4.25. DNCB’ye kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-13 düzeyleri Kimyasal %1 DNCB Absorbans (OD450) Konsantrasyon (pg/ml) 1,934 1003,86 2,774 1484,34 0,444 151,58 2,895 1553,552 2,361 1248,104 Ortalama (Konsantrasyon) Standart hata 1088,287 566,4404 Çizelge 4.26. TMA’ya kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-13 düzeyleri Kimyasal %10 TMA Absorbans (OD450) Konsantrasyon (pg/ml) 2,612 1391,676 2,515 1336,192 2,482 1317,316 2,71 1447,732 2,587 1377,376 Ortalama (Konsantrasyon) Standart hata 1374,058 50,99694 Çizelge 4.27. Diasetile kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-13 düzeyleri Kimyasal %10 Diasetil Absorbans (OD450) Konsantrasyon (pg/ml) 1,864 963,82 0,998 468,468 1,159 560,56 1,484 746,46 0,338 90,948 Ortalama (Konsantrasyon) Standart hata 566,0512 326,3599 64 Çizelge 4.28. Çözücüye kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-13 düzeyleri Çözücü AOO (4:1) Absorbans (OD450) Konsantrasyon (pg/ml) 0,339 91,52 0,233 30,888 0,353 99,528 0,293 65,208 0,303 70,928 0,288 62,348 0,261 46,904 0,317 78,936 0,558 216,788 1,075 Ortalama (Konsantrasyon) Standart hata 84,78311 53,78228 * * İstatistiksel hesaplamaya dahil edilmemiştir. Kimyasalların indüklediği IL-13 miktarları (pg/ml) Şekil 4.7’deki gibi gösterilmiştir. IL-13 düzeyi (pg/ml) 2000 1500 1000 ** ** ** 500 0 DNCB Diasetil TMA AOO Şekil 4.7. Kısa süreli maruziyet sonrası kimyasallar tarafından indüklenen IL-13 miktarı ** 0,001≤p<0,01; çözücü kontrol grubuna (AOO) göre istatiksel olarak yüksek anlamlı farklılık (Mann Whitney test). Her üç kimyasal da kısa süreli maruziyet sonrası çözücü kontrol grubuna göre IL-13 düzeyinin anlamlı derecede artışına neden olmuştur (p<0,01). 4.3. DNCB, TMA ve Diasetil Uygulanan Farelerin Kısa Süreli Maruziyet Sonrası Total Serum IgE Konsantrasyonunun Ölçümü %1’lik DNCB, %10’luk diasetil, %10’luk TMA ve çözücünün (AOO, 4:1) 3 günlük maruziyeti sonrası farelerin serumlarındaki total IgE miktarı, ELISA ile örneklerin optik dansitelerinin ölçümünden hareketle elde edilen standart doğru denkleminden hesaplandı. 65 IgE miktarı ölçümünde kullanılan standart doğru denklemi: y = 0,0008x + 0,049 Çizelge 4.29. DNCB’ye kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IgE düzeyleri Kimyasal %1 DNCB Absorbans (OD450) Konsantrasyon (ng/ml) 0,055 37,5 0,053 25 0,055 37,5 0,062 81,5 0,057 50 Ortalama (Konsantrasyon) Standart hata 46,25 21,46946 Çizelge 4.30. TMA’ya kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IgE düzeyleri Kimyasal %10 TMA Absorbans (OD450) Konsantrasyon (ng/ml) 0,058 56,25 0,061 75 0,061 75 0,071 137,5 0,058 56,25 Ortalama (Konsantrasyon) Standart hata 80 33,48274 Çizelge 4.31. Diasetile kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IgE düzeyleri Kimyasal %10 Diasetil Absorbans (OD450) Konsantrasyon (ng/ml) 0,108 368,75 0,068 118,75 0,088 243,75 0,065 100 0,059 62,5 Ortalama (Konsantrasyon) Standart hata 178,75 126,1355 66 Çizelge 4.32. Çözücüye kısa süreli maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IgE düzeyleri Çözücü Absorbans (OD450) Konsantrasyon (ng/ml) 0,057 50 0,057 50 0,182 Standart hata 57,14286 21,17283 * 0,085* AOO (4:1) Ortalama (Konsantrasyon) 0,054 31,25 0,059 62,5 0,055 37,5 0,062 81,25 0,072* 0,063 87,5 * İstatistiksel hesaplamaya dahil edilmemiştir. Total serum IgE konsantrasyonu (ng/ml) Kimyasalların indüklediği IgE miktarları (ng/ml) Şekil 4.8.’deki gibi gösterilmiştir. 400 300 * 200 100 0 DNCB Diasetil TMA AOO Şekil 4.8. Kısa süreli maruziyet sonrası kimyasallar tarafından indüklenen IgE miktarı * 0,01≤p<0,05; çözücü kontrol grubuna (AOO) göre istatistiksel anlamlı farklılık (Mann-Whitney test). DNCB ve TMA IgE düzeyinde istatistiksel açıdan çözücü kontrol grubuna göre anlamlı bir fark oluşturmazken, sadece diasetil total serum IgE düzeyinde çözücüye kıyasla anlamlı bir artışa neden olmuştur (p<0,05). 67 4.4. Radyoaktif Olmayan ex vivo LLNA Yöntemi ile Kimyasalların Kronik Maruziyet Sonrası Alerji Potansiyellerinin Ölçülmesi ile İlgili Deney Sonuçları Solunum sensitizan potansiyelleri göz önüne alındığında negatif kontrol olan 2,4dinitroklorobenzenin (DNCB) %1’lik konsantrasyondaki çözeltisinin kronik maruziyet sonucu ex vivo yöntemle tespit edilen OD450 sonuçları Çizelge 4.33.’te verilmiştir. Çizelge 4.33. DNCB’ye kronik maruziyet sonucu ex vivo yöntemle tespit edilen OD450 sonuçları Kimyasal OD450-1 0D450-2 (OD450-1+OD450-2) / 2 0,376 0,077* 0,376 0,148 0,109 0,1285 0,104 0,1 0,102 0,095 0,086 0,0905 0,165 0,079 0,165 %1 DNCB (Çözücü: AOO) Ortalama Standart hata 0,1724 0,11736561 * İstatistiksel hesaplamaya dahil edilmemiştir. Solunum sensitizanı olduğu bilinen ve çalışmamızda pozitif kontrol olarak kullandığımız trimellitik anhidritin (TMA) %10’luk konsantrasyondaki çözeltisinin kronik maruziyet sonucu ex vivo yöntemle tespit edilen OD450 sonuçları Çizelge 4.34.’te gösterilmiştir. Çizelge 4.34. TMA’ya kronik maruziyet sonucu ex vivo yöntemle tespit edilen OD450 sonuçları Kimyasal OD450 Ortalama Standart hata 0,0955 %10 TMA (Çözücü: AOO) 0,1 0,098 0,114 0,00731436 0,1025 0,105 * İstatistiksel hesaplamaya dahil edilmemiştir. Test maddemiz diasetilin %10’luk konsantrasyondaki çözeltisinin kronik maruziyet sonucu ex vivo yöntemle tespit edilen OD450 sonuçları Çizelge 4.35.’te gösterilmiştir. 68 Çizelge 4.35. Diasetile kronik maruziyet sonucu ex vivo yöntemle tespit edilen OD450 sonuçları Kimyasal OD450 Ortalama Standart hata 0,119 %10 Diasetil (Çözücü: AOO) 0,246 0,06556803 0,1075 0,148 0,1195 *İstatistiksel hesaplamaya dahil edilmemiştir. Çözücü olarak kullanılan aseton:zeytin yağının (AOO, 4:1) kısa süreli maruziyet sonucu ex vivo yöntemle tespit edilen OD450 sonuçları Çizelge 4.4.’te gösterilmiştir. Çizelge 4.36. Çözücüye kronik maruziyet sonucu ex vivo yöntemle tespit edilen OD450 sonuçları Çözücü OD450 Ortalama Standart hata 0,100333 0,015396969 Belirlenememiştir. Belirlenememiştir. 0,101 AOO (4:1) 0,121 0,076 0,092 Belirlenememiştir. 0,11 0,102 Belirlenememiştir. * İstatistiksel hesaplamaya dahil edilmemiştir. Solunum sensitizan potansiyelleri göz önüne alındığında negatif kontrol olan %1’lik konsantrasyonda DNCB, pozitif kontrol olan %10’luk konsantrasyonda TMA, test maddesi olan %10’luk Diasetil ve çözücü kontrolü olan aseton:zeytin yağının (AOO, 4:1) 13 günlük maruziyet sonrası BrdU ELISA kiti ile lenfosit proliferasyonu ölçümü sonrası elde edilen her bir gruba ait ortalama OD450 değerleri Şekil 4.9.’da sütun grafiği üzerinde gösterilmiştir. 69 0,35 0,3 OD 450 0,25 0,2 0,15 0,1 0,05 0 DNCB Diasetil TMA AOO Şekil 4.9. Kronik maruziyet sonucu lenfosit proliferasyonu ölçümü (OD450) 4.4.1. DNCB için stimülasyon indeksinin (SI) hesaplanması DNCB’nin ortalama optik dansite değeri SI = = 3.41 = 1,29 = 1,47 Çözücünün (AOO) ortalama optik dansite değeri 4.4.2. TMA için stimülasyon indeksinin (SI) hesaplanması TMA’nın ortalama optik dansite değeri SI = Çözücünün (AOO) ortalama optik dansite değeri 4.4.3. Diasetil için stimülasyon indeksinin (SI) hesaplanması Diasetilin ortalama optik dansite değeri SI = Çözücünün (AOO) ortalama optik dansite değeri Çalışmamızda her üç kimyasal da kronik maruziyet sonrası çözücü kontrolüne kıyasla immün yanıtın göstergesi olan lenfosit proliferasyonunu indüklemiştir. DNCB’nin stimülasyon indeksi değerinin 1,6’dan büyük çıkması ile bu kimyasalın temas sensitizanı potansiyeli ortaya konmuştur. Diasetil ve TMA’nın etki gücü daha önceki çalışmalarda olduğu gibi yüksek çıkmamıştır ve anlamlı bir stimülasyon indeksi değeri elde edilememiştir (SI<1,6). 70 4.5. DNCB, TMA ve Diasetil Uygulanan Farelerin Kronik Maruziyet Sonrası Kulak Arkası Lenf Düğümlerinden Elde Edilen Lenfosit Hücre Kültürlerinde Sitokin Düzeylerinin Ölçümü 4.5.1. IFN-γ ölçümü %1’lik DNCB, %10’luk diasetil, %10’luk TMA ve çözücünün (AOO, 4:1) 13 günlük maruziyeti sonrası farelerin kulak arkası lenf düğümlerinden elde edilen lenfositler fitohemaglutininli kültür ortamında ekildikten sonra 72. saatte salınan IFN-γ sitokin düzeyleri, ELISA ile örneklerin optik dansitelerinin ölçümünden hareketle elde edilen standart doğru denkleminden hesaplandı. IFN-γ miktarı ölçümünde kullanılan standart doğru denklemi: y = 0,0012x + 0,1122 Çizelge 4.37. DNCB’ye kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IFN-γ düzeyleri Kimyasal %1 DNCB Absorbans (OD450) 0,197 Konsantrasyon (pg/ml) 141,332768 0,16 79,666348 0,156 72,999708 0,158 76,333028 Ortalama (Konsantrasyon) Standart hata 92,582963 32,61363056 Belirlenememiştir Çizelge 4.38. TMA’ya kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IFN-γ düzeyleri Kimyasal %10 TMA Absorbans (OD450) Konsantrasyon Ortalama (pg/ml) (Konsantrasyon) 0,132 32,999868 0,204 152,999388 0,159 79,666348 0,147 49,666468 0,137 117,999528 86,66632 Standart hata 49,19329873 71 Çizelge 4.39. Diasetile kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IFN-γ düzeyleri Kimyasal %10 Diasetil Absorbans (OD450) 0,167 0,214 0,159 0,147 0,137 Konsantrasyon (pg/ml) 91,332968 169,665988 77,999688 57,999768 41,333168 Ortalama (Konsantrasyon) Standart hata 87,666316 49,6429726 Çizelge 4.40. Çözücüye kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IFN-γ düzeyleri Çözücü AOO (4:1) Absorbans Konsantrasyon (OD450) (pg/ml) 0,16 79,666348 0,114 2,999988 * 0,234 0,148 59,666428 0,17 96,332948 * 0,223 0,163 84,666328 0,148 59,666428 0,154 69,666388 Belirlenememiştir Ortalama (Konsantrasyon) Standart hata 64,666408 30,29166968 *İstatistiksel hesaplamaya dahil edilmemiştir. Kimyasalların indüklediği IFN-γ miktarları (pg/ml) Şekil 4.10.’daki gibi gösterilmiştir. IFN-γ düzeyi (pg/ml) 160 140 120 100 80 60 40 20 0 DNCB Diasetil TMA AOO Şekil 4.10. Kronik maruziyet sonrası kimyasallar tarafından indüklenen IFN-γ miktarı Her üç kimyasal da istatistiksel olarak anlamlı IFN-γ artışına neden olmamıştır. 72 4.5.2. IL-2 ölçümü %1’lik DNCB, %10’luk diasetil, %10’luk TMA ve çözücünün (AOO, 4:1) 13 günlük maruziyeti sonrası farelerin kulak arkası lenf düğümlerinden elde edilen lenfositler fitohemaglutininli kültür ortamında ekildikten sonra 72. saatte salınan IFN-γ sitokin düzeyleri, ELISA ile örneklerin optik dansitelerinin ölçümünden hareketle elde edilen standart doğru denkleminden hesaplandı. IL-2 miktarı ölçümünde kullanılan standart doğru denklemi: y = 0,0004x + 0,08 Çizelge 4.41. DNCB’ye kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-2 düzeyleri Kimyasal %1 DNCB Absorbans (OD450) Konsantrasyon (pg/ml) 0,26 900 0,152 360 0,109 145 0,151 355 Ortalama (Konsantrasyon) Standart hata 440 322,6194869 Belirlenememiştir Çizelge 4.42. TMA’ya kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-2 düzeyleri Kimyasal %10 TMA Absorbans (OD450) Konsantrasyon Ortalama (pg/ml) (Konsantrasyon) 0,172 460 0,234 770 0,186 530 0,106 130 0,19 550 488 Standart hata 231,3438999 73 Çizelge 4.43. Diasetile kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-2 düzeyleri Kimyasal %10 Diasetil Absorbans (OD450) 0,113 0,113 0,097 0,138 0,107 Konsantrasyon (pg/ml) 165 165 85 290 135 Ortalama (Konsantrasyon) Standart hata 168 75,6306816 Çizelge 4.44. Çözücüye kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-2 düzeyleri Çözücü AOO (4:1) Absorbans (OD450) 0,101 Konsantrasyon (pg/ml) 105 0,175 475 0,124 220 0,099 95 0,107 135 0,108 140 0,1 100 0,101 105 0,099 95 Belirlenememiştir Ortalama (Konsantrasyon) Standart hata 163,33 123,4149505 Kimyasalların indüklediği IL-2 miktarları (pg/ml) Şekil 4.11.’deki gibi gösterilmiştir. IL-2 düzeyi (pg/ml) 900 800 * * 700 600 500 400 300 200 100 0 DNCB Diasetil TMA AOO Şekil 4.11. Kronik maruziyet sonrası kimyasallar tarafından indüklenen IL-2 miktarı * 0,01≤p<0,05; çözücü kontrol grubuna (AOO) göre istatistiksel anlamlı farklılık (Mann-Whitney test). 74 IL-2 miktarı kronik maruziyet sonrası DNCB ve TMA için çözücü kontrolüne göre artış gösterirken, diasetilin indüklediği IL-2 miktarı AOO gurubuna göre istatistiksel anlamlılıkta değildir. 4.5.3. IL-4 ölçümü %1’lik DNCB, %10’luk diasetil, %10’luk TMA ve çözücünün (AOO, 4:1) 13 günlük maruziyeti sonrası farelerin kulak arkası lenf düğümlerinden elde edilen lenfositler fitohemaglutininli kültür ortamında ekildikten sonra 72. saatte salınan IFN-γ sitokin düzeyleri, ELISA ile örneklerin optik dansitelerinin ölçümünden hareketle elde edilen standart doğru denkleminden hesaplandı. IL-4 miktarı ölçümünde kullanılan standart doğru denklemi: y = 0,0069x + 0,13 Çizelge 4.45. DNCB’ye kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-4 düzeyleri Kimyasal %1 DNCB Absorbans (OD450) Konsantrasyon (pg/ml) 0,307 51,33 0,178 13,92 0,18 14,5 0,178 13,92 Ortalama (Konsantrasyon) Standart hata 23,4175 18,61034 Belirlenememiştir Çizelge 4.46. TMA’ya kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-4 düzeyleri Kimyasal %10 TMA Absorbans (OD450) Konsantrasyon (pg/ml) 1,049 266,51 3,336 929,74 1,654 441,96 0,254 35,96 2,411 661İ49 Ortalama (Konsantrasyon) Standart hata 467,132 345,895 75 Çizelge 4.47. Diasetile kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-4 düzeyleri Kimyasal %10 Diasetil Absorbans (OD450) Konsantrasyon (pg/ml) 0,13 0 0,151 6,09 0,137 2,03 0,128 -0,58 0,15 5,8 Ortalama (Konsantrasyon) Standart hata 2,668 3,146199 Çizelge 4.48. Çözücüye kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-4 düzeyleri Çözücü Absorbans (OD450) Konsantrasyon (pg/ml) AOO (4:1) 0,148 5,22 0,15 5,8 0,176 13,34 0,142 3,48 0,16 8,7 0,17 11,6 0,141 3,19 0,146 4,64 0,176 13,34 Ortalama (Konsantrasyon) Standart hata 7,701111 4,139772 Belirlenememiştir Kimyasalların indüklediği IL-4 miktarları (pg/ml) Şekil 4.12.’deki gibi gösterilmiştir. IL-4 düzeyi (pg/ml) 1000 ** 800 600 400 200 ** 0 DNCB Diasetil TMA AOO Şekil 4.12. Kronik maruziyet sonrası kimyasallar tarafından indüklenen IL-4 miktarı ** 0,001≤p<0,01; çözücü kontrol grubuna (AOO) göre istatiksel olarak yüksek anlamlı farklılık (Mann Whitney test). 76 Daha önceki çalışmalardan beklendiği üzere TMA yüksek istatistiksel anlamlılıkta IL-4 düzeyini çözücü kontrol grubuna göre artırmıştır. Aynı zamanda DNCB tarafından indüklenen IL-4 seviyesi de çözücü kontrolüne göre artış göstermiştir. Ancak IL-4 seviyesi diasetil için anlamlı bulunmamıştır. 4.5.4. IL-5 ölçümü %1’lik DNCB, %10’luk diasetil, %10’luk TMA ve çözücünün (AOO, 4:1) 13 günlük maruziyeti sonrası farelerin kulak arkası lenf düğümlerinden elde edilen lenfositler fitohemaglutininli kültür ortamında ekildikten sonra 72. saatte salınan IFN-γ sitokin düzeyleri, ELISA ile örneklerin optik dansitelerinin ölçümünden hareketle elde edilen standart doğru denkleminden hesaplandı. IL-5 miktarı ölçümünde kullanılan standart doğru denklemi: y = 0,0017x + 0,124 Çizelge 4.49. DNCB’ye kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-5 düzeyleri Kimyasal %1 DNCB Absorbans (OD450) Konsantrasyon (pg/ml) 0,138 16,464 0,277 179,928 0,129 5,88 0,15 30,576 Ortalama (Konsantrasyon) Standart hata 58,212 81,77218 Belirlenememiştir Çizelge 4.50. TMA’ya kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-5 düzeyleri Kimyasal %10 TMA Absorbans (OD450) Konsantrasyon (pg/ml) 0,249 147 0,183 69,384 0,207 97,608 0,193 81,144 0,168 51,744 Ortalama (Konsantrasyon) Standart hata 89,376 36,30394 77 Çizelge 4.51. Diasetile kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-5 düzeyleri Kimyasal Absorbans (OD450) 0,15 0,269 0,175 0,162 0,185 %10 Diasetil Konsantrasyon (pg/ml) 30,576 170,52 59,976 44,688 71,736 Ortalama (Konsantrasyon) Standart hata 75,4992 55,34326 Çizelge 4.52. Çözücüye kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-5 düzeyleri Çözücü AOO (4:1) Absorbans (OD450) Konsantrasyon (pg/ml) 0,124 0 0,157 38,808 0,16 42,336 0,131 8,232 0,144 23,52 0,197 85,848 0,226 119,952 0,156 37,632 0,204 94,08 Belirlenememiştir Ortalama (Konsantrasyon) Standart hata 50,04533 40,93304 Kimyasalların indüklediği IL-5 miktarları (pg/ml) Şekil 4.13.’teki gibi gösterilmiştir. IL-5 düzeyi (pg/ml) 150 100 50 0 DNCB Diasetil TMA AOO Şekil 4.13. Kronik maruziyet sonrası kimyasallar tarafından indüklenen IL-5 miktarı Her üç kimyasal da kronik maruziyet sonrası IL-5 seviyesinde anlamlı bir artışı indüklememiştir. 78 4.5.5. IL-10 ölçümü %1’lik DNCB, %10’luk diasetil, %10’luk TMA ve çözücünün (AOO, 4:1) 13 günlük maruziyeti sonrası farelerin kulak arkası lenf düğümlerinden elde edilen lenfositler fitohemaglutininli kültür ortamında ekildikten sonra 72. saatte salınan IFN-γ sitokin düzeyleri, ELISA ile örneklerin optik dansitelerinin ölçümünden hareketle elde edilen standart doğru denkleminden hesaplandı. IL-10 miktarı ölçümünde kullanılan standart doğru denklemi: y = 0,0019x + 0,24 Çizelge 4.53. DNCB’ye kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-10 düzeyleri Kimyasal %1 DNCB Absorbans (OD450) Konsantrasyon (pg/ml) 0,4 168,32 0,399 167,268 0,377 144,124 0,418 187,256 Ortalama (Konsantrasyon) Standart hata 166,742 17,65564 Belirlenememiştir Çizelge 4.54. TMA’ya kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-10 düzeyleri Kimyasal %10 TMA Absorbans (OD450) Konsantrasyon (pg/ml) 0,464 235,648 0,66 441,84 0,45 19,988 0,36 48,392 0,404 128,344 Ortalama (Konsantrasyon) Standart hata 239,4352 121,0522 79 Çizelge 4.55. Diasetile kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-10 düzeyleri Kimyasal %10 Diasetil Absorbans (OD450) 0,374 0,664 0,259 0,286 0,362 Konsantrasyon (pg/ml) 140,968 440,048 19,988 48,392 128,344 Ortalama (Konsantrasyon) Standart hata 156,748 169,7017 Çizelge 4.56. Çözücüye kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-10 düzeyleri Çözücü AOO (4:1) Absorbans (OD450) Konsantrasyon (pg/ml) 0,341 106,252 0,347 112,564 0,449 219,868 0,464 235,648 0,414 183,048 0,634 414,488 0,406 174,632 0,333 97,836 0,29 52,6 Belirlenememiştir Ortalama (Konsantrasyon) Standart hata 177,4373 107,5975 Kimyasalların indüklediği IL-10 miktarları (pg/ml) Şekil 4.14.’teki gibi gösterilmiştir. IL-10 düzeyi (pg/ml) 400 350 300 250 200 150 100 50 0 DNCB Diasetil TMA AOO Şekil 4.14. Kronik maruziyet sonrası kimyasallar tarafından indüklenen IL-10 miktarı Her üç kimyasal da kronik maruziyet ile IL-10 düzeyinde anlamlı bir artış oluşturmamıştır. 80 4.5.6. IL-13 ölçümü %1’lik DNCB, %10’luk diasetil, %10’luk TMA ve çözücünün (AOO, 4:1) 13 günlük maruziyeti sonrası farelerin kulak arkası lenf düğümlerinden elde edilen lenfositler fitohemaglutininli kültür ortamında ekildikten sonra 72. saatte salınan IFN-γ sitokin düzeyleri, ELISA ile örneklerin optik dansitelerinin ölçümünden hareketle elde edilen standart doğru denkleminden hesaplandı. IL-13 miktarı ölçümünde kullanılan standart doğru denklemi: y = 0,0035x + 0,179 Çizelge 4.57. DNCB’ye kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-13 düzeyleri Kimyasal %1 DNCB Absorbans (OD450) Konsantrasyon (pg/ml) 0,233 30,888 0,262 47,476 0,226 26,884 0,239 34,32 Ortalama (Konsantrasyon) Standart hata 34,892 8,922711 Belirlenememiştir Çizelge 4.58. TMA’ya kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-13 düzeyleri Kimyasal %10 TMA Absorbans (OD450) Konsantrasyon (pg/ml) 0,519 194,48 1,3 641,212 0,8 355,212 0,246 38,324 0,821 367,224 Ortalama (Konsantrasyon) Standart hata 319,2904 224,5781 81 Çizelge 4.59. Diasetile kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-13 düzeyleri Kimyasal Absorbans (OD450) 0,221 0,215 0,179 0,229 0,222 %10 Diasetil Konsantrasyon (pg/ml) 24,024 20,592 0 28,6 24,596 Ortalama (Konsantrasyon) Standart hata 19,5624 11,29899 Çizelge 4.60. Çözücüye kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IL-13 düzeyleri Çözücü AOO (4:1) Absorbans (OD450) Konsantrasyon (pg/ml) 0,231 29,744 0,241 35,464 0,247 38,896 0,285 60,632 0,277 56,056 0,266 49,764 0,274 54,34 0,245 37,752 0,218 22,308 Belirlenememiştir Ortalama (Konsantrasyon) Standart hata 42,77289 13,03977 Kimyasalların indüklediği IL-13 miktarları (pg/ml) Şekil 4.15.’teki gibi gösterilmiştir. IL-13 düzeyi (pg/ml) 600 * 500 400 300 200 100 0 DNCB Diasetil TMA AOO Şekil 4.15. Kronik maruziyet sonrası kimyasallar tarafından indüklenen IL-13 miktarı * 0,01≤p<0,05; çözücü kontrol grubuna (AOO) göre istatistiksel anlamlı farklılık (Mann-Whitney test). Kronik maruziyet sonrası IL-13 düzeyi TMA için çözücüye kıyasla anlamlı bir artış göstermiştir. 82 4.6. DNCB, TMA ve Diasetil Uygulanan Farelerin Kronik Maruziyet Sonrası Total Serum IgE Konsantrasyonunun Ölçümü %1’lik DNCB, %10’luk diasetil, %10’luk TMA ve çözücünün (AOO, 4:1) 13 günlük maruziyeti sonrası farelerin serumlarındaki total IgE miktarı, ELISA ile örneklerin optik dansitelerinin ölçümünden hareketle elde edilen standart doğru denkleminden hesaplandı. IgE miktarı ölçümünde kullanılan standart doğru denklemi: y = 0,0008x + 0,049 Çizelge 4.61. DNCB’ye kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IgE düzeyleri Kimyasal %1 DNCB Absorbans (OD450) 0,055 0,05 0,056 0,06 0,126 Konsantrasyon (ng/ml) 37,5 6,25 43,75 68,75 481,25 Ortalama (Konsantrasyon) Standart hata 127,5 199,0014 Çizelge 4.62. TMA’ya kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IgE düzeyleri Kimyasal %10 TMA Absorbans (OD450) 0,061 0,054 0,05 0,167 0,054 Konsantrasyon (ng/ml) 75 31,25 6,25 737,5 31,25 Ortalama (Konsantrasyon) Standart hata 176,25 314,7233 Çizelge 4.63. Diasetile kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IgE düzeyleri Kimyasal %10 Diasetil Absorbans (OD450) 0,081 0,058 0,049 0,065 0,086 Konsantrasyon (ng/ml) 200 56,25 0 100 231,25 Ortalama (Konsantrasyon) Standart hata 117,5 96,96568 83 Çizelge 4.64. Çözücüye kronik maruziyet sonrası kulak arkası lenf düğümlerinden elde edilen hücre kültürlerinde 72. saat sonunda IgE düzeyleri Çözücü Absorbans (OD450) Konsantrasyon (ng/ml) 0,057 0,074 AOO (4:1) Ortalama (Konsantrasyon) Standart hata 35,41667 16,23798 50 * 0,05 6,25 0,053 25 0,056 43,75 0,052 18,75 0,054 31,25 0,056 43,75 0,056 43,75 0,058 56,25 *İstatistiksel hesaplamaya dahil edilmemiştir. Kimyasalların indüklediği IgE miktarları (ng/ml) Şekil 4.16.’daki gibi gösterilmiştir. Total serum IgE konsantrasyonu (ng/ml) 600 500 400 300 200 ** 100 0 DNCB Diasetil TMA AOO Şekil 4.16. Kronik maruziyet sonrası kimyasallar tarafından indüklenen IgE miktarı ** 0,001≤p<0,01; çözücü kontrol grubuna (AOO) göre istatiksel olarak yüksek anlamlı farklılık (Mann Whitney test). Sadece diasetilin karonik maruziyet ile indüklediği IgE düzeyi çözücü kontrol grubuna göre istatistiksel olarak yüksek anlamlılığa sahiptir. 84 85 5. TARTIŞMA Kimyasallar tarafından indüklenen alerjik sensitizasyon ve alerjik hastalıklar toksikolojinin en çetrefilli ve önemli araştırma alanlarından birisidir. Alerjik temas dermatiti ile sonuçlanan deri sensitizasyonu insanlarda immünotoksisitenin en yaygın görülen şeklidir ve yüzlerce kimyasal deri sensitizanı olarak belirlenmiştir. Ancak daha az sayıda kimyasalın solunum bölgesinin sensitizasyonu ve astıma yol açtığı gösterilmiştir. Buna karşın konunun ciddiyeti daha az değildir. Solunum sensitizanlarının tehlikelerinin belirlenmesi ve risk değerlendirmesi oldukça güç olup, özellikle iş yerlerinde solunum alerjenlerine yüksek miktarda maruziyetin yol açtığı mesleki astım gibi aşırı duyarlılık hastalıkları ölümcül olabilmektedir. Sensitizasyon günümüzde en sık raporlanan mesleki hastalıklardan biri olup, işçiler için büyük bir sağlık riski oluşturmaktadır. Kimyasalların sahip oldukları tehlikenin ve taşıdığı riskin ortaya konması, öncelikle biyolojik, kimyasal ve toksikolojik mekanizmalarının aydınlatılması ve gerekli test yöntemlerinin geliştirilip geçerliliğinin kanıtlanması ile mümkün olabilir. Bu nedenle son yıllarda kimyasal sensitizanlarının tehlikelerinin belirlenmesi için hızlı ve hassas yöntemlerin geliştirilmesine ağırlık verilmiştir. Böylece kimyasal sensitizanların işyeri seviyeleri ve çevreye salımlarının kontrol edilmesi ile birlikte advers yanıtların insidansında ve sonuçta oluşan ekonomik kayıplarda azalma görülecektir. Temas sensitizanlarının tehlikelerinin belirlenmesine yönelik valide edilmiş yöntemler bulunmaktadır; ancak solunum sensitizanları için son yirmi yıldır yürütülen yoğun araştırmalara rağmen valide edilmiş bir yöntem mevcut değildir. Temas sensitizasyonu ilk olarak kobaylarda araştırılmıştır. En çok tercih edilen yöntemler arasında Kobay Maksimizasyon Testi ve Buehler Testi olmakla birlikte birçok kobay test yöntemi mevcuttur. Kobay modelleri kayda değer güvenilirliğe sahip olsa da, yüksek oranda yanlış pozitif veya yanlış negatif sonuç verir. İnsan yama testlerinin hala bazı ülkelerde deri alerjenleri için doğrulayıcı test olarak kullanılmasına karşın, etik kaygılar ve daha güvenilir alternatif test prosedürlerinin varlığı insan yama testinin geçerliliğini büyük ölçüde azaltmıştır. 86 1989’da geliştirilen Standart Lokal Lenf Düğümü Testi (LLNA), düşük molekül ağırlığına sahip kimyasalların temas sensitizan potansiyellerinin değerlendirmesine yönelik olarak, kobay testlerinin yerini almıştır. Kobay testleri ile karşılaştırıldığında, daha az deney hayvanı ile çalışılması, adjuvana ihtiyaç olmaksızın test maddesinin uygulanması, kısa süreli test protokolüne sahip olması, doz-yanıt ilişkisi sunması ve 3R ilkesi ile uyumlu şekilde deney hayvanına verilen acı ve stresin büyük oranda azaltılmış olması gibi birçok yönden LLNA daha fazla avantaja sahiptir. Ayrıca bu yöntem verilerin subjektif yorumlamadan ziyade enstrümantal ölçümüne dayalı daha iyi standardize edilmiş prosedürün avantajına sahiptir. Sensitizasyon değerlendirmesi için günümüzde ilk tercih edilen yöntem LLNA’dir. 1999 yılında ICCVAM ve ECVAM tarafından valide edildikten sonra, 2002 yılında OECD test kılavuzuna girmiştir. Son zamanlarda bu metod Avrupa Birliği REACH regülasyonu ile ilk ihtiyaç duyulan sensitizasyon testi olarak kabul edilmiştir. Standart LLNA’da radyoaktif maddenin kullanılması testin uygulanabilirliğini kısıtladığından, radyoaktif madde kullanımı gerektirmeyen alternatifleri geliştirilip valide edilmiştir ve OECD test rehberine girmiştir. OECD TG 442B’de yer alan bu radyoaktif olmayan LLNA’da, lokal olarak çoğalan lenfositlerin DNA’sına katılan BrdU miktarı ELISA ile belirlenerek lenfosit proliferasyonu ölçülür. Kimyasal sensitizanlar tarafından indüklenen lenfosit proliferasyonu immün yanıtın bir göstergesidir. Lenfosit proliferasyonunda çözücü kontrole kıyasla 1,6 kat artışı indükleyen kimyasallar pozitif temas sensitizanı olarak sınıflandırılır. Üç veya daha fazla konsantrasyon kullanıldığı için doz-yanıt ilişkisine imkan tanır. Hesaplanan EC3 değerleri temas sensitizasyonu oluşturan etkin konsantrasyon olup, EC3’ün insan yama testlerinden elde edilen değerlerle uyumlu olduğu gösterilmiştir. Böylece bu yöntem temas sensitizanlarının risk değerlendirmesinin yapılmasını mümkün kılar. Solunum sensitizanları için ise daha önce bahsedildiği üzere yaygın olarak kabul edilen veya valide edilmiş bir yöntem yoktur. Olası solunum sensitizanlarının prospektif belirlenmesine yönelik hastalığın klinik belirtilerinin taklit edildiği çeşitli maruziyet yollarının kullanıldığı kobay, fare ve rat modellerini içeren yöntem yaklaşımları mevcuttur. Bunlardan biri de LLNA yöntemidir. 87 Çalışmamızda temas sensitizasyon potansiyelinin değerlendirilmesinde uygulama kolaylığından dolayı radyoaktif olmayan LLNA:BrdU yöntemini tercih ettik. Ancak OECD rehberinde yer alan in vivo BrdU yöntemi yerine, hayvan refahını göz önünde bulundurarak, modifikasyon yapılmış versiyonunu kullandık. Bu modifikasyon fareye BrdU enjeksiyonu yapılmaksızın, fareler sakrifiye edildikten sonra izole edilen lenf düğümü hücrelerine BrdU’nun ex vivo ilavesini içerir (Ulker ve diğerleri, 2013, 2014). Böylece deney hayvanına invazif bir işlem yapılmaksızın daha az acı çekmesi sağlanır. Bu modifikasyon ile benzer sonuçların elde edilebileceği ortaya konmuştur. Çalışmamızda Dearman ve arakadaşlarının (2009) prosedürünü temel alarak solunum sensitizanlarının kısa süreli ve kronik olmak üzere dermal maruziyet protokollerini gerçekleştirdik. Dearman ve arkadaşlarının 13 günlük kronik maruziyet protokolünde belirtildiği üzere negatif kontrol DNCB’nin %1’lik, pozitif kontrol TMA’nın %10’luk konsantrasyonlarını uyguladık. Bazı yayınlarda kısa süreli maruziyet protokolünün 8 gün olarak belirlenmiş olmasına karşın (Vandebriel ve diğerleri, 2000), Dearman ve arkadaşlarının uyguladığı gibi 3 günlük maruziyet protokolünü kontrol gruplarının yine aynı konsantrasyonlarında gerçekleştirdik. Test maddesi olarak son yıllarda sensitizasyon ve solunum yoluyla ilgili diğer hastalıklara olan etkisi yoğun olarak araştırılan diasetil maddesini seçtik. Diasetilin farelere uygulanacak konsantrasyon seçimini, Anderson ve arkadaşlarının (2007) çalışmasının sonuçlarına göre yaptık. En iyi sonuçların çalışmış oldukları %6-12 konsantrasyon aralığında elde edilmesinden %10 konsantrasyonla çalışmayı uygun bulduk. LLNA’nın aynı zamanda doz-yanıt ilişkisi sunması, sensitizanların risk değerlendirmesinin yapılmasını mümkün kılmaktadır. Doz-yanıt ilişkisi verileri elde etmek için test ve kontrol maddelerinin en az 3 konsantrasyonu kullanılmak zorundadır. Çalışmamızda doz-yanıt ilişkisi verilerine ihtiyacımız olmadığı için test ve kontrol maddelerinin tek konsantrasyonlarının kullanılmasına karar verdik. Böylece alternatif yöntemlerin ilkelerinden biri olan daha az deney hayvanı kullanımını yerine getirdik. Çalışmamızda öncelikle diasetilin solunum sensitizanı potansiyelini ortaya koymayı amaçladık. Ancak solunum sensitizanı ve temas sensitzanlarının ayrımının yapılmasında LLNA yönteminin yeterli olmadığını daha önceki çalışmalardan ve testin genel prosedürü 88 açısından bilmekteyiz. LLNA sadece lenfosit proliferasyonundaki anlamlı artışa dayanarak immün cevabın test kimyasalı tarafından indüklendiğini göstermektedir. LLNA’da elde edilen pozitif yanıt kimyasalın sadece temas sensitizanı olarak belirlenmesini sağlar. Amacımıza yönelik olarak LLNA’ya ilave yöntemlerin yürütülmesi gerekmektedir. LLNA solunum ve temas sensitizanlarının ayrımının yapılmasına imkan vermediğinden, bu testle birlikte sensitizanların indüklediği farklı sitokin yanıtlarının ortaya konması solunum sensitizanlarının temas sensitizanlarından ayırt edilmesini sağlayacaktır. Bugüne kadar yapılan araştırmalar, sitokin fenotipinin oluşmasının kimyasal alerjenlerin indüklediği immün yanıtın olgunlaşması süresince devam ettiğini ortaya koymaktadır. Hem kimyasal hem de solunum alerjenlerine topikal maruziyet bölgesindeki lenf düğümü hücrelerinin kısa süreli indüksiyonunun benzer sitokin profili gösterdiği, daha uzun süreli maruziyetin ise selektif sitokin üretimine yol açacağı öne sürülmektedir. Temas alerjenleri öncelikle tip 1 sitokinleri, solunum alerjenleri ise tercihen tip 2 sitokinleri ile ilişkilidir. Kimyasal alerjenlere immün yanıt oluşumu sırasında farklı sitokin üretiminin gerçekleştiği bu zamana kadar yapılan çalışmalarda anlaşılmıştır. Temas sensitizanlarına maruziyetten sonra diğer sitokinlere kıyasla Th1 sitokini IFN-γ’nın arttığı gözlenirken, solunum sensitizanlarına maruziyet selektif Th2 sitokinleri IL-4, IL-5, IL-10 ve IL-13 seviyelerinin ve daha düşük miktarda Th1 sitokinlerinin artışına yol açmıştır (Kimber and Dearman, 1997, 1998). Bu hipotezden yola çıkarak kendi hipotezimizi, diasetilin solunum sensitizasyonu potansiyelinin sitokin salım profilleri üzerinden değerlendirilmesi olarak belirledik. Kimyasala dermal maruziyet sonucu indüklenen total serum IgE konsantrasyonundaki artışın solunum sensitizasyon potansiyelinin belirlenmesinde kullanılabileceği savunulmaktadır. Bu nedenle fare IgE testini de çalışmamıza eklemeyi uygun gördük. Ancak standart fare IgE testinden farklı olarak, 3R ilkesi gözetilerek her grup için 6 adet fare yerine 5 adet fare ile çalıştık. Standart protokol sadece kronik maruziyetin indüklediği IgE miktarını incelerken biz hem kronik hem de kısa süreli maruziyet sonrası total serum IgE miktarını ölçtük. Bu hususta elde ettiğimiz sonuçları değerlendirecek olursak, öncelikle solunum sensitizasyonu açısından negatif kontrol olarak kullandığımız DNCB’ye farelerin kısa 89 süreli maruz bırakılması sonucu immün yanıtın göstergesi olan lenfosit proliferasyonunun ölçülmesi ile stimülasyon indeksi (SI) 2,29 olarak bulunmuştur. Bu değer OECD test kılavuzunda yer alan 1,6 değerinden büyük olduğu için DNCB beklediğimiz üzere anlamlı bir cevap oluşturmuştur. Böylece çalışmamızla DNCB’nin daha önceki çalışmalarda gösterilen temas sensitizan potansiyeli desteklenmiş oldu. Özellikle TMA ile yapılan radyoaktif çalışmalarda TMA’nın güçlü sensitizan özellikte yorumlanacak düzeyde lenfosit poliferasyonuna yol açtığı bulunmasına karşın (Boverhof ve diğerleri, 2008), radyoaktif olmayan ex vivo BrdU LLNA çalışmasında böyle bir değer bulunmamıştır (Williams ve diğerleri, 2015). Çalışmamızda ise TMA’nın lenfosit proliferasyonu indüksiyon değerinde, uyguladığımız konsantrasyonlarda çözücü kontrole kıyasla herhangi bir artış bulunmamıştır. Bu durum bizim uyguladığımız yöntemin radyoaktif olmayan LLNA yöntemi olmasından kaynaklanıyor olabilir. Aynı zamanda solunum sensitizasyonu potansiyeli bulunan daha fazla kimyasal madde ile çalışılarak, yöntemin solunum ve temas sensitizanlarını ayrım konusundaki bu pozitif durumunun netleştirilmesi ile radyoaktif LLNA yönteminin eleştirilen bu eksikliğinin giderilmesi büyük önem taşıyabilir. Test maddemiz diasetile kısa süreli maruziyet sonrası SI değeri 1,43 olarak hesaplanmıştır. Diasetilin SI değeri OECD protokolünde yer alan 1,6 değerinden küçük olduğu için bu konsantrasyonda temas sensitizasyonuna yol açtığı söylenemez. Anderson ve arkadaşlarının (2007) yaptığı çalışmada diasetilin temas sensitizasyon potansiyeli araştırılmış ve diasetil güçlü temas sensitizanı olarak sınıflandırılmıştır. Ancak bir diğer çalışmada (Robert ve diğerleri, 1999) diasetil zayıf sensitizan olarak bulunmuştur. Dworak ve arkadaşlarının (2013) yapmış olduğu modelleme çalışmasına göre diasetilin solunum sensitizasyon potansiyeline sahip olmadığı yorumlanmıştır. National Toxicology Program (NTP) raporu doğrultusunda diasetilin temas sensitizasyonu potansiyelinin olmadığı söylenebilir. Bizim bulgularımız bu araştırmalarla uyumlu olarak diasetilin temas sensitizasyon poyansiyeli taşımadığını göstermektedir. Solunum ve temas sensitizanları Radyoaktif LLNA ile ayrımının yapılıp yapılmayacağını araştıran çalışmalar göstermiştir ki sadece lenfosit proliferasyonu indüksiyonunun belirleyici bir marker olamayacağı ek son noktaların (sitokin ölçümü gibi) ölçülmesinin gerekliliği ortaya konmuştur. Bunun üzerine sitokin ve IgE düzeyleri ölçülmüştür. 90 Farelerde kimyasal alerjenler tarafından indüklenen cevaplara ait sitokin profillemesinin, tehlikenin belirlenmesine yönelik alternatif stratejiler için temel oluşturabileceği düşünülmektedir. Tez çalışmamızda deneysel temas sensitizanı olarak kullanılan solunum sensitizasyonu potansiyeli açısından negatif kontrol olarak kullandığımız DNCB, kısa süreli dermal maruziyet sonrası Th1 sitokini IFN-γ üretimini beklediğimiz üzere anlamlı şekilde indüklemiştir (p < 0,01). Bu sonuç temas sensitizasyonunun Th1 hücreleri aracılı gerçekleştiğini desteklemektedir. Ancak DNCB ile kısa süreli maruziyet sonrası IL-4, IL10 ve IL-13 düzeyleri çözücü kontrolüne kıyasla yüksek istatistiksel anlamlılıkta artış göstermiştir (p < 0,01). Dearman ve arkadaşları (2003b) da uyguladığımız DNCB konsantrasyonunda şiddetli IFN-γ üretimi ile birlikte tip 1 sitokin profili indüksiyonu ancak daha düşük seviyede tip 2 sitokinleri IL-4, IL-10 ve IL-13 artışı kaydetmişlerdir. Elde ettiğimiz verilerin Dearman’ın çalışmasını ve diğer yayınları (Selgrade ve diğerleri, 1997; Farraj ve diğerleri, 2007) desteklemesi, DNCB’ye temas sensitizasyonunun gelişmesinde karma Th1/Th2 yanıtlarının ve bu hücrelerin sitokinlerinin etkili olduğunu göstermektedir. Pozitif kontrol olarak kullandığımız solunum sensitizanı olarak kabul edilen TMA, Dearman ve arkadaşlarının (2009) çalışmasını baz alarak %10 konsantrasyonda farelere uygulandı.. Çözücü kontrole göre lenfosit proliferasyonunun daha fazla indüklediği konsantrasyon olan %10’luk TMA’nın sitokin profili analizi için uygun olduğuna karar verdik. Solunum sensitizasyonu gelişimi hem ani hem de geç faz reaksiyonlarını kapsamaktadır. Bundan dolayı ani faz reaksiyonlarında rol oynayan Th2 sitokinleri ve özellikle IL-4 artışı ile IgE antikor cevabı ile hücre aracılı geç faz reaksiyonda görevli Th1 sitokinlerinin yanıtını içeren karma immün yanıtın solunum bölgesinin aşırı duyarlılık reaksiyonlarında baskın olabileceği varsayımı yapılabilir. Çalışmamızdaki sitokin profillemesi sonuçlarına göre bu varsayımı destekleyecek şekilde, kısa süreli dermal maruziyet sonrası TMA, Th1 sitokini IFN-γ’yı çözücü kontrol grubuna göre istatistiksel olarak anlamlı şekilde indüklemiştir (p < 0,01). Beklediğimiz üzere TMA tarafından indüklenen Th2 sitokinleri IL-4, IL-5, IL-10 ve IL-13 düzeylerinin çözücü 91 kontrole göre artışı istatistiksel olarak anlamlıdır (p < 0,01). Bu veriler pozitif kontrol olarak %10’luk TMA’nın iyi bir seçim olduğunu göstermektedir. Moussavi ve arkadaşlarının (1998) yürüttüğü çalışmada, TMA’ya ilk maruziyetin DNCB’ye kıyasla lenf düğümü hücrelerinde daha güçlü IFN-γ üretimi indüklediği tespit edilirken, tam tersi bir ilişkinin kronik maruziyeti takiben geliştiği gösterilmiştir. Bu durumu, DNCB ve TMA maruziyeti ile indüklenen sitokin ekspresyon modellerinin CD4+ T lenfositlerin (yardımcı T lenfositleri) yanı sıra CD8+ T lenfositlerin (sitotoksik T lenfositleri) de katılımıyla şekillendiğinin kanıtı olarak kabul etmişlerdir. Selgrade ve arkadaşları (1997) DNCB ile indüklenen şiddetli IFN-γ üretimine hem Th1 hem de sitotoksik T 1 hücrelerinin (Tc1) katıldığını, az miktarda indüklenen IL-4 sekresyonunda ise Th2 hücrelerin etkili olduğunu belirtmişlerdir. TMA’nın indüklediği şiddetli IL-4 salımının ise sadece Th2 hücreleri, az miktarda IFN-γ üretiminin Tc1 hücreleri aracılı olduğu savunulur. Bu veriler doğrultusunda solunum sensitizanlarının karma Th1/Th2 immün yanıtlarını indüklediği ortaya konmuştur. Ayrıca CD4+ ve CD8+ T hücrelerinin ekspresyon ölçümlerini kapsayan çalışmalara dayanarak bu immün yanıt oluşumunda sitotoksik T hücrelerinin de rolünün olabileceğini, ortaya koyduğumuz sitokin salım profillerine bakarak söyleyebiliriz. Test maddemiz olan diasetilin kısa süreli maruziyet sonrası sitokin salım profilini değerlendirecek olursak, IL-2 ve IL-4 düzeyinde anlamlı bir artış (p < 0,05), IL-13 düzeyinde de yüksek istatistiksel anlamlılıkta bir artış (p < 0,01) elde edilmiştir. Hem temas hem de solunum sensitizanları uyarımı sonucu bölgesel lenf düğümlerinde T hücre bölünmesini indükleyen IL-2 sitokin düzeyinde her üç kimyasal için çözücü kontrolüne göre anlamlı bir artış olmasını beklerdik. Diasetilin neden olduğu IL-4 ve IL-13 düzeylerindeki artış, diasetilin sorumlu tutulduğu solunum yolları ile ilgili inflamasyon ve aşırı duyarlılık reaksiyonlarına açıklık getirmektedir. 92 Özellikle IL-13 düzeyinde tespit edilen artış, Keane ve arkadaşlarının (2007) bronşiyolitis obliterans sendromunda IL-13 sitokinin rolünü ortaya koydukları çalışmayı desteklemektedir. Th2 sitokini IL-4’ün B lenfositleri tarafından sentezlenen IgE düzeyinin artışında başlıca rolünün olduğu daha önceki çalışmalarda ortaya konmuştur (Dearman ve diğerleri, 1994; Deo ve diğerleri, 2010). IgE aracılı yanıtlara neden olduğu bilinen kimyasallara dermal maruziyet sonrası hem insan hem de farelerde total serum IgE seviyelerinin arttığı gösterilmiştir. Bu verilere dayanarak, tercihen Th2 yolağını indükleyen solunum sensitizanı TMA’nın ve test maddemiz diasetilin IL-4 aracılığıyla serum IgE seviyesinde artışa neden olmalarını bekledik. Ancak sadece diasetil için serum IgE konsantrasyonu kısa süreli maruziyet sonrası çözücü kontrol grubuna göre anlamlı artış göstermiştir (p<0,05). Daha önce yapılan çalışmalarda farelerin DNCB’ye standart LLNA protokolünde belirtilenden daha uzun süreli topikal maruziyetinin lenf düğümü hücrelerinin proliferasyonunu indüklemesi ile ilişkili olarak daha immünojenik olduğu ortaya konmuştur (Dearman ve diğerleri, 2003b). Bu nedenle standart LLNA protokolünde yer alan 3 günlük kısa süreli maruziyet ile birlikte 13 günlük kronik maruziyet protokolünü yürütmeye karar verdik. Kronik maruziyeti takiben lenfosit proliferasyonunun BrdU:ELISA yöntemi ile ölçümü sonrası DNCB’nin %1’lik konsantrasyonunun SI değeri 1,6’dan büyük olduğundan seçtiğimiz konsantrasyonda bu kimyasalın temas sensitizanı olduğunu söyleyebiliriz. TMA ve diasetilin seçtiğimiz konsantrasyonları dermal uygulama sonrası, radyoaktif olmayan ex vivo LLNA:BrdU yönteminden beklediğimiz üzere lenfosit proliferasyonunu anlamlı şekilde indüklememiştir. Buna göre %10 TMA ve %10 diasetil için temas sensitizasyon potansiyeline sahip olmadıkları yorumu yapılabilir. Hem kimyasal hem de solunum alerjenlerine kısa süreli maruziyetin benzer sitokin yanıtları oluşturacağı, daha uzun süreli maruziyetin ise selektif sitokin üretimi ile sonuçlanacağının belirtilmesine karşın (Kimber ve diğerleri, 1996), deney sonuçlarımız bunu yansıtmamaktadır. Temas sensitizanı DNCB’nin 13 günlük dermal maruziyetinin selektif tip 1 sitokin indüksiyonu yaptığının gösterilmesine karşın (Dearman ve diğerleri, 2003b), bulduğumuz IFN-γ düzeyi DNCB için anlamlı artış göstermemiştir. Ayrıca 93 DNCB’ye kronik maruziyet sonrası Th2 sitokini IL-4 miktarının oldukça yüksek istatistiksel anlamlılıkta artış göstermiştir. Deney sonucunda temas sensitizasyonunda Th1 ve Th2 sitokinlerinin beraber rol oynadığını söyleyebiliriz. T lenfositlerin olgunlaşması ve çoğalmasında rol oynayan IL-2’nin DNCB ve TMA için anlamlı çıkması, bu kimyasalların T lenfositlerde immün cevabı indüklediklerini göstermektedir. Dearman ve arkadaşlarının (2009) TMA’ya 13 günlük kronik maruziyeti sonrası oldukça yüksek seviyede IL-4, IL-5, IL-10 ve IL-13 artışı kaydetmesi solunum sensitizanlarının selektif Th2 yanıtlarını indüklediğini göstermektedir. Bulgularımıza göre solunum sensitizanı TMA’nın kronik maruziyet sonrası anlamlı düzeyde IL-4 ve IL-13 artışına neden olması bu sitokinlerin solunum aşırı duyarlılık reaksiyonlarında etkin olduğunu ve bu tip reaksiyonlarda Th2 yolağının ağır bastığını göstermektedir. Ayrıca kısa süreli standart prosedürün yanı sıra kronik sensitizan maruziyetinin de aşırı duyarlılık reaksiyonlarında anlamlı sitokin cevabını indükleyeceğinin gösterilmesi 13 günlük deney prosedürünün uygulanabilirliğini ortaya koymuştur. Dearman ve arkadaşları (2009) kronik maruziyet sonrası TMA’nın DNCB’ye kıyasla sergilediği yüksek Th2 sitokin profili sonuçlarına dayanarak solunum sensitizanlarının temas sensitizanlarından ayrımının yapılabileceği görüşünü savunurlar. Bu hipoteze karşın elde ettiğimiz DNCB tarafından indüklenen IL-4 artışından dolayı Th2 sitokinlerinin ayırıcı bir gösterge olmadığını düşünüyoruz. Diasetile kronik maruziyet sonrası incelediğimiz sitokinlerde çözücüye kıyasla anlamlı bir artış gözlemlemedik. Buna istinaden diasetile kronik maruziyetin daha spesifik bir sitokin profili ortaya koymayacağı görüşündeyiz. IgE’nin indüklendiği alerjenlerin belirlenmesine yönelik fare total serum IgE ELISA yönteminin kullanıldığı birçok araştırma mevcuttur. Ancak bu yöntemin güvenilirliği, IgE aracılı yanıtları indüklemediği bilinen DNCB’ye maruz bırakılan hayvanlarda total serum IgE seviyesinin kontrollere kıyasla yüksek çıkması nedeniyle tartışmalıdır. Ayrıca total serum IgE seviyelerindeki tutarsızlığın nedeni olarak farklı fare ırkları kullanılması veya fareler arasında IgE seviyelerindeki farklılıklar gösterilmiştir (Manetz ve Meade, 1999). 94 Hem kısa süreli maruziyet hem de kronik maruziyet sonrası DNCB için total serum IgE düzeyi anlamlı bir artış gözlemlemedik. Birçok çalışmada TMA’nın IgE ile ilişkisinin gösterilmesine karşın, yürütmüş olduğumuz her iki maruziyet protokolünde de anlamlı bir IgE artışı kaydetmedik. Ayrıca TMA maruziyeti için IL-4 düzeyi ve IgE miktarı arasında bir korelasyondan söz edemeyiz. TMA IL-4 seviyesini her iki maruziyet sonrasında da anlamlı şekilde artırmış olsa da, IgE cevabı yetersiz çıkmıştır. Diasetil hem kısa süreli hem de kronik maruziyet sonrası serum IgE konsantrasyonunu anlamlı şekilde indüklemiştir. Diasetil maruziyeti için, IL-4 ve IgE düzeyleri arasındaki ilişkiyi sadece kısa süreli maruziyete göre değerlendirmemiz doğru olmaz, çünkü kronik maruziyette anlamlı IL-4 artışı gözlenmemesine karşın, IgE düzeyi oldukça yüksek çıkmıştır. Amaçlandığı gibi çalışmalarımız doğrultusunda, kimyasalların alerjik potansiyellerini ölçebilen, radyoaktif olmayan ve hayvan refahını gözeten bir yöntemin kurulması gerçekleştirilmiştir. Tez kapsamında yapılan sitokin analizlerinin amacı, Kimyasalların alerjik potansiyellerinin tespitinde alternatif sonuç noktaları olarak kullanıp kullanılmayacaklarını tespit etmek Solunum sensitizanları ve temas sensitizanlarının farklı sitokin profili gösterip göstermeyeceklerini saptamak Diasetilin tüm sitokin profilini ortaya koymaktır. Uyguladığımız kimyasallar ile elde ettiğimiz sitokin analizleri sonuçları doğrultusunda, Th1 sitokini IFN-γ’nın DNCB ve TMA için benzer sonucu vermesi bu sitokinin temas ve solunum alerjenlerinin ayrımında indikatör olarak kullanılması için uygun olmadığını ortaya koyar. IL-2’nin temas dermatitinde Th1 cevabının gelişiminde etkili olduğunu ve solunum ile temas sensitizanlarının ayrımında IL-2 sitokininin kullanılabileceğini savunan hipotezin (Goutet ve diğerleri, 2012) aksine, elde ettiğimiz sonuçlar neticesinde IL-2’nin ayırıcı indikatör olarak kullanılabileceğini düşünmüyoruz. Th2 hücrelerinden salınan IL4’ün de sadece solunum sensitizasyonunun oluşumunda özgül olmadığı, temas sensitizasyonunda kayda değer miktarda salındığı tespit edilmiştir. Diğer Th2 sitokinlerinin sadece solunum sensitizanları ile up-regüle olduğu ve bu nedenle bunların ayrılmasında 95 kullanılabileceği iddiasını da bulgularımız desteklememektedir. Özellikle kısa süreli maruziyet sonrası hem Th1 hem de Th2 sitokin düzeylerindeki anlamlı artışlar, her iki tip alerjik reaksiyonda da karma sitokin cevabının rol oynadığını göstermektedir. Diasetilin göstermiş olduğu sitokin salım profili, bu kimyasalın yol açtığı solunum bölgesi ile ilşkili hastalıklarda Th2 yolağının etkili olduğu iddiasını desteklememektedir. Ancak kısa süreli maruziyet protokolünden elde edilen diasetilin indüklediği anlamlı IL-13 artışı, solunum yolları ile ilişkili bronşiyolitis obliterans sendromunda IL-13 sitokinin etkin role sahip olduğu iddiasına olumlu veri oluşturması açısından katkı sağlamaktadır. Tez kapsamında yapılan serum IgE konsantrasyonunun ölçümünün amacı, IgE miktarının solunum ve temas sensitizasyonlarının ayrımında kullanılıp kullanılmayacağını göstermek, Diasetilin indüklediği immün yanıtların IgE aracılı olup olmadığını tespit etmektir. Uyguladığımız kimyasallar ile elde ettiğimiz IgE düzeyleri sonuçları doğrultusunda, temas ve solunum sensitizanlarının ayrımının IgE üretimine göre yapılamayacağı gösterilmiştir. Diasetilin hem kronik hem de kısa süreli maruziyetinin indüklediği immün yanıtların IgE aracılı olduğunu söyleyebiliriz. Diasetil için Th2 sitokinlerinin anlamlı çıkmaması, ancak serum IgE konsantrasyonunun artış göstermesi, bu kimyasalın yol açtığı solunum bölgesi hastalıklarında hücre aracılı gecikmiş tip aşırı duyarlılığın etkin rol oynamadığını düşündürmektedir. Sitokin profillemesinin ve serum IgE konsnatrasyonu ölçümünün istenilen beklentiyi karşılamaması temas ve solunum sensitizanlarının birbirinden ayrılmasına yönelik LLNA’nın özgüllüğünü artırmak için daha sağlam verilere ihtiyaç duyulmaktadır. Daha önce yürütülen çalışmalarda kaydedilen veriler doğrultusunda, sitokin profillemesinin tehlikenin belirlenmesi için alternatif bir yaklaşım olarak kabul edilebilir olmasına karşın, elde ettiğimiz veriler kimyasal solunum alerjenlerinin rölatif sensitizasyon potansiyellerinin değerlendirilmesi için yeterli uygunluğa sahip olmadığını göstermektedir. Bu yöntemin solunum sensitizanlarının rölatif etkinliklerinin belirlenmesine nasıl dönüştürüleceği de net değildir. Çünkü spesifik bir sitokinin belirli ekspresyon seviyesi için ne kadar kimyasal gerektiği bu yöntemle belirlenememektedir. Kimyasalların sitokin 96 üretimi için gerekli olan minimum konsantrasyonlarından ziyade hangi tip sitokinlerin üretildiği tespit edilmektedir. Bu nedenle bu yöntemin kimyasalların olası temas sensitizanı potansiyellerinin ileriye yönelik belirlenmesi ve sınıflandırılması için uygun olacağını düşünüyoruz. Ancak solunum sensitizasyonunun toksikolojik değerlendirmesinde sitokin profillemesinin geçerliliği için daha fazla kimyasalla yapılan çalışmalara ve verilere ihtiyaç vardır. Çalışmamızı kısa süreli (3 günlük) ve kronik (13 günlük) olmak üzere iki tip maruziyet protokolü çerçevesinde yürüttük. Kronik maruziyet ile temas ve solunum sensitizanlarının ayrımında daha iyi sonuç alındığını gösteren çalışmaların aksine, kısa süreli maruziyet ile daha tutarlı veriler elde ettik. 97 6. SONUÇ ve ÖNERİLER Tez çalışmamızın immünotoksisite amacı, solunum sensitizasyonuna yol açtığı bilinen ancak mekanizması tam olarak ortaya konmamış diasetilin solunum sensitizasyonu potansiyelini gösterdiği sitokin salım profili ve IgE üretimi ile ilişkisi üzerinden değerlendirmekti. Bu amaçla öncelikle diasetilin LLNA ile sensitizan olduğu belirlenmiş konsantrasyonunda, aynı yöntemde modifikasyonlar yaparak verdiği immün cevabı inceledik. Ardından aynı konsantrasyonda Th1 ve Th2 sitokin düzeyleri ile total serum IgE konsantrasyonunu ölçtük. Sonuç olarak kimyasalların sensitizasyon potansiyellerinin değerlendirildiği çalışmalarda kullanılan deney protokolleri üzerinde, en az sayıda hayvana mümkün olan en az acıyı verecek ufak modifikasyonlar yaparak ilk defa disetilin tüm sitokin profilini ve IgE üretimi ile ilişkisini ortaya koyduk. Gıda endüstrisi pek çok maruziyetin bir arada bulunduğu ve solunum sistemi etkilenmesinin oldukça sık görüldüğü bir iş koludur. Bu iş kolunda oldukça sık kullanılan katkı maddelerine maruziyet astım, rinit, solunum yolu rahatsızlıkları gibi aşırı duyarlılık reaksiyonlarının ortaya çıkmasından sorumludur. Tehlikelerinin yeterince ortaya konmadığı, olası zararlı etkileri belirlenmeyen ve kullanılırken korunma önlemleri alınmayan diasetil gibi kimyasal tatlandırıcılar genç yaşta üretken kişileri akciğer transplantasyonu listelerine sokacak kadar malul edici bronşiyolitis obliterans sendromuna yol açabilir. Bir kimyasalın oluşturduğu riskin değerlendirilmesi ve sağlık otoriteleri tarafından bu riskin yönetilmesi için öncelikle bu kimyasalın tehlikesinin belirlenmesi ve bu tehlikeyi oluşturan toksikolojik mekanizmaların ortaya konması gerekmektedir. Bundan dolayı, diasetilin toksisite mekanizmasının ayrıntılı bir şekilde incelendiği bir çalışma şimdiye kadar mevcut olmadığından diasetilin tehlikesini, gösterdiği sitokin salım profilinden ve IgE cevabından hareketle belirlemeyi amaçladık. Diasetilin tehlikesinin belirlenmesinde sitokinlerin sonuç nokta olarak kullanılmasında yeterli olmayacağını, ancak IL-13 ve IgE düzeylerindeki artışın, diasetilin solunum sensitizasyonu tehlikesine işaret olabileceğini ortaya koyduk. 98 Bu çalışma sonucu elde edilen veriler mesleki sağlık açısından düşünüldüğünde, deri ve solunum bölgesinin alerjik sensitizasyonuna yol açan düşük molekül ağırlığına sahip kimyasalların üretim güvenliğinin sağlanması ve prediktif toksikoloji yaklaşımının benimsenmesine katkı sağlayacaktır. Kimyasalların alerji potansiyellerinin belirlenmesi ve sınıflandırılmasına olanak tanıyacak bu yöntemin geliştirilmesi ve daha fazla sayıda kimyasal madde ile kapsamlı laboratuarlar arası çalışmaların yapılmasının regülasyonların hazırlanmasında sağlık otoritelerine yardımcı olacağını ve solunum sensitizanlarının sınıflandırılmasında var olan boşluğu kapatabileceğini düşünüyoruz. 99 KAYNAKLAR Abbas, A.K., and Lichtman, A.H. (2007). Temel immünoloji. (çev. Y. Camcıoğlu, G. Deniz). İstanbul Medikal Yayıncılık. 193-208. Abbas, A.K., Murphy, K.M., and Sher, A. (1996). Functional diversity of helper T lymphocytes. Nature, 383, 787-793. Adenuga, D., Woolhiser, M.R., Gollapudi, B.B., and Boverhof, D.R. (2012). Differential gene expression responses distinguish contact and respiratory sensitizers and nonsensitizing irritants in the local lymph node assay. Toxicological Sciences, 126(2), 413-425. Akpinar-Elci, M., Travis, W.D., Lynch, D.A., and Kreiss, K. (2004). Bronchiolitis obliterans syndrome in popcorn production plant workers. European Respiratory Journal, 24, 298-302. Anderson, S.E., Siegel, P.D., and Meade, B.J. (2011). The LLNA: a brief review of recent advances and limitations. Journal of Allergy, 2011, 1-10. Anderson, S.E., Wells, J.R., Fedorowicz, A., Butterworth, L.F., Meade, B.J., and Munson, A.E. (2007). Evaluation of the contact and respiratory sensitization potential of volatile organic compounds generated by simulated indoor air chemistry. Toxicological Sciences, 97(2), 355-363. Arts, J.H., De Jong, W.H., Van Triel, J.J., Schijf, M.A., De Klerk, A., Van Loveren, H., and Kuper, C.F. (2008). The respiratory local lymph node assay as a tool to study respiratory sensitizers. Toxicological Sciences, 106(2), 423-434. Ashikaga, T., Yoshida, Y., Hirota, M., Yoneyama, K., Itagaki, H., Sakaguchi, H., Miyazawa, M., Ito, Y., Suzuki, H., and Toyoda, H. (2006). Development of an in vitro skin sensitization test using human cell lines: the human cell line activation test (h-CLAT). I. optimization of the h-CLAT protocol. Toxicology in Vitro, 20(5), 767773. Azam, P., Peiffer, J.L., Chamousset, D., Tissier, M.H., Bonnet, P.A., Vian, L., Fabre, I., and Ourlin, J.C. (2006). The cytokine-dependent MUTZ-3 cell line as an in vitro model for the screening of contact sensitizers. Toxicology and Applied Pharmacology, 212(1), 14-23. Ban, M., Morel, G., Langonne, I., Huguet, N., Pepin, E., and Binet, S. (2006). TDI can induce respiratory allergy with Th2-dominated response in mice. Toxicology, 218, 39-47. Basketter, D.A. (2008). Skin sensitisation: strategies for risk assessment and risk management. British Journal of Dermatology, 159, 267-273. Basketter, D.A., and Kimber, I. (2011). Assessing the potency of respiratory allergens: uncertainties and challenges. Regulatory Toxicology and Pharmacology, 61, 365372. 100 Basketter, D.A., Anderson, K.E., Liden, C., Van Loveren, H., Boman, A., Kimber, I., Alanko, K., and Berggren, E. (2005a). Evaluation of the skin sensitizing potency of chemicals by using the existing methods and considerations of relevance for elicitation. Contact Dermatitis, 52, 39-43. Basketter, D.A., Blaikie, L., Dearman, R.J., Kimber, I., Ryan, C.A., Gerberick, G.F., Harvey, P., Evans, P., White, I.R., and Rycroft, R.J.G. (2000). Contact Dermatitis, 42, 344-348. Basketter, D.A., Clapp, C., Jefferies, D., Safford, B., Ryan, C.A., Gerberick, G.F., Dearman, R.J., and Kimber, I. (2005b). Predictive identification of human skin sensitisation thresholds. Contact Dermatitis, 53, 260-267. Basketter, D.A., Gerberick, F., and Kimber, I. (2014). The local lymph node assay in 2014. Dermatitis, 25(2), 49-50. Bousquet, J., JeferyP.K., Busse, W.W., Johnson, M., and Vignola, A.M. (2000). Asthma from bronchoconstriction to airways inflammation and remodeling. American Journal of Respiratory and Critical Care Medicine, 161, 1720-1745. Boverhof, D.R., Billington, R., Gollapudi, B.B., Hotchkiss, J.A., Krieger, S.M., Poole, A., Wiescinski, C.M., and Woolhiser, M.R. (2008). Respiratory sensitization and allergy: current research approaches and needs. Toxicology and Applied Pharmacology, 226(1), 1-13. Boverhof, D.R., Gollapudi, B.B., Hotchkiss, J.A., Osterloh-Quiroz, M., and Woolhiser, M.R. (2009). Evaluation of a toxicogenomic approach to the local lymph node assay (LLNA). Toxicological Sciences, 107(2), 427-439. Casati S, Aeby P, Basketter D A, Cavani A, Gennari A, Gerberick G F, Griem P, Hartung T, Kimber I, Lepoittevin J-P, Meade B J, Pallardy M, Rougier N, Rousset F, Rubinstenn G, Sallusto F, Verheyen G R, and Zuang V. (2005). Dendritic cells as a tool for the predictive identification of skin sensitisation hazard. ATLA, 33, 47–62. Chung, K.F., and Barnes, P.J. (1999). Cytokines in asthma. Thorax, 54(9), 825-857. Corrigan, C.J., ve Kay, A.B. (1992). Asthma. Role of T-lymphocytes and lymphokines. British Medical Bulletin, 48(1), 72-84. Cumberbatch, M., Dearman, R.J., Griffiths, C.E.M., and Kimber, I. (2000). Langerhans cell migration. Clinical and Experimental Dermatology, 25, 413-418. Dearman, R.J., and Kimber, I. (1991). Differential stimulation of immune function by respiratory and contact chemical allergens. Immunology, 72, 563-570. Dearman, R.J., and Kimber, I. (2001). Cytokine fingerprinting and hazard assessment of chemical respiratory allergy. Journal of Applied Toxicology, 21(2), 153-156. Dearman, R.J., Basketter, D.A. and Kimber, I. (1996). Characterization of chemical allergens as a function of divergent cytokine secretion profiles induced in mice. Toxicology and Applied Pharmacology, 138, 308-316. 101 Dearman, R.J., Basketter, D.A., Evans, P., and Kimber, I. (1999). Comparison of cytokine secretion profiles provoked in mice by glutaraldehyde and formaldehyde. Clinical and Experimental Allergy, 29, 124-132. Dearman, R.J., Basketter, D.A.,and Kimber, I. (2013). Inter-relationships between different classes of chemical allergens. Journal of Applied Toxicology, 33(7), 558565. Dearman, R.J., Betts, C.J., Caddick, H.T., and Kimber, I. (2009). Cytokine profiling of chemical allergens in mice: impact of mitogen on selectivity of response. Journal of Applied Toxicology, 29, 233-241. Dearman, R.J., Betts, C.J., Humphreys, N., Flanagan, B.F., Gimour, N.J., Basketter, D.A., and Kimber, I. (2003a). Chemical allergy: considerations for the practical application of cytokine profiling. Toxicological Sciences, 71(2), 137-145. Dearman, R.J., Humphreys, N., Skinner, R.A., and Kimber, I. (2005). Allergen-induced cytokine phenotypes in mice: role of CD4 and CD8 T cell populations. Clinical & Experimental Allergy, 35(4), 498-505. Dearman, R.J., Ramdin, L.S.P., Basketter, D.A., and Kimber, I. (1994). Inducible interleukin-4-secreting cells provoked in mice during chemical sensitization. Immunology, 81, 551-57. Dearman, R.J., Skinner, R.A., Humphreys, N.E., and Kimber, I. (2003b). Methods for the identification of chemical respiratory allergens in rodents: comparisons of cytokine profiling with induced changes in serum IgE. Journal of Applied Toxicology, 23, 199-207. Dearman, R.J., Warbrick, E.V., Humphreys, I.R., and Kimber, I. (2000). Characterization in mice of the immunological properties of five allergenic acid anhydrides. Journal of Applied Toxicology, 20, 221-230. Deo, S.S., Mistry, K.J., Kakade, A.M., and Niphadkar, P.V. (2010). Role played by Th2 type cytokines in IgE mediated allergy and asthma. Lung India, 27(2), 66-71. Dhingra, N., Shemer, A., Da Rosa, J.C., Rozenblit, M., Suárez-Fariñas, M., FuentesDuculan, J., Gittler, J.K., Finney, R., Czarnowicki, T., Zheng, X., Xu, H., Estrada, Y.D., Cardinale, I., Krueger, J.G., and Guttman-Yassky, E. (2014). Molecular profiling of contact dermatitis skin identifies allergen-dependent differences in immune response. Journal of Allergy and Clinical Immunology, 134(2), 362-372. Divkovic, M., Pease, C.K., Gerberick, G.F., and Basketter, D.A. (2005). Hapten- protein binding: from theory to practical application in the in vitro prediction of skin sensitization. Contact Dermatitis, 53(4), 189-200. Dworak, J.J., Roberts, D.W., Calter, M.A., Fields, C.A., and Borak, J. (2013). Is diasetyl a respiratory sensitizer? A reconsideration using QSAR, QMM, and competition experiments. Chemical Research in Toxicology, 26, 631-633. Dykewicz, M.S. (2009). Occupational asthma: current concepts in pathogenesis, diagnosis, and management. The Journal of Allergy and Clinical Immunology, 123, 519-528. 102 Egilman, D.S., and Schilling, J.H. (2012). Bronchiolitis obliterans and consumer exposure to butter-flavored microwave popcorn: a case series. International Journal of Occupational and Environmental Health, 18(1), 29-42. Farraj, A.K., Boykin, E., Haykal-Coates, N., Gavett, S.H., Doerfler, D., and Selgrade, M. (2007). Th2 cytokines in skin draining lymph nodes and serum IgE do not predict airway hypersensitivity to intranasal isocyanate exposure in mice. Toxicological Sciences, 100(1), 99-108. Farraj, A.K., Harkema, J.R., and Kaminski, N.E. (2006). Topical application versus intranasal instillation: a qualitative comparison of the effect of the route of sensitization on trimellitic anhydride–induced allergic rhinitis in A/J mice. Toxicological Sciences, 92(1), 321-328. Foster, P.S., Hogan, S.P., Matthaei, K.I. and Young, I.G. (1997). Interleukin-4 and interleukin-5 as targets for the inhibiton of eosinophilic inflammation and allergic airways hyperreactivity. Memórias do Instituto Oswaldo Cruz, 92, 55-61. Friedmann, P.S. (2006). Contact sensitization and allergic contact immunobiological mechanisms. Toxicology Letters, 162, 49-54. dermatitis: Gerberick, G.F., Robinson, M.K., Ryan, C.A., Dearman, R.J., Kimber, I., Basketter. D.A., Wright, Z.M., and Marks, J.G. (2001). Contact allergenic potency: correlation of human and local lymph node assay data. American Journal of Contact Dermatitis, 12, 156–161. Gerberick, G.F., Ryan, C.A., Kern, P.S., Schlatter, H., Dearman R.J., Kimber, I., Patlewicz, G.Y., and Basketter D.A. (2005). Compilation of historical local lymph node data for evaluation of skin sensitization alternative methods. Dermatitis, 16(4), 157-202. Gerberick, G.F., Ryan, C.A., Kimber, I., Dearman, R.J., Lea, L.J., and Basketter D.A. (2000). Local lymph node assay: validation assessment for regulatory purposes. American Journal of Contact Dermatitis, 11(1), 3-18. Goldsby, R.A., Kindt, T.J., Kuby, J., and Osborne, B.A. (2002). Kuby Immunology. (Fourth edition). New york Freeman, 373. Goutet, M., Pépin, E., Langonné, I., Huguet, N., and Ban, M. (2012). Identification of contact and respiratory sensitizers according to IL-4 receptor α expression and IL-2 production. Toxicology and Applied Pharmacology, 260(2), 95-104. Hilton, J., Dearman, R.J., Basketter, D.A, and Kimber, I. (1995). Identification of chemical respiratory allergens: dose-response relationships in the mouse IgE test. Toxicology Methods, 5(1), 51-60. Holsapple, M.P., Jones, D., Kawabata, T.T., Kimber, I., Sarlo, K., Selgrade, M.K., Shah, J., and Woolhiser, M.R. (2006). Assessing the potential to induce respiratory hypersensitivity. Toxicological Sciences, 91(1), 4-13. 103 Howell, M.D., Weissman, D.N., and Jean Meade, B. (2002). Latex sensitization by dermal exposure can lead to airway hyperacitivity. International Archives of Allergy and Immunology, 128, 204-211. Hubbs, A.F., Battelli, L.A., Goldsmith, W.T., Porter, D.W., Frazer, D., Friend, S., Schwegler-Berry, D., Mercer, R.R., Reynolds, J.S., Grote, A., Castranova, V., Kullman, G., Fedan, J.S., Dowdy, J., and Jones, W.G. (2002). Necrosis of nasal and airway epithelium in rats inhaling vapors of artificial butter flavoring. Toxicology and Applied Pharmacology, 185, 128-135. Isola, D., Kimber, I., Sarlo, K., Lalko, J., and Sipes, I.G. (2008). Chemical respiratory allergy and occupational asthma: what are the key areas of uncertainty? Journal of Applied Toxicology, 28, 249-253. Kanwal, R., Kullman, G., Piacitelli, C., Boylstein, R., Sahakian, N., Martin, S., Fedan, K., and Kreiss, K. (2006). Evaluation of flavorings-related lung disease risk at six microwave popcorn plants. Journal of Occupational and Environmental Medicine, 48(2), 149-157. Karol, M.H. (1994). Animal models of occupational asthma. European Respiratory Journal, 7, 555-568. Keane, M.P., Gomperts, B.N., Weigt, S., Xue, Y.Y., Burdick, M.D., Nakamura, H., Zisman, D.A., Ardehali, A., Saggar, R., Lynch III, J.P., Hogaboam, C., Kunkel, S.L., Lukacs, N.W., Ross, D.J., Grusby, M.J., Strieter R.M., and Belperio, J.A. (2007). IL13 is pivotal in the fibro-obliterative process of bronchiolitis obliterans syndrome. The Journal of Immunology, 178, 511-519. Kelso, A. (1998). Cytokines: principles and prospects. Immunology and Cell Biology, 76, 300-317. Kelso, A. (2000). Cytokines and their receptors: an overview. Therapeutic Drug Monitoring, 22(1), 40-43. Kimber, I., Agius, R., Basketter, D.A., Corsini, E., Cullinan, P., Dearman, R.J., GimenezArnau, E., Greenwell, L., Hartung, T., Kuper, F., Maestrelli, P., Roggen, E., and Rovida, C. (2007). Chemical respiratory allergy: opportunities for hazard identification and characterisation. ATLA, 35, 243-265. Kimber, I., and Dearman, R.J. (1997). Cell and molecular biology of chemical allergy. Clinical Reviews in Allergy & Immunology, 15(2), 145-168. Kimber, I., and Dearman, R.J. (1998). T-lymphocyte sub-populations and immune responses to chemical allergens. In I. Kimber and M.J. Selgrade (Eds), T lymphocyte Subpopulations in Immunotoxicology. Chichester, UK: John Wiley and Sons, pp: 199-231. Kimber, I., and Dearman, R.J. (2002). Chemical respiratory allergy: role of IgE antibody and relevance of route of exposure. Toxicology, 181-182, 311,315. Kimber, I., and Dearman, R.J. (2005). What makes a chemical a respiratory sensitizer? Current Opinion in Allergy and Clinical Immunology, 5(2), 119-124. 104 Kimber, I., and Weisenberger, C. (1989). A murine local lymph npde assay fort he identification of contact allergens. Assay development and results of an inital validation study. Archives of Toxicology, 63, 274-282. Kimber, I., Basketter, D.A., Butler, M., Gamer, A., Garrigue, J.L., Gerberick, G.F., Newsome, C., Steiling, W., Vohr, H.W. (2003) Classification of contact allergens according to potency: proposals. Food and Chemical Toxicology, 41, 1799-1809. Kimber, I., Basketter, D.A., Gerberick, G.F., Ryan, C.A., and Dearman, R.J. (2011). Chemical allergy: translating biology into hazard characterization. Toxicological Sciences, 120(1), 238-268. Kimber, I., Basketter, D.A., Thyssen, J.P., Dearman, R.J., and McFadden, J.P. (2014). Chemical allergy in humans. Journal of Immunotoxicology, 11(3), 203-204. Kimber, I., Cumberbatch, M., Dearman, R.J., Bhusnan, M., and Griffiths, C.E.M. (2000). Cytokines and chemokines in the initiation and regulation of epidermal Langerhans cell mobilization. British Journal of Dermatology, 142, 401-412. Kimber, I., Hilton, J., Basketter, D.A., and Dearman, R.J. (1996). Predictive testing for respiratory sensitization in the mouse. Toxicology Letters, 86(2-3), 193-198. Kojima, H. (2008). Current status of safety evaluation and alternative to animal testings in Japan. The Pharmaceutical Society of Japan Abstracts. Kondo, H., Ichikawa, Y., and Imokawa, G. (1998). Percutaneous sensitization with allergens through barrier-disrupted skin elicits a Th2-dominant cytokine response. European Journal of Immunology, 28, 769-779. Kreiss, K., Gomaa, A., Kullman, G., Fedan, K., Simoes, E., and Enright, P.L. (2002). Clinical bronchiolitis obliterans in workers at a microwave-popcorn plant. The New England Journal of Medicine, 347(5), 330-338. Lockey, J.E., Hilbert, T.J., Levin, L.P., Ryan, P.H., White, K.L., Borton, E.K., Rice, C.H., McKay, R.T., and LeMasters, G.K. (2009). Airway obstruction related to diacetyl exposure at microwave popcorn production facilities. European Respiratory Journal, 34, 63-71. Manetz, T.S., and Meade, B.J. (1999). Development of a flow cytometry assay for the identification and differentiation of chemicals with the potential to elicit irritation, IgE-mediated, or T cell-mediated hypersensitivity responses. Toxicological Sciences, 48(2), 206-217. Mehling, A., Eriksson, T., Eltze, T., Kolle, S., Ramirez, T., Teubner, W., Van Ravenzwaay, B., and Landsiedel, R. (2012). Non-animal test methods for predicting skin sensitization potentials. Archives of Toxicology, 86, 1273-1295. Mori, T., Tanimoto, Y., Ota, M., Masakado, T., Kitamoto, S., Saito, K., Isobe, N., and Kaneko, H. (2012). Comparison of cytokine profiles in bronchoalveolar lavage fluid of mice exposed to respiratory and contact sensitizers. The Journal of Toxicological Sciences, 37(2), 337-343. 105 Moussavi, A., Dearman, R.J., Kimber, I., and Kemeny, D.M. (1998). Cytokine production by CD4+ and CD8+ T cells in mice following primary exposure to chemical allergens: evidence for functional differentiation of T lymphocytes in vivo. International Archives of Allergy and Immunology, 116, 116-123. Newell, L., Polak, M.E., Perera, J., Owen, C., Boyd, P., Pickard, C., Howarth, P.H., Healy, E., Holloway, J.W., Friedmann, P.S., and Ardern-Jones, M.R. (2013). Sensitization via healthy skin programs Th2 responses in individuals with atopic dermatitis. Journal of Investigative Dermatology, 133, 2372-2380. Parmet, A.J., and Von Essen, S. (2002). Rapidly progressive, fixed airway obstructive disease in popcorn workers: a new occupational pulmonary illness? Journal of Occupational and Environmental Medicine, 44(3), 216-218. Potera, C. (2012). Still searching for better butter flavoring. Environmental Health Perspectives, 120(12), a457. Python, F., Goebel, C. And Aeby, P. (2007). Assessment of the U937 cell line for the detection of contact allergens. Toxicology and Applied Pharmacology, 220(2), 113124. Renauld, J.C. (2001). New insights into the role of cytokines in asthma. Journal of Clinical Pathology, 54, 577-589. Roberts, D.W., York, M., and Basketter, D.A. (1999). Structure-activity relationships in the murine local lymph node assay for skin sensitization: alpha,beta-diketones. Contact Dermatitis, 41(1), 14-17. Roggen E., Aufderheide, M., Cetin, Y., Dearman, R.J., Gibbs, S., Hermanns, I., Kimber, I., Regal, J.F., Rovida, C., Warheit, D.B., Uhlig, S., and Casati, S. (2008). The development of novel approaches to the identification of chemical and protein respiratory allergens. ATLA, 36, 591-598. Rovida, C. (2011). Local lymph node assay: how testing laboratories apply OECD TG 429 for REACH purposes. ALTEX, 28(2), 117-129. Ryan, C.A. (2008). New approaches for hazard identification: the development of in vitro methods for predicting contact sensitization potential. Regulatory Toxicology and Pharmacology, 50, 191-193. Sailstad, D.M., Ward, M.D.W., Boykin, E.H.,and Selgrade, M.K. (2003). A murine model for low molecular weight chemicals: differentiation of respiratory sensitizers (TMA) from contact sensitizers (DNFB). Toxicology, 194, 147-161. Saint-Mezard, P., Rosieres, A., Krasteva, M., Berard, F., Dubois, B., Kaiselian, D., and Nicolas, J.F. (2004). Allergic contact dermatitis. European Journal of Dermatology, 14, 284-295. Schachter, E.N. (2002). Popcorn worker’s lung. The New England Journal of Medicine, 347(5), 360-361. 106 Selgrade, M.K., Boykin, E.H., Haykal-Coates, N., Woolhiser, M.R., Wienscinski, C., Andrews, D.L., Farraj, A.K., Doerfler, D.L., and Gavett, S.H. (2006). Inconsistencies between cytokine profiles, antibody responses, and respiratory hyperresponsiveness following dermal exposure to isocyanates. Toxicological Sciences, 94(1), 108-117. Selgrade, M.K., Lawrence, D.A., Ullrich, S.E., Gilmour, M.I., Schuyler, M.R., and Kimber, I. (1997). Modulation of T-helper cell populations: potential mechanisms of respiratory hypersensitivity and immune suppression. Toxicology and Applied Pharmacology, 145(1), 218-229. Shibamoto, T. (2014). Diacetyl: occurence, analysis, and toxicity. Journal of Agricultural and Food Chemistry, 62, 4048-4053. Steinke, J.W., and Borish, L. (2001). Th2 cytokines and asthma interleukin-4: its role in the pathogenesis of asthma, and targeting it for asthma treatment with interleukin-4 receptor antagonists. Respiratory Research, 2(2), 66-70. Suda, A., Yamashita, M., Tabei, M., Taguchi, K., Vohr, H.W.,Tsutsui, N., Suzuki, R., Kikuchi, K., Sakaguchi, K., Mochizuki, K., and Nakamura, K. (2002). Local lymph node assay with non-radioisotope alternative endpoints. The Journal of Toxicological Sciences, 27(3), 205-218. Takeyoshi, M., Yamasaki, K., Yakabe, Y., Takatsuki, M., and Kimber, I. (2001) Development of non-radio isotopic endpoint of murine local lymph node assay based on 5-bromo-2’-deokwyuridine (BrdU) incorporation. Toxicology Letters, 119, 203-208. Tao, Y., Sugiura, T., Nakamura, H., Kido, M., Tanaka, I., and Kuroiwa, A. Experimental lung injury induced b trimellitic anhydride inhalation on guinea pigs. International Archives of Allergy and Immunology, 96(2), 119-127. The National Institute for Occupational Safety and Health. (1978). Current intelligance bulletin 21: trimellitic anhydride (TMA). The National Institute for Occupational Safety and Health. (2011). Criteria for a recommended standart occupational exposure to diacetyl and 2,3-pantadione. The National Institute for Occupational Safety and Health. (2013). Hazard prevention and control of exposure to diacetyl and 2,3-pentanedione. Thyssen, J.P., Giménez-Arnau, E., Lepoittevin, J.P., Menné, T., Boman, A., and Schnuch, A. (2012). The critical review of methodologies and approaches to assess the inherent skin sensitization potential (skin allergies) of chemicals part I. Contact Dermatitis, 66, 11-24. Ulker, O.C., Ates, I., Atak, A., Karakaya, A. (2013). Evaluation of non-radioactive endpoints of ex vivo local lymph node assay-BrdU to investigate select contact sensitizers. Journal of Immunotoxicology, 10(1), 1-8. 107 Ulker, O.C., Kaymak, Y., and Karakaya, A., (2014). Allergenicity evaluation of fragrance mix and its ingredients by using ex vivo local lymph node assay–BrdU endpoints. Food and Chemical Toxicology, 65, 162-167. Van Loveren, H., and Vos, J.G. (2011). Mechanisms of toxicity. In Jeanne Mager Stellman (Ed). Encyclopedia of occupational health and safety. Geneva. International Labor Organization. Van Loveren, H., Cockshott, A., Gebel, T., Gundert-Remy, U., De Jong, W.H., Matheson, J., McGarry, H., Musset, L., Selgrade, M.K., and Vickers, C. (2008). Skin sensitization in chemical risk assessment: report of a WHO/IPCS international workshop focusing on dose–response assessment. Regulatory Toxicology and Pharmacology, 50, 155-162. Van Och, F.M.M. (1971). Assessment of the sensitizing potency of low molecular weight chemicals: employment of a regression method in vivo and in vitro. (Doctoral dissertation, Universiteit Utrecht, 1971). Utecht University Repository, 2003. Van Och, F.M.M., Van Loveren, H., De Jong, W.H., and Vandebriel, R.J. (2002). Cytokine production induced by low-molecular-weight chemicals as a function of the stimulation index in a modified local lymph node assay: an approach to discriminate contact sensitizers from respiratory sensitizers. Toxicology and Applied Pharmacology, 184, 46-56. Vandebriel, R., Cransveld, C.C., Crommelin, D., Diamant, Z., Galzenburg, B., Joos, G., Kuper, F., Natsch, A., Nijkamp, F., Noteborn, H., Pieters, R., Roberts, D., Roggen, E., Rorije, E., Seed, M., Sewald, K., Van del Huevel, R., Van Engelen, J., Verstraelen, S., and Van Loveren, H. (2011). Respiratory sensitization: advances in assessing the risk of respiratory inflammation and irritation. Toxicology in Vitro, 25, 1251-1258. Vandebriel, R.J., De Jong, W.H., Spiekstra, S.W., Van Dijk, M., Fluitman, A., Garssen, J., and Van Loveren, H. (2000). Assessment of preferential T-helper 1 or T-helper 2 induction by low molecular weight compounds using the local lymph node assay in conjunction with RT-PCR and ELISA for interferon-γ and interleukin-4. Toxicology and Applied Pharmacology, 162, 77-85. Vangosa, G.B., Braun, C.L.J., Cookman, G., Hofmann, T., Kimber, I., Loveless, S.E., Morrow, T., Pauluhn, J., Sorensen, T., and Niessen, H.J. (1994). Respiratory allergy: hazard identification and risk assessment. Fundamental and Applied Toxicology, 23, 145-158. Vanoirbeek, J.A.J., Madervelt, C., Cunningham, A.R., Hoet, P.H.M., Xu, H., Vanhooren, H.M., and Nemery, B. (2003). Validity of methods to predict the respiratory sensitizing potential of chemicals: a study with a piperidinyl chlorotriazine derivative that caused an outbreak of occupational asthma. Toxicological Sciences, 76, 338-346. Vanoirbeek, J.A.J., Tarkowski, M., Vanhoren, H.M., De Vooght, V., Nemery, B., and Hoet, P.H.M. (2006). Validation of a Mouse model of chemical-induced asthma 108 using trimellitic anhydride, a respiratory sensitizer, and dinitrochlorobenzene, a dermal sensitizer. Journal of Allergy and Clinical Immunology, 117(5), 1090-1097. Viola, A., Iezzi, G., and Lanzavecchia, A. (1999). The role of dendritic cells in T cell priming: the importance of being Professional. In M.T. Lotze and A.W. Thomson (Eds), Dendritic Cells. San Diego: Academic Press, pp. 251-255. Wang, B., Zhuang, L., Fujisawa, H., Shinder, G.A., Feliciani, C., and Shivji, G.M. (1999). Enhanced epidermal Langerhans cell migration in IL-10 knockout mice. The Journal of Immunology, 162, 277-283. Williams, I.R., and Kupper, T.S. (1996). Immunity at the surface: homeostatic mechanisms of the skin immune system. Life Sciences, 58(18), 1485-1507. Williams, W.C., Copeland, C., Boykin, E., Quell, S.J., and Lehmann, D.M. (2015). Development and utilization of an ex vivo bromodeoxyuridine local lymph node assay protocol for assessing potential chemical sensitizers. Journal of Applied Toxicology, 35, 29-40. Zeiss, C.R., Patterson, R., Pruzansky, J.J., Miller, M.M., Rosenberg, M., and Levitz, D. (1977). Trimellitic anhyride-induced airway syndromes: clinical and immunological studies. Journal of Allergy and Clinical Immunology, 60(2), 96-103. Zhang, X.D., Fedan, J.S., Lewis, D.M., and Siegel, P.D. (2004). Asthmalike biphasic airway responses in Brown Norway rats sensitized by dermal exposure to dry trimellitic anhydride powder. Journal of Allergy and Clinical Immunology, 113(2), 320-326. Zhu, J., and Paul, W.E. (2008). CD4 T cells: fates, functions and faults. Blood, 112(5), 1557-1569. 109 EKLER 110 EK-1. Hayvan deneyleri yerel etik kurul onayı 111 EK-1. (devam) Hayvan deneyleri yerel etik kurul onayı 112 ÖZGEÇMİŞ Kişisel Bilgiler Soyadı, adı : ELKAMA, Aylin Uyruğu : T.C. Doğum tarihi ve yeri : 03/07/1989 Ankara Medeni hali : Bekar Telefon : 0 (312) 202 23 82 e-posta : [email protected] Eğitim Derecesi Okul/Program Mezuniyet yılı Yüksek Lisans Gazi Üniversitesi/Farmasötik Toksikoloji Devam ediyor Lisans Gazi Üniversitesi/Eczacılık Fakültesi 2011 Lise Ankara Atatürk Anadolu Lisesi 2006 İş Deneyimi, Yıl Çalıştığı Yer Görev 2012 – devam ediyor Gazi Üniversitesi Yabancı Dili İngilizce Araştırma Görevlisi GAZİ GELECEKTİR...