maddenin tanecikli yapsı ve özellikleri ünitesi özet çalışma kâğıdı
advertisement

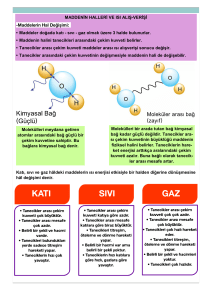
MADDENİN TANECİKLİ YAPSI VE ÖZELLİKLERİ ÜNİTESİ ÖZET ÇALIŞMA KÂĞIDI 1. PERİYODİK SİSTEM 1.1. 1 H Hidrojen 11 Na Sodyum 2 He Helyum 12 Mg Magnezyum 3 Li Lityum 13 Al Alüminyum 4 Be Berilyum 14 Si Silisyum 5 B Bor 15 P Fosfor 6 C Karbon 16 S Kükürt 7 N Azot 17 Cl Klor 8 O Oksijen 18 Ar Argon 9 F Flor 19 K Potasyum 10 Ne Neon 20 Ca Kalsiyum Demir Fe Kalay Sn Bakır Cu Platin Pt Alüminyum Al Cıva Hg Altın Au Kurşun Pb Gümüş Ag Krom Cr Çinko Zn Nikel Ni 1.2. Periyodik Cetvelin Özellikleri Periyodik cetvelde elementler artan atom numarasına göre sıralanmıştır. Benzer fiziksel ve kimyasal özelliklere sahip elementler alt alta sıralanmıştır. Periyodik cetvelde yatay sıralara periyot denir. Periyodik cetvelde 7 tane periyot vardır. Periyodik cetvelde düşey sütunlara grup denir. 8 tane A, 10 tane B olmak üzere 18 grup vardır. 1.3. Aynı periyotta soldan sağa gidildikçe; Atom numarası artar. Kütle numarası artar. Elektron verme eğilimi azalır. Metalik özellik azalır. Ametalik özellik artar. 1.4. Aynı grupta yukarıdan aşağıya doğru gidildikçe; Atom numarası artar. Kütle numarası artar. Elektron verme eğilimi artar. Metalik özellik azalır. Kimyasal özellikleri benzerdir. 1.5. Periyodik cetvelde 1A grubu elementlerine alkali metal, (H,Li,K,Na) 2A grubu elementlerine toprak alkali metal (Be,Mg,Ca) 7A grubu elementlerine halojenler, (F,Cl) 8A grubu elementlerine soygazlar(asal gazlar) denir. (He,Ne,Ar) 1.6. Metaller (-yum ile biten Li,Be,Na,Mg,Al,K,Ca) Normal koşullarda katı hâlde bulunur. Cıva sıvıdır. Parlak olduklarından ışığı yansıtır. Sert veya yumuşak olabilir. Tel, levha ve toz hâline gelebilir. Esnektir ve eğilip bükülebilir. Elektrik ve ısıyı iletir. 1A,2A ve 3A grupları metaldir. (Hidrojen hariç) 1.7. Ametaller(H,C,N,O,F,P,S,Cl) Katı sıvı ya da gaza halinde bulunabilirler Parlak değildir.Işığı iyi yansıtmaz. Çoğu yalıtkandır, ısıyı ve elektriği iyi iletmez. Esnek değildir. Tel ve levha hâline getirilemez. 1.8. Yarı Metaller ( B, Si) Normal şartlarda katı hâlde bulunur. Yüzeyleri parlak veya mat olabilir. Dövülerek işlenebilir. Metaller kadar iyi olmasa da elektriği iletebilir. 1.9. METAL Li,Be, Na,Mg,Al, K,Ca AMETAL H, C,N,O,F, P,S,Cl 2. KİMYASAL BAĞLAR 2.1. Baran İsmail AKTAŞ Yıldıztepe Ortaokulu Eyyübiye - ŞANLIURFA 2016 Y. METAL B, Si SOYGAZ He Ne Ar MADDENİN TANECİKLİ YAPSI VE ÖZELLİKLERİ ÜNİTESİ ÖZET ÇALIŞMA KÂĞIDI 2.2. Çok Atomlu İyonlar 3.3. Bir bileşikteki atom sayısı İyonun adı Formülü Amonyum NH4+ Hidroksit 0H- Nitrat N03- Karbonat C032- Sülfat SO42- Fosfat P043- FORMÜLÜ H2O CO2 Na2CO3 3SO2 2H2SO4 4Ca(OH)2 2.3. İYONİK BAĞ e- alışverişi ile gerçekleşir Anyon ile Katyon arasında görülür. + ve – nin çekim gücü vardır. Metal ile Ametal arasında gerçekleşir. (Bileşikte- yum varsa iyoniktir.) Oluşan bileşik iyoniktir. 2.4. KOVALENT BAĞ e- ortaklaşması ile gerçekleşir Anyon ile Anyon arasında görülür. Ametal ile Ametal arasında gerçekleşir. (Bileşikte- yum yoksa kovalenttir.) Oluşan bileşik molekülerdir. 3. KİMYASAL TEPKİMELER 3.1. Bileşik oluşturma Elementlerin iyon halleri yan yana yazılır. İyon yükleri işaretlere bakılmadan çapraz bir şekilde diğerinin altına yazılır. Örn : Ca+2 ile PO 4-3 Ca3(PO4)2 (Kalsiyum Fosfat) ADI 2 H +1 O = 3 ATOM 1 C + 2 O = 3 ATOM 2 Na + 1 C + 3 O = 6 ATOM 3 S + 6 O = 9 ATOM 4 H +2 S + 8 O = 14 ATOM 4 Ca + 8 O + 8 H = 20 ATOM 3.4. Tepkime denkleştirme Kimyasal denklemler denkleştirilirken önce hidrojen ve oksijen dışındaki elementler denkleştirilir. Daha sonra hidrojen ve oksijen elementleri eşitlenir. Reaksiyonlarda kütle korunacağı için girenler ve ürünlerdeki atomların sayılarının eşit olması gerekir bu eşitliği sağlamaya Denkleştirme denir. Girenler(Reaktifler) → Çıkanlar(Ürünler) H2 + O2 → H2O 2H2 + O2 → 2H2O ( Denkleştirilmiş Hali ), H2 + N2 3H2 + N2 → NH3 → 2NH3 ( Denkleştirilmiş Hali ) Kimyasal tepkimede değişmeyenler Kütle Atom sayısı ve cinsi Toplam proton ve elektron sayısı 3.5. Yanma tepkimeleri Tepkimelerin girenler kısmında O2 varsa yanma tepkimesidir. 3.2. Bazı Bileşiklerin adları BİLEŞİĞİN FORMÜLÜ H2O NaCl CO CO2 Na2CO3 SO2 H2SO4 HCl NaOH Ca(OH)2 NO2 BİLEŞİĞİN ADI Su Sodyum klorür Karbonmonoksit Karbondioksit Sodyum karbonat Kükürtdioksit Sülfürik asit Hidroklorik asit Sodyum hidroksit Kalsiyum hidroksit Azot dioksit 2 H2 + O2 → 2 H2O CH4 +2 O2 CO2 +2 H2O Yanma tepkimeleri iki çeşittir. Hızlı yanma (alevli) suyun oluşması Yavaş yanma (alevsiz) demirin paslanması Baran İsmail AKTAŞ Yıldıztepe Ortaokulu Eyyübiye - ŞANLIURFA 2016 MADDENİN TANECİKLİ YAPSI VE ÖZELLİKLERİ ÜNİTESİ ÖZET ÇALIŞMA KÂĞIDI 4. Asitler ve Bazlar 4.1. Asitler: Sulu çözeltilerinde ortama H+ iyonu veren maddelere Asit denir. Tatları ekşidir. Cildi tahriş ederler. Mermere zarar verirler. Sulu çözeltileri elektriği iletir. Turnusol kâğıdını kırmızıya çevirirler. 4.2. Bazlar: Sulu çözeltilerinde ortama OH- iyonu veren maddelere Baz denir. Tatları acıdır. Ele kayganlık hissi verirler. Cildi tahriş ederler. Sulu çözeltileri elektriği iletir. Turnusol kâğıdını maviye çevirirler. 4.3. Asit Mi Baz Mı ? H2SO4 Sülfirik Asit -----> Zaçyağı HCl Hidroklorik asit -----> Tuz ruhu HNO3 Nitrik asit -----> Kezzap CH3COOH -----> Asetik asit NaOH Sodyum Hidroksit-----> Sud kostik Ca(OH)2 Kalsiyum Hidroksit-----> Kireç KOH Potasyum Hidroksit-----> Potas Kostik NH3 (KURU BAZ ) -----> Amonyak 4.4. pH metre : Ph metre renklerden oluşan bir ölçektir. 14 birime ayrılmıştır.0-7 arası kırmızı renklerden, 7-14 arası ise mavi tonlu renklerden oluşur. Yani 0-7 arası asitleri gösterirken, 7-17 arası bazları gösterir. 7 ise ne asit ne bazı yani nötr özelliği simgeler. pH değeri; 0 a yaklaştıkça kuvvetli asit, 14 e yaklaştıkça kuvvetli baz olur. 4.5. Asit baz ayraçları : Bir maddenin asit mi baz mı olduğunu anlamamızı sağlayan maddelere ayraç (belirteç) denir. Belirteç Turnusol Kağıdı Metil Oranj Fenolftalein Asit Baz Kırmız Kırmız Renksiz Mavi Sarı Kırmızı / pembe 4.6. Nötralleşme tepkimesi: Asit ile Bazın tepkimeye girmesi ile Tuz ve su oluşturan tepkimelere denir. Asit + baz Tuz + Su HCl + NaOH NaCl + H2O 4.7. Asit yağmurları: Fosil yakıtların tüketimi ile havaya verilen NO2, CO2 , SO2 gazları su ile tepkimeye girerek nitrik asit, sülfürik asit ve karbonik asiti oluşturur. Bu asitlerin yeryüzüne yağmurlarla gelmesi ile asit yağmurları oluşur. Asit yağmurları; Metalleri aşındırır. Tarihi eserleri tahrip eder Ormanları tahrip eder Toprağı verimsizleştirir. 5. SU KİMYASI VE ARITIMI 5.1. İçerisinde Ca+2 ve Mg+2 iyonları çok fazla olan suya sert su denir. 5.2. Sert sular; Çamaşırları yıpratır. Deterjan ve elektriğin fazla harcanmasına neden olur. Banyo ve lavabo musluklarında tortular oluşturur. Rezistansların kireçlenmesine sebep olur. Kemik ve diş sağlığı için olumludur. 5.3. Sert sular 2 şekilde yumuşatılır. Kaynatma İyon değiştirici reçine kullanma 5.4. Kaynatılan sudaki Ca+2 ve Mg+2 iyonları tortu halinde kabın tabanına çöker. 5.5. İyon değiştirici reçinede sert sudaki Ca+2 ve Mg+2 iyonları, Na + iyonu ile yer değiştirilir. Böylelikle sert su yumuşatılır. 5.6. Suların mikroplardan arındırılmasına Dezenfektasyon denir. 5.7. En çok bilinen dezenfektasyon işlemi klorlamadır. 5.8. Metallerin paslanmasına korozyon denir. 5.9. Korozyondan korunmak için Galvanizleme Boyama Katodik koruma İşlemleri yapılabilir. Baran İsmail AKTAŞ Yıldıztepe Ortaokulu Eyyübiye - ŞANLIURFA 2016 SES ÜNİTESİ ÖZET ÇALIŞMA KÂĞIDI 1. SESİN ÖZELLİKLERİ 1.1. Ses, titreşen maddelerin etrafına yaydığı enerjidir. 1.2. Ses her yöne dalgalar halinde yayılır. 1.3. Sesin yayılması için maddesel ortam gerekir. Ses boşlukta yayılmaz. 1.4. Belli zaman diliminde belli bir hareketin tekrarlanmasına salınım denir. 1.5. 1 saniyedeki salım sayısına frekans denir. 1.6. 1 saniyede bir noktadan geçen ses dalgası sayısına sesin frekansı denir. Birimi Hertz’dir.“Hz” İle gösterilir. 1.7. Bir ses dalgasının tepe noktası ile çukur noktası arasındaki mesafenin yarısına genlik denir. 1.8. Sesin 3 özelliği vardır. Yüksekliği, şiddeti, tınısı. 1.9. Sesin yüksekliği, sesin frekansı ve sesin ince kalın olması demektir. 1.10. Yüksek ses=çok frekans(çok titreşim) = ince(tiz) ses 1.11. Düşük ses = az frekans(az titreşim) = kalın (pes) ses 1.12. Sesin genliği, sesin gürlüğü, sesin şiddeti, sesin düzeyi, sesin enerjisi, sesin duyulma mesafesi birbiri ile doğrudan ilişkilidir. 1.13. Genlik çok =gür ses =şiddetli ses = düzeyi çok ses = enerjisi çok ses = uzaktan duyulur. 1.14. Genlik az = gür olmayan ses =şiddeti az ses = düzeyi az ses = enerjisi az ses = uzaktan duyulmaz. 1.15. Frekansı 20000 Hz’den büyük sesleri insanlar duyamaz. Bu seslere ultrasonik ses denir. 1.16. Frekansı 20 Hz’den küçük sesleri insanlar duyamaz. Bu seslere infrasonik ses denir. 1.17. Ses şiddetinin birimi desibel’dir. dB ile gösterilir. 1.18. 60 dB den şiddetli seslere gürültü denir ve sağlığa zararlıdır. 1.19. Belli bir frekansta ses üreten cisimlere “Diyapazon” (ses çatalı)denir. Frekansı çok olan diyapazon ince ses, az olan ise kalın sese üretir. 1.20. Titreşen madde ÇOK ise ses KALIN çıkar. 1.21. Titreşen madde AZ ise ses İNCE çıkar. 1.22. Ses dalgasını ölçen aletlere osiloskop denir 1.23. Canlılar işitemeyeceği sesleri üretemezler 2. MÜZİK VE FEN 2.1. Müzik aletleri üç gruptur. Telli, vurmalı, üflemeli 2.2. Telli müzik aletlerinde sesin ince veya kalın olması, Telin cinsine, kalınlığına, uzunluğuna, gerginliğine bağlıdır. 2.3. Kalın tel = kalın (pes) ses, ince tel = ince(tiz) ses 2.4. Uzun tel = kalın (pes) ses, kısa tel = ince (tiz) ses 2.5. Az gergin tel = kalın (pes) ses, çok gergin tel = ince(tiz) ses 2.6. Vurmalı müzik aletlerinde sesin ince veya kalın olması, derinin cinsine, kalınlığına, yüzey alanına, gerginliğine bağlıdır. 2.7. Kalın deri = kalın (pes) ses, ince deri = ince(tiz) ses 2.8. Büyük deri = kalın ses, küçük deri = ince ses 2.9. Az gergin deri = kalın (pes) ses, çok gergin deri = ince(tiz) ses 2.10. Üflemeli müzik aletlerinde sesin ince veya kalın olması, müzik aletinin titreştirdiği havanın çokluğuna bağlıdır. 2.11. Çok boşluk = kalın(pes) ses, Az boşluk =ince(tiz)ses 2.12. Aynı nota farklı müzik aletlerinde çalınmasına karşın farklı sesler duyarız. Buna sesin tınısı denir. 2.13. Bütün müzik aletlerinde ortak kural; titreşen madde çok ise ses kalın, az ise ses incedir. 3. SES BİR ENERJİDİR 3.1. Ses bir enerjidir. Bunun kanıtları; yakından giden uçağın camları titreştirmesi, opera sanatçılarının bardağı kırması vb. 3.2. Ses dalgası kaynağında uzaklaştıkça enerjisinin bir kısmı ısı enerjisine dönüşür. Böylelikle duyulmaz. 3.3. Ses kaynağından uzaklaştıkça genlik azalır. Ancak frekans değişmez. 4. SES Mİ HIZLI IŞIK MI? 4.1. Işık hızı = 300.000 km/s ile evrende ulaşılabilecek en yüksek hızdır. 4.2. Sesin havadaki hızı ortalama 340 m/s dir. 4.3. Işık boşlukta en yüksek hız ile yayılır. 4.4. Sesin yayılma hızına etki eden iki faktör vardır. Ortamın yoğunluğu ve sıcaklığı 4.5. Ses yoğun ortamda daha hızlı yayılır. Bunun için sesin hızı; katı > sıvı > gaz 4.6. Ses sıcak ortamlarda daha hızlı yayılır. Bunun için sesin hızı; sıcak > ılık > soğuk Baran İsmail AKTAŞ Yıldıztepe Ortaokulu Eyyübiye - ŞANLIURFA 2016 MADDENİN HALLERİ VE ISI ÜNİTESİ ÖZET ÇALIŞMA KÂĞIDI 1. ISI – SICAKLIK 1.1. Isı ile sıcaklık arasındaki farklar; Isı bir enerji çeşidi, sıcaklık ise bir ölçümdür. Isı toplam kinetik enerjisi, sıcaklık ise ortalama kinetik enerjinin bir ölçüsüdür. Isı, sıcaklığı yüksek olan bir maddeden düşük olan maddeye aktarılan enerji türüdür. Isı değişimi kalorimetre kabı ile sıcaklık değişimi termometre ile ölçülür. Isı birimi kalori (cal) veya Joule, sıcaklık birimi ise derecedir. Isı, madde miktarına bağlıdır, sıcaklık ise madde miktarında bağlı değildir. 1.2. Isı alış-verişi yapan iki maddede Sıcak olan maddenin sıcaklığı düşer, soğuk olan maddenin sıcaklığı artar. Sıcak olan maddeler ısı kaybeder soğuk olan maddeler ısı kazanır. Isı alış-verişi aynı sıcaklığa ulaşıncaya kadar devam eder. Son sıcaklık iki maddenin sıcaklığının arasındadır. Alınan ısı verilen ısıya eşit olur. ( Dış ortamdan yalıtılmış olmalıdır.) Son sıcaklıkları aynı olunca arasında ısı alış-verişi gerçekleşmez. 1.3. Isı-Kütle-Sıcaklık ilişkisi Özdeş ısıtıcılarla ısıtılan iki maddenin aldığı ısı, madde miktarına bağlı değildir. Özdeş ısıtıcılarla aynı cins miktarları farklı iki sıvı ısıtıldığında, miktarı az olanın sıcaklığı daha çok artar. Miktarı fazla olanın sıcaklığı az artar. Not: Aynı cins maddeler özdeş ısıtıcılarla ısıtıldığında kütle ve sıcaklık artışı ters orantılıdır Sıcaklık: Bir maddenin taneciklerinin sahip olduğu hareket enerjisinin ortalamasıdır. Sıcaklık bir enerji değildir. Sıcaklığın ölçülmesi: Sıcaklık ölçen araç termometredir. Termometre içinde sıcaklıkla genleşen sıvı bulunmaktadır. 1.4. Termometre Yapısı Nasıldır? Termometre içinde genellikle cıva veya alkol kullanılır. Alkolün görünebilmesi için kırmızı renklendirilir. Alkolden yapılmış termometreler çok yüksek sıcaklıkları ölçemez, çünkü alkolün kaynama noktası 78 ºC’ dir. Yüksek sıcaklıklarda patlayacaktır. Termometre içindeki sıvının Donma sıcaklığının düşük ve kaynama sıcaklığının yüksek olması gerekir. Aldıkları ısı ile genleşmesinin orantılı olması gerekir. 2. Enerji Dönüşümü ve Öz Isı 2.1. Enerji dönüşümü: Enerjiler birbirine dönüşür, fakat yok olmazlar. Fırında, ütüde elektrik enerjisi ısı enerjisine dönüşür. Elimizi birbirine sürttüğümüzde mekanik enerji ısı enerjisine dönüşür. Enerji dönüşümleri %100 gerçekleşmez, bazı kayıplar gerçekleşir. Elektrik enerjisi ampulde ışık enerjisine dönüşürken, bir kısım enerjide ısı enerjisine dönüşür. 2.2. Öz ısı: 1g maddenin sıcaklığını 1°C artırmak için verilmesi gereken ısı miktarına öz ısı denir. Birimi j/g°C veya cal/g°C dir. Sembolü ‘c’ ile gösterilir.Öz ısı maddenin ayırt edici özelliklerinden biridir. Her maddenin öz ısısı farklıdır. 2.3. Kalori/joule 1 cal = 4,18 J dür.1 gram suyun sıcaklığını 1°C artırabilmek için 1 Kalori ısı vermek gerekir. 2.4. Formül (sıcaklık değişimi varsa) Q = m. c. Δt Q=ısı ,m = kütle, c=özısı, Δt= sıcaklık değişimi Q ile m doğru orantılıdır. (c ile Δt sabit iken) Q ile c doğru orantılıdır. (m ile Δt sabit iken) Q ile Δt doğru orantılıdır. (c ile m sabit iken) m ile Δt ters orantılıdır. (c ile Q sabit iken) m ile c ters orantılıdır. (Q ile Δt sabit iken) c ile Δt ters orantılıdır. (m ile Q sabit iken) 3. Maddenin Halleri ve Isı Alış Verişi 3.1. Maddenin Katı hali Maddenin sıcaklığı azdır Taneciklerin titreşim enerjisi de azdır Tanecikler arası çekim kuvveti fazladır. Belli bir hacmi ve şekli vardır. 3.2. Maddenin Sıvı hali Sıcaklık katı haline göre artmıştır, Titreşim enerjisi katı haline göre artar, Taneciklerin arasındaki çekim kuvveti zayıflar Tanecikler kendi aralarında serbestçe hareket etmeye başlar. Belli bir hacimleri vardır, ancak belli bir şekilleri yoktur. 3.3. Maddenin Gaz hali Sıcaklık sıvı haline göre daha fazladır. Titreşim enerjinin çok fazladır Tanecikler birbirinden bağımsızıdr. Taneciklerin arasındaki çekim kuvveti en azdır. Belli bir hacimleri de yoktur, belli bir şekilleri de yoktur. Baran İsmail AKTAŞ Yıldıztepe Ortaokulu Eyyübiye - ŞANLIURFA 2016 MADDENİN HALLERİ VE ISI ÜNİTESİ ÖZET ÇALIŞMA KÂĞIDI Katı Sıvı Gaz Tanecikler arası çek. kuvveti Fazla Orta Az Tanecikler arası mesafe Az Orta Fazla Taneciklerin har. enerjisi Az Orta Fazla Titreşim hareketi Var Var Var Öteleme hareketi Yok Var Var Belli hacim Var Var Yok Belli şekil Var Yok Yok 4. Erime – Donma ve Buharlaşma – Yoğuşma Isısı 4.1. Erime ısısı Erime: Maddenin ısı alarak katı halden sıvı hale geçmesine erime denir. Erime sıcaklığı: Erimenin başladığı sıcaklıktır. Erime ısısı: Erime sıcaklığındaki 1g maddenin katı halden sıvı hale geçmesi için gereken ısı miktarıdır. Erime ısısı Le ile gösterilir. Birimi j/g dır. Erime sıcaklığına gelen madde ısı almasına rağmen sıcaklığında bir artış meydana gelmez. Alınan ısı hal değişimi için kullanılır. Taneciklerin arasındaki bağ koparılır. Erime ısısı maddenin ayırt edici özelliğidir. Farklı maddelerin erime ısıları da farklıdır. Formül Q=m.Le Q: Verilen ısı, m: Kütle, Le: Erime ısısı Saf maddelerin erime ve donma sıcaklıkları sabittir. Saf maddelerin içerisine yabancı madde ilave edildiğinde erime ve donma sıcaklığı düşer. Suyun içerisine tuz ilave edildiğinde donma sıcaklığı 0°C nin altına düşer. Suyun içindeki tuz oranı ne kadar fazla ise donma sıcaklığı da o kadar düşük olur. Kışın meyve-sebze hallerinde, meyve ve sebzelerin donmasını engellemek için su dolu kaplar bırakılır. Su donarken etrafa ısı vereceğinden ortamın aşırı soğuması engellenmiş olur. 4.2. . Donma ısısı Donma: Maddenin ısı vererek sıvı halden katı hale geçmesine denir. Donma sıcaklığı: Maddenin katılaşmaya başladığı sıcaklıktır. Donma ısısı: Donma sıcaklığındaki 1g saf sıvının katı hale geçmesi için çevreye verdiği ısıdır. Donma ısısı Ld ile gösterilir. Bir madde erime ve donma sıcaklıkları aynıdır. Bir maddenin erime ve donma ısıları aynıdır. (Le=Ld) Formül 4.3. Buharlaşma ısısı Buharlaşma: Maddenin ısı alarak sıvı halden gaz hale geçmesine denir. Buharlaşma her sıcaklıkta olur. Kaynama: Sıvının içerisinde gaz kabarcıklarının oluşmasıdır. Kaynama hızlı buharlaşmadır. Kaynama sıcaklığı: Sıvının kaynamaya başladığı sıcaklıktır. Buharlaşma ısısı: Kaynama sıcaklığındaki 1g sıvıyı gaz haline geçirmek için gerekli ısıdır. Buharlaşma ısısı Lb ile gösterilir. Formül Q=m.Lb Q: gereken ısı m: Kütle Lb: Buharlaşma ısısı Buharlaşma olayının görüldüğü yerlerde soğuma görülür. Elimize dökülen kolonya, elimizde serinlik hissetmemizi sağlar. Kolonya buharlaşırken ısıyı elimizden alır. Toprak testinin suyu serin tutması, kesilen karpuzun güneş altında soğuması, ıslak başımızla dışarı çıktığımızda üşümemiz buharlaşma nedeni ile olur. Saf maddelerin kaynama sıcaklığı sabittir. Saf maddelerin içerisine yabancı madde ilave edildiğinde kaynama sıcaklığı yükselir. Su içerisine tuz ilave edildiğinde, tuz oranına bağlı olarak suyun kaynama sıcaklığı 100°C nin üzerine çıkar. 4.4. Yoğuşma ısısı Yoğuşma: Gaz halindeki bir maddenin çevreye ısı vererek sıvı hale geçmesine denir. Yoğuşma sıcaklığı: Yoğuşma olayının başladığı sıcaklıktır. Yoğuşma ısısı: Kaynama sıcaklığındaki 1g gaz halindeki maddenin sıvı hale geçerken verdiği ısıdır. Yoğuşma ısısı Ly ile gösterilir. Buharlaşma ısısı yoğuşma ısısına eşittir. (Lb=Ly) Formül Q=m.Ly Q: Yoğuşurken verdiği ısı m: Kütle Ly: Yoğuşma ısısı Not: Erime, buharlaşma, kaynama, süblimleşme olaylarında madde dışarıdan ısı alır. Donma, yoğuşma, kırağılaşma sırasında madde dışarıya ısı verir. Q=m.Ld Q: Çevreye verilen ısı m: Kütle Ld: Donma ısısı Baran İsmail AKTAŞ Yıldıztepe Ortaokulu Eyyübiye - ŞANLIURFA 2016 MADDENİN HALLERİ VE ISI ÜNİTESİ ÖZET ÇALIŞMA KÂĞIDI 5. Isınma ve Soğuma Eğrileri 5.1. Isınma eğrisi ve yorumları -10 °C bulunan buzun ısıtılması ile oluşan sıcaklıkzaman grafiği görülmektedir. A-B noktaları arasında buzdur(katı). Alınan ısı buzun sıcaklığını artırır. B-C noktaları arasında buz ve su (kat+ sıvı) karışımı vardır. Alınan ısı buzun erimesi (yani bağların kopması) için kullanılır. Sıcaklık sabittir. C-D noktaları arasında sudur(sıvı). Alınan ısı suyun sıcaklığını artırır. D-E noktaları arasında su ve buhar (sıvı+gaz)karışımıdır. Alınan ısı suyun buharlaşması (yani bağların kopması) için kullanılır. Sıcaklık sabittir E-F noktaları arasında buhardır(gaz). Alınan ısı buharın sıcaklığını artırmaktadır. Yukarıdaki grafiğe göre maddenin erime ve donma noktası ilk hal değiştirdiği sıcaklık olan 0oC’dir. Kaynama ve yoğuşma sıcaklığı ise ikinci hal değiştirdiği sıcaklık olan 100 oC’dir. Not: Saf maddeler( element ve bileşikler) hal değiştirirken sıcaklık sabit kalır. Eğer sıcaklıklarda bir değişim varsa o madde saf madde değildir. (Karışım) NOTLAR: 5.2. Soğuma eğrisi ve yorumları 110 °C de bulunan su buharının soğuması ile oluşan sıcaklık-zaman grafiği görülmektedir. E-F noktaları arasında buhardır. Buhar ısı kaybederek sıcaklığı azalmaktadır. D-E noktaları arasında su ve buhar (sıvı+gaz) karışımıdır. Kaybedilen ısı buharın yoğuşmasına (yani yeni bağların oluşmasına) neden olur. Sıcaklık sabittir. C-D noktaları arasında sudur(sıvı). Suyun kaybettiği ısı suyun sıcaklığını azaltır. B-C noktaları arasında buz ve su karışımı(sıvı+katı) vardır. Su ısı vererek donmaktadır(yani yeni bağların oluşmasına). Sıcaklık sabittir. A-B noktaları arasında buzdur (katı). Buzun sıcaklığı giderek azalmaktadır. Yukarıdaki grafiğe göre maddenin erime ve donma noktası ilk hal değiştirdiği sıcaklık olan 100 oC’dir. Kaynama ve yoğuşma sıcaklığı ise ikinci hal değiştirdiği sıcaklık olan 0oC’dir. Not: Saf maddeler( element ve bileşikler) en fazla iki defa hal değiştirirler. Eğer bir madde ikiden fazla hal değişimine uğrarsa o madde saf madde değildir. (karışım) NOTLAR: Baran İsmail AKTAŞ Yıldıztepe Ortaokulu Eyyübiye - ŞANLIURFA 2016 CANLILAR VE BESİN İLİŞKİLERİ ÜNİTESİ ÖZET ÇALIŞMA KÂĞIDI 1. BESİN ZİNCİRİ 1.1. Canlılar enerji ihtiyacı için besine ihtiyaç duyarlar. Bu besini de ya başka bir canlıdan elde eder. 1.2. Canlıların besin için birbirini yemeleri ile besin zincir oluşur. 1.3. Besin zinciri örnekleri; Bitki çekirge kurbağa yılan kartal Bitki koyun insan 1.4. Besin zincirinin ilk basamağı her zaman üreticiler oluşturur. 1.5. Üreticiler kendi besinin kendi üreten canlılardır. 1.6. Üreticilerle beslenen canlılar 1. Tüketicidir 1.7. 1.tüketicilerle beslenen canlılar 2. Tüketicidir. 1.8. 2.tüketicilerle beslenen canlılar 3. Tüketicidir. 1.9. Tüm canlıların ölü kalıntıları ile beslenen canlılar ayrıştırıcıdır(saprofit). 1.10. Besin piramidinde üreticiden tüketiciye doğru gidildikçe; Aktarılan enerji azalır. Aktarılan enerji oranı her basamakta % 10 dur. Birey sayısı azalır. Biyokütle azalır. Canlıların boyutlar büyür. Zehirli madde miktarı artar. 2. FOTOSENTEZ 2.1. Üreticiler besinlerini Fotosentez ile üretirler. 2.2. Üreticilerin ışık enerjisi ile CO2 ve H2O’yu kullanarak besin ve oksijen üretmesine fotosentez denir. 2.3. Fotosentez yapan canlılar; Bitkiler, siyano bakteriler, algler, öglena 2.4. Fotosentezin kimyasal formülü 2.5. Fotosentez için gerekli olan özellikler; CO2, H2O, klorofil, uygun sıcaklık ve ışık 2.6. Klorofil kloroplastta bulunur. Dolayısıyla fotosentez burada gerçekleşir. 2.7. Fotosentez için ışık gerekeli olduğu için doğal koşullarda üreticiler gündüzleri fotosentez yaparken, geceleri yapamazlar. 2.8. Bir bitkinin fotosentez yapıp yapmadığını anlamak için iyot çözeltisi kullanılır. Üretilen glikoz nişasta olarak depo edilir. İyot çözeltisi nişasta ayracıdır. İyot dökülen yaparak mavi-mor rengini alırsa orada nişasta ve dolayısıyla da fotosentez olduğunun ispatıdır. 3. ATP (ADENOZİNTRİFOSFSAT) 3.1. ATP : canlıların enerji birimidir. 3.2. ATP molekülündeki enerjinin büyük bir kısmı yüksek enerjili bağlarda depolanır. 3.3. ATP molekülünde bir fosfatın kopması sonucunda 7300 kalorilik enerji ve ısı açığa çıkar. 4. SOLUNUM 4.1. Glikozun hücrede enerjiye çevrilmesine solunum denir 4.2. Solunum Oksijenli ve oksijensiz olarak 2ye ayrılır. 4.3. Glikoz parçalanırken oksijen kullanılırsa Oksijenli solunum olur. 4.4. Oksijenli solunumun kimyasal denklemi; 4.5. Oksijenli solunum mitokondri bulunduran canlılarda mitokondride gerçekleşir diğerlerinde ise sitoplazmada gerçekleşir. 4.6. Not: oksijenli solunumun ürünleri fotosentezin girenleridir. Yani fotosentez ile oksijenli solunum birbirinin tersi olan kimyasal tepkimelerdir. 4.7. Oksijenli solunum sonucunda CO2 ortaya çıkar. Bir ortamda CO2 olduğunun kanıtı ise, kireçli sudur. Eğer ortamda CO2 varsa kireçli su bulanır. 4.8. Oksijensiz solunum (fermantasyon) iki çeşittir. Laktik asit fermantasyonu, Etil alkol fermantasyonu Baran İsmail AKTAŞ Yıldıztepe Ortaokulu Eyyübiye - ŞANLIURFA 2016