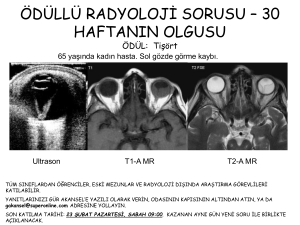
fotokoagülasyona yanıt vermeyen diyabetik diffüz maküla ödeminde
advertisement

1 T.C. Sağlık Bakanlığı Dr. Lütfi Kırdar Kartal Eğitim ve Araştırma Hastanesi 2. Göz Kliniği Klinik Şefi: Prof.Dr. Yusuf Özertürk FOTOKOAGÜLASYONA YANIT VERMEYEN DİYABETİK DİFFÜZ MAKÜLA ÖDEMİNDE İNTRAVİTREAL TRİAMSİNOLON ASETONİDİN ANATOMİK VE GÖRSEL PROGNOZA ETKİSİ DR. İBRAHİM ARİF KOYTAK UZMANLIK TEZİ İstanbul, 2005 2 ÖNSÖZ Uzmanlık eğitimim sırasında derin bilgi ve tecrübelerinden faydalandığım, eğitimimde büyük katkıları olan, iyi bir göz hekimi olarak yetişmem için gayret gösteren değerli hocam ve klinik şefim Prof.Dr. Yusuf Özertürk’e sonsuz saygı ve şükranlarımı sunarım. Uzmanlık eğitimimde ve göz cerrahisi pratiğini kazanmamda büyük katkıları olan, tezimin hazırlanmasında yardımlarını esirgemeyen şef yardımcımız Op.Dr. Anıl Kubaloğlu’na şükranlarımı sunarım. Eğitimim sırasında yardımlarını esirgemeyen, göz cerrahisini öğrenmemde büyük katkıları olan başasistanlarımız Op.Dr. Ekrem Kurnaz ve Op.Dr. Burak Özdemir’e teşekkürlerimi sunarım. Asistanlığım boyunca bilgi ve tecrübelerinden faydalandığım, her zaman desteklerini yanımda hissettiğim Op.Dr. Titap Yazıcıoğlu ve Op.Dr. Zeynep Eren’e teşekkürlerimi sunarım. Eğitimim boyunca pek çok şey paylaştığımız, asistanlığımı birlikte yapmaktan mutululuk duyduğum sevgili asistan arkadaşlarıma, kliniğimizde çalışan hemşire ve personelimize teşekkürlerimi sunarım. Tüm eğitim ve öğrenim hayatımda desteklerini yanımda hissettiğim aileme sonsuz minnet ve sevgilerimi sunarım. 3 ÖZET Amaç: Fotokoagülasyona dirençli diyabetik diffüz maküla ödeminde intravitreal kristalize kortizonun (triamsinolon asetonid) anatomik ve görsel prognoza etkisini araştırmak. Gereç ve Yöntem: Yaşları 52-75 arasında (ort: 64,3 ±5,9) değişen diyabetli 30 hastanın (18 kadın, 12 erkek) diffüz maküla ödemli 39 gözüne intravitreal 4 mg (0,1 ml) triamsinolon asetonid enjekte edildi. Olguların tümüne daha önce laser fotokoagülasyonu uygulanmıştı. Olgular fundus fluoresein anjiyografisi (FFA) ve görme keskinliği yönünden değerlendirildi. Bulgular: 39 olgunun 25’inin (% 64,1) FFA’sında 1. ay sonunda bariz düzelme izlenirken, 14’ünün (% 35,9) FFA’sında belirgin iyileşme gözlenmedi. Gözlerin birinci, üçüncü ve altıncı aylarda yapılan düzeltilmiş görme keskinliği ölçümleri sırasıyla ortalama 0,35 ±0,16; 0,38 ±0,18 ve 0,32 ±0,16 olarak bulundu. Düzeltilmiş görme keskinliklerinde birinci ayda ortalama 0,13 ±0,12; üçüncü ayda ortalama 0,17 ±0,12 ve altıncı ayda ortalama 0,11 ±0,11’lük artış izlendi. Tedavi öncesi ortalama 15,38 ±2,40 mmHg olan göz içi basınçlarında 1. ayda %24,2, üçüncü ayda %14,1, altıncı ayda %12,2’lik artış tespit edildi. Göz içi basıncı 21 mmHg’nın üzerine çıkan 12 olgu topikal monoterapi ile kontrol altına alındı. Sonuç: Laser fotokoagülasyona cevap vermeyen diyabetik diffüz maküla ödeminde intravitreal triamsinolon asetonidin geçici bir süre için de olsa, gerek anatomik, gerekse görsel düzelme sağlayan, tecrübeli hekimler için uygulaması kolay, maliyeti düşük ve komplikasyonları kabul edilebilir düzeyde bir tedavi yöntemi olduğu gözlendi. ANAHTAR KELİMELER: intravitreal triamsinolon, intravitreal kortikosteroid, diffüz maküla ödemi, diyabetik maküla ödemi 4 İÇİNDEKİLER Sayfa Önsöz i Özet ii 1. Giriş ve Amaç 1 2. Genel Bilgiler 5 2.1. Retina 5 2.1.1 Retina Embriyolojisi 5 2.1.2. Retina Anatomisi 6 2.1.3. Retinanın Topografik Anatomisi 9 2.1.4. Retinanın Kan Dolaşımı 11 2.1.5. Retinanın Fizyolojisi 13 2.2. Diyabetik Retinopati 15 2.2.1. Epidemiyoloji 15 2.2.2. Diyabetik Retinopati İçin Risk Faktörleri 16 2.2.3. Diyabetik Retinopatinin Patogenezi 17 2.2.4. Diyabetik Retinopatide Sınıflandırma 18 2.2.5. Diyabetik Retinopatinin Tedavisi 22 2.3. Diyabetik Maküla Ödemi 23 2.3.1. Semptomlar 24 2.3.2. Klinik Bulgular 24 2.3.3. Tanı 27 2.3.4. Diyabetik Maküla Ödeminde Tedavi 28 2.4. Kortikosteroidler 31 2.4.1. Maküla Ödeminin Tedavisinde Kortikosteroidler 2.4.2. Yan Etkiler 36 3. Gereç ve Yöntem 38 4. Bulgular 42 5. Tartışma 52 6. Sonuç 57 7. Kaynaklar 58 33 5 1. GİRİŞ VE AMAÇ Diyabetik retinopati (DRP) görme kayıplarının en önemli nedenlerinden biridir 1,2 . Diyabetik hastalardaki görme kaybının başlıca nedeni ise maküla ödemidir 3. Bu hastaların %29’unda 20 yıl veya daha uzun süre sonunda maküla ödemi geliştiği gözlenmiştir. Maküla ödemi gelişen hastaların 2 yıllık takipleri sonucunda vakaların yarıdan fazlasında iki veya daha fazla sıra görme kaybı tespit edilmiştir. Erken Tedavili Diyabetik Retinopati Çalışması’nda (The Early Treatment Diabetic Retinopathy Study, ETDRS) klinik olarak belirgin maküla ödeminde fokal laser fotokoagülasyonun faydalı olduğu belirtilmiştir 1. Ne var ki zamanında laser fotokoagülasyon uygulanan hastaların dahi %12’sinde 3 yıllık gözlem sonucunda ETDRS ölçeğine göre 15 harflik görme kaybı tespit edilmiş; öte yandan hastaların ancak %3’lük kısmında 15 harflik görme artışı izlenmiştir. Aynı zamanda, laser tedavisi uygulanan gözlerin %24’ünde 36 aylık takip sonrasında maküla merkezini içine alacak şekilde retina kalınlaşması gözlenmiştir. Tüm bunlar diyabetik maküla ödemi (DMÖ) gelişen gözlerin bir bölümünün laser fotokoagülasyon tedavisine dirençli olduğunu göstermektedir. Diffüz maküla ödemi arka retina kapiller yatağının büyük bölümünden yaygın sızıntılar, nadir sert eksüdalar ve kistoid boşlukların oluşumu ile karakterizedir 4. ETDRS çalışmasında klinik olarak belirgin maküla ödemi vakalarında faydalı olduğu bildirilen laser fotokoagülasyon tedavisinin diffüz maküla ödemi bulunan gözlerde ancak sınırlı fayda sağladığı başka çalışmalarla kanıtlanmıştır 2,4,5. Lee ve Olk, grid laser tedavisi ile diffüz DMÖ vakalarının %68 ila %94’ünde iyileşme sağlandığını, görme keskinliğinin %61 vakada stabilize olduğunu bildirmişlerdir 5. Aynı serideki gözlerin %24,6’sında görme keskinliğinin 3 veya daha fazla sıra gerilediği bildirilmiştir. Laser fotokoagülasyon tedavisinin çok sayıda dirençli vakada yarar sağlamadığının anlaşılması ilgiyi alternatif tedavi yöntemlerine yöneltmiştir. Üzerinde durulan yöntemler arasında cerrahi tedavi olarak pars plana vitrektomi 6, medikal tedavi olarak ise protein kinaz C inhibitörleri ve yavaş salınımlı intravitreal kortikosteroid implantları sayılabilir. 6 Triamsinolon asetonid kistoid maküla ödeminin tedavisinde perioküler enjeksiyon tarzında lokal olarak kullanılmaktadır 7. İntravitreal kortikosteroidler aynı zamanda proliferatif vitreoretinopatilerin koroid neovaskülarizasyonlarının 11 8,9 , retinal neovaskülarizasyonların 10 ve tedavileri ve önlenmeleri için deneysel olarak kullanılmıştır. Çalışmamızın amacı laser fotokoagülasyona dirençli diyabetik diffüz maküla ödemli vakalarda intravitreal triamsinolon kullanımının görsel ve anatomik prognoza etkisini prospektif olarak araştırmaktır. 7 2. GENEL BİLGİLER 2.1. RETİNA 2.1.1 Retina Embriyolojisi 12,13 Retina, embriyolojik önbeynin bir uzantısı olan optik vezikülden gelişir. Optik çanağın dışta kalan, ince tabakası retina pigment epiteline dönüşürken, içteki kalın tabakası sensoriyel retina kompleksine dönüşür. Optik vezikül kendi üzerine katlandığı için retina hücreleri ile pigment epiteli tepe noktalarından yüz yüze gelirler ve aralarında sıkı bir bağlantı oluşmaz. Oluşan bu potansiyel boşluk tüm hayat boyunca kalır ve sıvı birikiminde retina altı boşluğu oluşturur. Embriyonik gelişimin birinci ayında nöroektodermal kökenli optik vezikül, yüzey ektoderme yaklaşır, kendi içine doğru çukurlaşır ve optik çanağa (ikincil optik vezikül) dönüşür. Optik vezikül beynin bir uzantısı olduğundan, optik vezikülün tabakaları beyin ile devamlılık gösterir. Optik çanağın iç tabakası, gelişmekte olan lens ile etkileşim içinde, gelişir ve kalın nöroepitel tabakasına dönüşür. Sürecin devamında bu tabakanın hücreleri gözün ışığı algılayan hücrelerine, yani fotoreseptörlere (koni ve basil hücreleri) ve nöron gövdelerine (bipolar ve gangliyon hücreleri) dönüşür. İkinci ayda retina pigment epiteli ile sensoriyel retina birbirlerine yaslanırlar ve boşluk kaybolur, fakat arada sıkı bir bağlantı oluşmaz. Aynı zamanda pigment epitelinde de pigment hücreleri belirmeye başlar. Üçüncü ayda sensoriyel retinada bipolar ve gangliyon hücreleri ortaya çıkar. Fotoreseptörlerin iç segmentleri beşinci ayda, dış segmentleri yedinci ayda ortaya çıkar. Retina damarları dördüncü aydan itibaren oluşmaya başlar ve periferik retinaya ulaşmaları dokuzuncu ayı bulur. Makülanın gelişimi nihai olarak doğumdan sonra dördüncü ayda tamamlanır. 2.1.2. Retina Anatomisi 13,14,15,16,17,18,19,20 Retina, sklera ve koroidden sonra, göz küresinin en içteki üçüncü gömleğidir. Ora serratada 0,1 mm, ekvatorda 0,2 mm, optik sinir yakınında 0,5 mm kalınlığı olan ince 8 saydam bir dokudur. İç yüzeyi vitreus yüzeyi ile temasta olup dış yüzeyi ise retina pigment epitelinden (RPE) retina içi mesafe denilen potansiyel bir boşluk ile ayrılmıştır. Retina, pigmentli pigment epiteliyle, saydam bir zar olan sensoriyel retinadan oluşmuştur. Arkada sinir lifi tabakası hariç bütün retina tabakaları optik sinir başında sonlanır. Periferde sensoriyel retina ora serrataya uzanır ve pars plana pigmentsiz siliyer epitel ile devam eder. Retina komşu pigment epiteli ve altındaki skleranın şeklini alsa bile pigment epiteline sadece iki bölgede, optik disk ve ora serratada sıkı yapışıklık gösterir. Diğer bölgelerde yapışıklık zayıftır. Pigment epiteliyle sensoriyel retina arasında anatomik bağ yoktur. Birbirlerine sadece yaslanmışlardır. Retina dekolmanı, santral seröz koryoretinopati gibi hastalıklarda sensoriyel retina pigment epitelinden ayrılır. Retina oftalmoskopi ve mikroskopik olarak incelenebilir. Oftalmoskopik olarak retina, arka kutup (maküla), ekvator ve ora serrata olarak üç bölgeye ayrılır. Mikroskobik olarak retinanın on katı vardır. 1. Retina pigment epiteli 2. Fotoreseptör tabakası 3. Dış limitans zarı 4. Dış nükleer tabaka 5. Dış pleksiform tabaka 6. İç nükleer tabaka 7. İç pleksiform tabaka 8. Gangliyon hücreleri katı 9. Sinir lifleri tabakası 10. İç limitans zarı 2.1.2.1. Retina pigment epiteli Retina pigment epiteli, tek sıralı, 4-6 milyon hücreden oluşmuştur. Bu hücreler koroidin Bruch zarına yapışık, küboid yapıda melanin pigmenti içeren hücrelerdir. Bu hücreler arasında zonula oklüdens denen sıkı bağlantılar vardır. Bu özelliğiyle ışığın koroide geçmesini engellerler. Bu bağlantılar suyun ve iyonların serbest geçişini engellediğinden sıvının subretinal alana pompalanması için metabolik enerji kullanılır. Hücreler arasındaki bağlantıların çok sıkı olması, retina damarlarıyla birlikte, pigment epitelinin ikinci kan-retina bariyerini oluşturmasına yol açar. 9 Pigment epiteli fotoreseptörlerin fonksiyonunu idame ettirmesindeki yaşamsal dokudur. Retina pigment epiteli hücreleri arasında, retinanın farklı bölgelerinde şekil ve boyut farklılıkları görülmektedir. Maküla bölgesindeki hücreler daha küçük çapta iken (10-14 mikron), periferde hücreler düz ve daha geniş çaptadır (60 mikron). Pigment epiteli hücreleri foveada, periferdekilere göre daha yüksek, dar ve pigmentlidirler. Bu nedenle fluoresein anjiografisinde fovea, koroid fluoresansının maskelenmesine bağlı olarak daha karanlık görülür. Fotoreseptör hücrelerinin yoğunluğu retinanın farklı bölgelerinde değişiklik göstermekle birlikte, ortalama her bir retina pigment epiteli hücresine karşılık 45 adet fotoreseptör hücresi bulunur. 2.1.2.2. Fotoreseptör tabakası Fotoreseptör hücreleri gözün kırıcı ortamı tarafından yönlendirilen görüntüyü nöral sinyallere çevirerek görme olayını başlatan özelleşmiş hücrelerdir. Retinada koniler ve basiller olmak üzere iki tip fotoreseptör hücresi vardır. Basiller karanlıkta, koniler aydınlıkta işlev yaparlar. Foveada hiç basil bulunmazken koniler en yüksek konsantrasyonu sahiptir. İnsan koni pigmentleri 419 nm (mavi), 531 nm (yeşil), 558 nm (kırmızı) olmak üzere ışık spektrumunun üç bölgesindeki fotonları maksimum olarak absorbe ederler. Koniler ışıkta renk ayırımı, aydınlıkta görme ve keskin görmeden sorumludur. Koniler horizontal ve bipolar hücrelerle olduğu kadar diğer basiller ve konilerle de sinaps yaparlar. Konilerin toplam sayısı yaklaşık 6,5 milyondur. Basil hücreleri foveoladan 0,5 mm uzaklıkta ortaya çıkarlar. 5-6 mm uzaklık, en yoğun oldukları bölgedir. Konilerin sayısında merkezden periferiye doğru hızlı bir düşüş gözlenir. Basiller konilerden daha dar ve uzun yapıdadırlar. Periferik retinada basillerin çapı 25 mikrondur. Basiller alacakaranlıkta ve karanlıkta görmeden sorumludurlar. Bir basilde ortalama 6.000-10.000 disk bulunur. Basil iki horizontal hücre dentriti ile bir ya da daha çok bipolar hücre dentriti ile sinaps yapmaya uyumludur. Retinada toplam basil sayısı yaklaşık 120 milyondur. Koni ve basil hücrelerinin dış segmentleri mukopolisakkarid bir örtüyle kaplıdır ve pigment epiteli ile temas halindedir. 2.1.2.3. Dış limitans zarı 10 Fotoreseptörlerin iç segmentleriyle Müller destek hücrelerinin dış uzantılarının aralarındaki bağdan oluşmuştur. Gerçek bir membran değildir. Koni ve basillerin dış ve iç segmentlerinin arasından geçer. Periferik retinada bu membran ora serrata pigment epiteli ile birleşir. 2.1.2.4. Dış nükleer tabaka Fotoreseptörlerin çekirdek ve sitoplazmalarının bulunduğu bölgedir. 2.1.2.5. Dış pleksiform tabaka Birinci nöron fotoreseptörler ile bipolar ve horizontal hücrelerin arasındaki sinapsların bulunduğu bölgedir. Normal retinada kalınlığı 2 mikron olmasına karşılık, fovea çukurluğunun kenarında clivusta 50 mikronu bulur. Foveada konilerin önünü serbest bırakmak için kenarlara çekilerek Henle katını oluştururlar. 2.1.2.6. İç nükleer tabaka İkinci nöron bipolar hücreleri, bağlantı hücreleri, amakrin ve yatay hücreler ile destek hücreleri Müller hücrelerinin çekirdeklerinin bulunduğu bölgedir. 2.1.2.7. İç pleksiform tabaka Foveolada bulunmayan iç pleksiform kat ikinci nöron bipolarlar ile üçüncü nöron gangliyonlar ve amakrin hücreleri arasındaki sinapsların bulunduğu bölgedir. 2.1.2.8. Gangliyon hücreleri katı Üçüncü nöron olan gangliyon hücreleri katıdır. İç pleksiform kat gibi, foveolada bulunmaz. Gangliyonlar, bipolarlar gibi iki çeşittirler. Merkezdekiler küçüktür ve dendritleri konilerle sinaps yapan bir bipolar hücreyle sinaps yapar. Periferidekiler daha büyüktürler ve birkaç bipolarla sinaps yaparlar. 2.1.2.9. Sinir lifleri tabakası Korpus genikulatum lateralede sonlanan 1,2 milyon dolayındaki gangliyon hücresi aksonları, sinir lifleri katını oluşturur. Burada ayrıca retina arter ve venleri, astrositler, mikrogliyal hücreler ile oligodendrositler de vardır. Retina beslenmesinde 11 rolü olan astrosit, mikrogliya ve oligodendrositler retinanın arter, ven ve kapillerleri çevresinde kümelenmişlerdir. 2.1.2.10. İç limitans zarı Retinanın en iç katı olan iç limitans zarı, retinayı vitreustan ayırır. Vitreus ile temas halinde olan iç yüzünün düzgün olmasına karşılık, dış yüzü Müller hücrelerinin uçlarından ötürü pürtüklüdür. Yazarların bir kısmına göre gerçek bir zardır. Diğerlerine göre de Müller hücrelerinin uçları tarafından oluşturulmuştur. 2.1.3. Retinanın Topografik Anatomisi Retina topografik olarak iki bölümde incelenir: Santral retina (maküla) ve periferik retina. 2.1.3.1. Maküla Santral retina ya da maküla bölgesi, histolojik olarak ganliyon hücre tabakasında en az iki nükleus tabakası içeren bölge şeklinde tanımlanır. Topografik olarak maküla 4 kısımdan oluşur. a) Fovea Fovea, santral retinanın iç, yani vitreusa bakan yüzünde hafif bir çöküklük veya ekskavasyonudur. Fovea, optik sinir başı merkezinin 4,0 mm temporalinde ve 0,8 mm aşağısında yaklaşık 1,5 mm çaplı alandır. Foveanın derinliği kişiden kişiye değişmekle birlikte, ortalama 0,25 mm’dir. Foveada ikinci ve üçüncü nöronların kenara doğru itilmesine bağlı olarak 22 derecelik bir çukurluk oluşur. Foveada sinir lifleri, ganglion hücreleri ve iç pleksiform tabakaları yoktur. Foveanın santral 0,57 mm çaplı bölgesi fotoreseptör olarak sadece konileri içerir. b) Foveola Foveola 350 mikron çaplı ve 150 mikron kalınlığında, yalnız konilerin yer aldığı fovea çukurluğudur. Avasküler foveola kapillerlerin oluşturduğu bir halka ile çevrelenir. Bu damarlar iç nükleer tabaka düzeyindedir ve 250-600 mikron genişliğindeki avasküler zonu oluştururlar. Foveola merkezinde çapı yaklaşık 150200 mikron olan ve en keskin görmeyi sağlayan umbo yer alır. 12 Fovealoda birinci ve ikinci nöronlar kenara itildiğinden dış pleksiform tabakadaki lifler, iç nükleer tabakayı oluşturan hücrelerin uzantıları ile sinaps yapmadan önce iç limitans membrana paralel seyrederler. c) Parafovea Parafovea foveayı çevreleyen, 0,5 mm genişliğindeki bölgedir. İç retina tabakasında, özellikle iç nükleer ve ganglion hücre tabakasında belirgin hücre artışı ile karakterizedir. Retinanın bu bölgesinde tabakalar regülerdir. 4-6 tabaka ganglion hücresi, 7-11 tabaka bipolar hücre içerir. Hücreler bu bölgenin periferinde sayı bakımından azalma gösterir. Her 100 mikronda yaklaşık 100 koni, komşu koniler arasındaki boşlukta ise bir tek basil bulunur. d) Perifovea Perifovea 1,5 mm genişliğindedir ve dış sınırı fovea merkezinden 2,75 mm uzaktadır. Çok sayıda ganglion hücre tabakası ve 6 bipolar hücre tabakası içerir. Burada her 100 mikronda ortalama 12 koni ve komşu koniler arasında iki rod hücresi bulunur. 2.1.3.2. Periferik retina Periferik retina yakın perifer ve uzak perifer olarak iki bölge halinde incelenmektedir. a) Ekvator Yakın perifer 1,5 mm genişliğinde perifovea ile ora serrata arasında ekvator olarak adlandırılan, yaklaşık 3 mm genişlikteki bölgedir. Vorteks venleri ekvatorda, saat 1, 5, 7 ve 11 kadranları hizasında konumlanmıştır. Üst nazal ve temporal vorteks venleri 7-8 mm, alt vorteks venleri 5-6 mm’lik mesafeden başlarlar. Gözün çevresi ekvatorda ortalama 72 mm, ora serratada 60 mm’dir. b) Ora serrata Uzak perifer, ekvator ile pars plana arasında, ora serrata olarak adlandırılan bölgedir. Ora serrata nöral retinanın sonlandığı, silyer cisim ile retinanın birleştiği yerdir. Ora serratada fotoreseptör yoktur. Burada retina pigment epiteli siliyer cisim epiteline, Bruch’s membranı pigment epiteli bazal membranına, Müller hücreleri pigmentsiz epitele, iç limitans membran ise pigmentsiz epitelin bazal membranına dönüşür. Genişliği temporalde 2 mm, nazalde 1 mm’dir. Limbustan ora serrataya uzaklığı temporalde 7 mm, nazalde 6 mm’dir. Ora serrata bölgesinde sensoriyel retina, 13 pigment epiteli ile birleşir ve retina altı sıvının pars planaya geçişi engellenir. Retina ora serratada 20-30 adet parmaksı uzantılar vererek testere dişi görünümü oluşturur. c) Pars plana Uzak periferin ikinci kısmı pars plana bölgesi olup, uç perifer bölgesi olarak da tanımlanmaktadır. Pars plana, retinanın ora serratası ile siliyer cismin pars pilikatası arasında bulunur. Siliyer cisim pars pilikata ve pars plana olarak iki kısımdan oluşur. Pars pilikata siliyaris, iris kökünden arkaya doğru uzanan yaklaşık 2,5 mm kalınlığındaki bölgedir. Siliyer cismin oblik ve dairesel uzanan kasları ve 70-80 adet siliyer uzantıları bulunur. Pars plana siliyaris, globun temporal ve nazal yarılarında farklı genişliklerde çepeçevre uzanan, siliyer cismin ikinci kısmıdır. Nazalde yaklaşık 3 mm, temporalde ise yaklaşık 4,5 mm genişliktedir. 2.1.4. Retinanın Kan Dolaşımı Gözün arteriyel beslenmesi internal karotid arterin ilk dalı olan oftalmik arter tarafından sağlanır. Oftalmik arterden çıkan retina santral arteri, retinanın iç 2/3’ündeki tabakaları besler. Retinanın dış 1/3’ü ise (retina pigment epiteli, fotoreseptörler) koroidden difüzyonla beslenir. Oftalmik arterin santral retina arterinden sonraki dalları olan kısa ve uzun arka siliyer arterler optik sinir etrafından globa girerler. Posterior koriokapillaris kısa arka siliyer arterlerden, anterior koriokapillaris ise uzun arka siliyer arterlerden ve ön siliyer arterlerden beslenir. Retinanın venöz drenajı santral retina veniyle sağlanır. Optik sinirden çıkan venöz drenaj direkt olarak kavernöz sinüse ulaşır. Koroidin venöz drenajı ise vorteks venleri ile üst ve alt oftalmik venler aracılığıyla kavernöz sinüste sonlanır. 2.1.4.1. Arterler Retina nöroserebral katı retina santral arterinden ve var olduğunda, siliyoretiniyen arterden beslenir. a) Retina santral arteri Oftalmik arterin dalı olan retina santral arteri, papilladan 1 cm uzaklıkta optik sinir içine girer. Papilla merkezinde ilk önce alt ve üst, sonra da temporal ve nazal dallara ayrılarak retinaya yayılır. Retina yüzeyinde sinir lifleri ve iç limitans zarı katında 14 seyreder. Retina santral arteri dallanmaları ikiye ayrılma şeklinde olur. Periferiye doğru arterler, arteriyol ve kapillerlere dönüşürler. b) Siliyoretiniyen arter Koroidden gelen, papilla çevresindeki Zinn arter çemberinden kaynaklanır. Papilla temporal kenarından çıkarak maküla bölgesini sular. Fluoresein anjiografisinde, retina arterlerinden önce, koroid ile beraber boyanır. Siliyoretiniyen arter, olguların ancak %6-20’sinde bulunur. 2.1.4.2. Venler Ora serratada venler, arterlere göre daha perifere kadar giderler. Ekvatordan itibaren arterlerle birlikte seyrederler ve papillada toplanarak retina santral venini oluştururlar. Arter ve venler sık sık çaprazlaşırlar. Çaprazlaşma bölgelerinde aynı kılıf içinde olduklarından arteriyosklerozda arter veni ezer (Gunn belirtisi). Retina santral veni, oftalmik vene, sonra da kavernöz sinüse dökülür. Venlerin çapı arterlere göre daha geniştir. Normalde arter çapının ven çapına oranı 2/3’tür. 2.1.4.3. Kapillerler Retina arteriyolleri ile venülleri arasında kapillerler bulunur. Koriyokapillerlerin duvarlarında geniş pencerelenmeler bulunmasına ve geçirgen olmalarına karşılık, retina kapillerlerinin duvarları sızdırmazdır. Retina pigment epiteli dış, retina kapillerleri de iç kan-retina bariyerini oluştururlar. Kapillerlerin bazal zarının içinde, birbirlerine zonula occludenslerle sıkıca yapışık endotel hücreleri, duvarlarında da, kasılmalarını sağlayan çizgisiz kas lifleri, perisitler vardır. Normalde perisit/endotel hücresi oranı 1/1’dir. Retina kapillerleri yüzeyel ve derin olmak üzere, iki ağ şeklindedirler. a) Yüzeyel kapillerler Retinanın sinir lifleri katındadırlar. b) Derin kapillerler İç nükleer ve dış pleksiform katların birleşme yerindedirler. Derin kapillerler, yüzeyel kapillerlerden kaynaklanırlar ve onlara, dikine gelen kapillerlerle bağlıdırlar. Dış 15 pleksiform kat, retina kapillerleriyle beslenen bölge ile koroidden beslenen katlar arasındadır. 2.1.4.4. Lenfatik damarlar Retinada lenfatik damar yoktur. 2.1.5. Retinanın Fizyolojisi 2.1.5.1. Görme Işığın görmeye dönüşmesi, retinadaki fotoreseptör hücrelerinin dış segmentlerindeki fotokimyasal reaksiyonların fotoelektriksel akıma dönüşerek bipolar ve gangliyon hücrelerinden geçmesi ve optik sinir yoluyla oksipital kortekse ulaşmasıyla gerçekleşir. Fotoreseptörlerin dış segmentlerindeki protein kökenli görme pigmentleri, iyonlara karşı selektif bariyer niteliğindeki çift katlı lipid ile sarılmışlardır. Basillerin görme pigmenti rodopsin, konilerinki ise opsindir. Basiller, bir foton ile dahi uyarılabildiklerinden karanlıkta görmeyi sağlarlar. Konilerin uyarılabilmesi için daha fazla ışığa gereksinmeleri vardır. Koniler, keskin görme ile renkli görmeyi gerçekleştirirler. Koniler üç farklı grupta toplanmışlardır. Her birinde, değişik dalga boyundaki ışıklara duyarlı görme pigmentleri bulunur. 419 nm dalga boyuna duyarlı koniler mavi, 531 nm’ye duyarlı koniler yeşil, 558 nm’ye duyarlı koniler ise kırmızı ışık ile uyarılırlar. Üç grup koninin aynı anda uyarılmasıyla renkli görme gerçekleşir. Bir veya daha fazla grup koninin bulunmaması, renk körlüğüne yol açar. a) Fotokimyasal reaksiyonlar Fotokimyasal reaksiyonların oluşmasında fotoreseptörlerin dış segmentinde bulunan A vitamini türevleri retinal (retinaldehit) ve retinol’ün (A vitamini alkol şekli) önemli rolü vardır. Bir foton, basil hücresinde rodopsinin beyazlaşmasına ve opsin+retinal’e dönüşmesine neden olur. Retinal, pigment epiteline geçerek retinol şekline girer. Kandan ve fotoreseptörlerden gelen retinol, karanlıkta fotoreseptörlere retinal şeklinde geri dönerek opsin ile birleşir ve pembe renkli rodopsini oluşturur. A vitamini, sentezi yapılamadığından, organizmaya besinlerle gelir. Karaciğerde depolanır ve kan yoluyla retina pigment epiteline ulaşır. 16 Fotokimyasal reaksiyonların gerçekleşebilmesi için fotoreseptörler ile pigment epitelinin sıkı temas halinde bulunmaları gereklidir. b) Fotoelektriksel akım Basillerdeki rodopsinin beyazlanması sonucu, siklik guanozin monofosfat’ın (cGMP) hidrolizasyonu ve kalsiyum (Ca2+) iyonunun etkisiyle plazma zarında sodyum iyonu (Na+) geçirgenliği azalır ve hücre zarında gelişen hiperpolarizasyon, fotoelektriksel akımın doğmasına neden olur. Fotoreseptörlerde başlayan elektriksel akım, sinapslarla bipolarlar ve gangliyonlardan geçerek optik sinir yoluyla oksipital kortekse ulaşır. 2.1.5.2. Retina pigment epiteli Fotoreseptör hücrelerin dış segmentlerini oluşturan diskler, tabanda sürekli yenilenirler, dışta pigment epiteline doğru kayarak ilerlerler ve uçta düşerek pigment epiteli tarafından fagosite edilirler. Fotoreseptörlerin artıkları, retina pigmentinden koriyokapillarise geçerek kan dolaşımı yoluyla gözü terk ederler. Herhangi bir nedenle koroide geçemeyen ve pigment epitelinde biriken artık maddeler, maküla dejeneresansına ve drusenlere neden olurlar. Retinitis pigmentosa gibi hastalıklarda da artıkların pigment epitelinde fagosite edilememesi, bunların fotoreseptörlerin arasında birikmelerine ve pigment epitelinde dejenerasyona yol açar. Retina pigment epiteli, retina damarlarıyla birlikte kan-retina bariyerini oluşturur. Pigment epiteli ayrıca, koriyokapillaristeki oksijeni fotoreseptörlere aktarır, görme pigmentini depolar ve fotoreseptörlerin tekrar yapılanmalarını sağlar. Pigment epitelindeki melanin, ışığın koroide ve göz dışına geçmesini engellemesi yanında, fotoreseptörlerdeki fotokimyasal reaksiyonlar sonucu açığa çıkan ısıyı emerek termostat görevini de yapar. Pigment epiteli, retina altı oluşan sıvıları emmesi, fotokimyasal reaksiyonlar ve metabolizma aktiviteleri nedeniyle sensoriyel retinaya yapışık kalır. Bu yapışıklıkta pigment epitelinin iç yüzündeki mikrovillozitelerin, fotoreseptörlerin dış segmentlerini sarmasının da rolü vardır. 17 2.2. DİYABETİK RETİNOPATİ Diyabetik retinopati (DRP) ve diyabetik maküla ödemi (DMÖ) diyabet hastalarında sıkça rastlanan, görme keskinliğinde ani ve ciddi kayıplara yol açan mikrovasküler komplikasyonlardır. DRP’nin ileri evreleri iskemiye sekonder retinada anormal yeni damar oluşumuyla karakterizedir. Yeni damar oluşumuna hipoksik retina dokusundan salınan büyüme faktörleri neden olur. Diyabetik retinopati sürecinin herhangi bir aşamasında diyabet hastalarında maküla bölgesindeki kalınlaşmayla karakterize diyabetik maküla ödemi de gelişebilir. Diyabetik maküla ödemi, geçirgenliği artmış dilate kapillerler ve mikroanevrizmalardan kaynaklanan sızıntılarla kan-retina bariyerinin bozulmasının sonucu olarak ortaya çıkar. DRP ve DMÖ’nin kontrolü için halihazırda geçerli olan strateji bu bozuklukların erken teşhisine ve kan şekeri düzeyinin sıkı kontrolüne dayanır. 2.2.1. Epidemiyoloji Tip 2 diyabet nüfusun yaşlanması ve obezitenin yaygınlaşması nedeniyle neredeyse bir epidemi haline gelmiştir. Diyabetik retinopati diyabetli hastalardaki görme kayıplarının başta gelen sebebidir. Diyabetin süresi uzadıkça diyabetik retinopati sıklığı da artmaktadır 21. Gelişmiş ülkelerde, diyabetik retinopati çalışan nüfustaki (20-74 yaş) körlük nedenleri arasında birinci sıradadır ve bir yılda gerçekleşen yeni körlük vakalarının %12’sinden sorumludur 22. Tip 1 diyabetli hastalarında 14 yıl içinde görme kaybı (görme keskinliğinin, iyi gören gözde 20/40 ve daha altına düşmesi) ve tam körlük oranları sırasıyla %12,7 ve %2,4 olarak bulunmuştur. Diyabetik maküla ödemi diyabetik retinopatinin sık rastlanan bir bulgusudur ve tip 2 diyabetli hastalardaki görme kaybının en önemli sebebidir. Diyabet tanısı olan ABD’li hastalar arasında, 10 yıllık süre içinde subklinik DMÖ ve klinik olarak belirgin DMÖ gelişme oranları sırasıyla %14 ve % 10 olarak bulunmuştur. DMÖ gelişen hastaların yaklaşık yarısının görme keskinliklerinde, iki yıl içinde iki veya daha fazla sıra kayıp olacağı öngörülmektedir. Retinopatinin henüz tam körlüğe yol açmadığı hastalarda bile, diyabete bağlı görme keskinliği azalması kişinin aktivitesini önemli ölçüde etkileyen, önemli bir 18 komplikasyondur. 40 yaşından büyük şehirli erişkinlerdeki ciddi görme kayıplarının üçüncü önemli nedeni diyabettir 21,23,24,25. 2.2.2. Diyabetik Retinopati İçin Risk Faktörleri Diyabetin süresi, en önemli faktördür. 30 yaşından önce diyabet tanısı konan hastalarda on yıl içinde diyabetik retinopati gelişme insidansı %50 iken, bu oran 30 yaşından sonra tanı alan hastalarda %90’a yükselmektedir. Diyabetin ortaya çıkmasından sonraki 5 yıl içinde ve püberte öncesinde diyabetik retinopati gelişimi son derece nadir olmakla birlikte, insüline bağımlı olmayan diyabetiklerin yaklaşık %5’inin ilk muayenelerinde diyabetik retinopati gözlenir 21. Diyabetin iyi metabolik kontrolü, sonuçta diyabetik retinopati gelişimini önlemese de, ortaya çıkışını bir süre geciktirebilmektedir. Diyabet komplikasyonlarının kötü metabolik kontrol ile ilgili olduğuna dair kanının giderek yaygınlaşması, kan glukoz düzeyinin normalleştirilmesi yolundaki çabaların yoğunlaştırılmasına yol açmıştır. Öte yandan, her türlü önlemle kan glukoz seviyeleri normal seviyelerde tutulabilen bazı hastalarda da birkaç ay içinde diyabetik retinopati gelişimi gözlenebilmektedir. Diyabetik retinopatinin gelişimini hızlandırıp, seyrini ağırlaştırabilen diğer bazı faktörler şunlardır: o Gebelik, zaman zaman proliferatif retinopatiye doğru hızlı bir ilerleyişe neden olmaktadır. Gebelik öncesinde diyabetin kötü kontrolü, gebeliğin erken dönemlerinde kontrolün hızlı biçimde sıkılaştırılması ve pre-eklampsi ile sıvı dengesizliği gibi faktörler gebelik esnasında retinopatinin kötüleşmesine zemin hazırlar. o Hipertansiyon, özellikle kontrol altında olmadığında, diyabetik retinopatinin hızlı ilerleyişi ile ilişkili bulunmuştur. Hipertansiyon hem tip 1, hem de tip 2 diyabet hastaları açısından önemli bir risk oluşturmaktadır. o Ağır renal hastalık, diyabetik retinopatinin ilerlemesini hızlandırabilmektedir. Buna karşılık, renal hastalığın, örneğin böbrek 19 nakli ile, tedavisi de retinopatide düzelmeye ve fotokoagülasyona daha iyi cevap alınmasına zemin hazırlayabilmektedir. o Diğer olumsuz faktörler arasında şişmanlık, hiperlipidemi, sigara ve anemi sayılabilir. 2.2.3. Diyabetik Retinopatinin Patogenezi Diyabetik retinopati, retinadaki prekapiller arteriyoller, kapillerler ve venülleri etkileyen bir mikroanjiyopatidir. Bununla birlikte daha büyük damarların tutulduğu da görülebilir. Retinopatide, hem mikrovasküler oklüzyona, hem de sızıntıya bağlı bulgular yer almaktadır. Diabetik retinopatiye ilişkin patolojik değişimlerin ortaya çıkmasında rol oynayan başlıca patolojik biyokimyasal mekanizmalar non-enzimatik glikozilasyon, oksidatif stres ve sorbitol yolu başlıkları altında açıklanmaktadır. 2.2.3.1. Non-enzimatik glikozilasyon Uzun süreli hiperglisemide glikoz, proteinlere kimyasal bakımdan nonenzimatik olarak yapışır ve bozulmaya dayanıklı bir takım maddelerin ortaya çıkmasına yol açar. Ketamin ve amodori ürünleri adını verdiğimiz proteinler, bir dizi reaksiyona uğrayarak ileri glikozilasyon ürünleri denilen AGE (Advanced Glycosylation Endproducts) ürünlerinin ortaya çıkmasına neden olur. Parçalanmaya dirençli AGE ürünleri bazal membranda albümin ve IgG birikimine neden olurlar. Non-enzimatik glikozilasyon hipergliseminin yüksekliğine ve devam süresine bağlı olarak gelişen yavaş bir reaksiyondur. Ara ürün olarak AGE ürünleri, sonuçta ise yarı ömrü uzun makromoleküller ortaya çıkar. Serbest radikal (kollajen DNA) oluşumunu arttırırlar. 2.2.3.2. Oksidatif stres Bu teoriye göre oksidatif stres sonucu ortaya çıkan serbest radikaller, proteinlerin çapraz bağlantılarını etkiler ve farklı aminoasit kalıntılarının ortaya çıkmasına neden olur. Proteinlerin non-enzimatik glikozilasyonları, artmış serbest radikal hassasiyeti ile birleşince protein davranışlarında farklılıklar oluşur. Sonuçta kanın şekilli elemanlarının aglütinasyon ve agregasyonlarında artış meydana gelir. Mikrotromboz oluşumları görülür. 2.2.3.3. Sorbitol yolu 20 Vücutta glukoz aldoz redüktaz enzimi ile sobitole, sorbitol ise sorbitol dehidrogenaz yardımıyla fruktoza dönüşür. Glukoz sorbitole dönüşürken NADPH kullanılır. Fazla glukoz varlığında NADPH fazla tüketilir ve myoinositol ortaya çıkar. Miyoinositol ise vasküler disfonksiyona neden olur. Fazla miktarda glukoz alındığında NADPH fazla miktarda tüketilir ve aşırı sorbitol ortaya çıkar. NADPH’ın aşırı tüketimi ve sorbitol birikimi, sorbitol dehidrogenazı etkisizleştirerek işlemin ikinci kısmını bloke eder ve fruktoza dönüşümü engellenir. Bunun sonucunda sorbitol daha da artar ve kısır bir döngü ortaya çıkar. Bu kısır döngünün sonucu aşırı sorbitol ve myoinositol birikimi ve NADPH tüketimi aracılığıyla yaygın vasküler disfonksiyondur 26. 2.2.4. Diyabetik Retinopatide Sınıflandırma Erken Tedavi Diyabetik Retinopati Çalışma Grubu’na (ETDRS) göre diyabetik retinopatinin sınıflandırılması şöyledir. 1. Non-proliferatif diyabetik retinopati a) Hafif-orta (background diyabetik retinopati) b) Orta-şiddetli (pre-proliferatif diyabetik retinopati) 2. Proliferatif diyabetik retinopati a) Erken b) Yüksek riskli 2.2.4.1 Non-proliferatif diyabetik retinopati a) Hafif-orta (background) diyabetik retinopati Erken dönem değişiklikleridir. Diyabetik retinopatideki göz dibi değişiklikleri diyabetik retinal mikroanjiopati sonucu gelişir ve bu erken evrede damar tıkanmaları, geç evrede ise fibrovasküler proliferasyon ve skar oluşumu ile özellik kazanır. Klinik olarak göz dibi değişikliklerine yol açan başlıca fizyopatolojik nedenler, iskemi yapan retina damar tıkanmaları ve artmış retina damar geçirgenliğidir. Diyabete bağlı vasküler hastalıklarda patolojik olay kapiller duvarında perisit kaybı ve bazal membran kalınlaşmasıdır. Retina damarlarının otoregülasyonu sonucu gelişen perfüzyon eksikliği, hipoksik bir durum oluşturur ve retina damarları genişleyerek akımı arttırır. 21 Diyabetik gözlerde hiperglisemiyi takiben mikrovasküler genişleme olur, bunu kapiller tıkanmalar ve mikroanevrizma oluşumları izler. Bu tip diabetik retinopatide görülen lezyonlar şunlardır: Mikroanevrizmalar Bu evrenin ilk belirtisi, kapiller tıkanma bölgeleri nedeniyle gelişen mikroanevrizmalardır. Mikroanevrizmalar, retina kapillerlerinden gelişir ve genellikle, tıkanmış kapillerlerin yoğunlaştığı bölgelerde bulunur. Bunlar yüzeysel ve derin retina kapiller sisteminde, hatta koroid dolaşımında bile ortaya çıkabilir. Mikroanevrizmalar 12-125 milimikron çapındadır; ancak 30 milimikron üstündekiler muayenede tespit edilebilir. 125 milimikrondan büyükleri hemaroji olarak kabul edilmelidir. Başlangıçta parlak kırmızı renktedirler; tıkanma ve hyalinizasyon sonucu sarı renk alırlar. Küçük anevrizmalar kapiller duvarda perisit kaybının yol açtığı zayıflık ve takiben duvarda keseleşme sonucu oluşurlar.Retinanın iç nükleer tabakasında yerleşmişlerdir. Genelde maküla temporalinde küçük, yuvarlak noktalar şeklinde göze çarparlar. FFA’da erken venöz evrede boyanırlar. İntraretinal Kanamalar Mikroanevrizma, kapiller ya da venüllerin yırtılması sonucu meydana gelir. Bunların şekilleri retinada yerleştikleri yere göre değişir. Dış pleksiform ve iç nükleer tabakalardaki kanamalar yuvarlak veya pençe şeklinde görülürken, yüzeysel sinir lifleri tabakasındakiler alev şeklindedir. Hemorajiler FFA’da hipofluoresans gösterir. Buna karşılık mikroanevrizmalar genellikle hiperfluoresandır. Retina içi kanamalar 6 hafta ila 4 ay arasında rezorbe olurlar. Fovea içindeki kanamalar görmeyi etkileyebilirler. Sert Eksüdalar Dış pleksiform tabakada bulunurlar ve parlak mum renginde veya sarı-beyaz renktedirler. Çizgi biçimli, kümeler halinde veya mikroanevrizmaları çevreleyen halkalar şeklinde (circinate) olurlar. Eksüda içeriği serum lipoproteinlerinden oluşur. Daha çok makülada toplanırlar ve retina kalınlaşması ile birlikte seyrederler. Sert eksüdalar kendiliklerinden veya laser fotokoagülasyon sonucu tekrar rezorbe olurlar ve makrofajlar tarafından fagosite edilirler. Kronik olarak sert 22 eksüdalar sert plaklara dönüşerek diskiform tip skar oluşturabilirler. Eksüdalar FFA’da boyayı maskelemez. Maküla Ödemi Non-proliferatif diyabetik retinopatideki görme kaybının en sık nedeni iken, tüm diyabetik retinopatililerde (non-proliferatif ve proliferatif) vitreus hemorojisi ile birlikte, en sık görme kaybı nedenidir 27,28 . İç kan-retina bariyerinin fonksiyon bozukluğu sonucu meydana gelir. Mikroanevrizmalardan, kapillerlerden ve İRMA’lardan sızan serum lipoproteinleri ve diğer plazma elamanları ekstrasellüler boşluklarda birikirler. Fluoresein sızması görülse de, maküla ödemi tanısı için biyomikroskopik olarak retina kalınlaşmasının izlenmesi gerekir. Maküla ödemi fokal, diffüz veya miks tipte olabilir 39-47. b) Orta-şiddetli (pre-proliferatif) diyabetik retinopati Hafif non-proliferatif diyabetik retinopatide görülen lezyonlara ek olarak atılmış pamuk görünümlü eksüda, venöz boncuklanma ve İRMA görülür. Ayrıca retina içi kanamalar dört kadranda görülür. Atılmış Pamuk Görünümlü Eksüda Sinir fibrillerindeki küçük infarktlardır. Arteriyollerdeki tıkanma sonucu aksoplazmik staz ve retina dokusunda şişme oluşur. Retina içi kanama Nokta pençe kanamalar hemorojik retina infarktlarının sonucudur ve arteriollerdeki tıkanmaya bağlı oluşur. Hemoraji ve atılmış pamuk görünümlü spotlar FFA’da boyayı maskeler. Venöz Boncuklanma Ven duvarında incelmeyle birlikte görülen fokal venöz dilatasyon alanlarıdır. Bu değişiklikler, kapiller non-perfüzyon ve retina iskemisiyle bağlantılı ve proliferatif retinopati ile ilgilidir. İntraretinal Mikrovasküler Anomaliler (İRMA) İRMA, hastalıklı kapiller yataktaki tüm patolojik değişiklikleri kapsar. Spesifik olarak hastalıklı arteriyol ve venüller arasındaki genişlemiş, kıvrımlı ve telanjiektazik kanallardır. Bunlar arterioller ve kapiller nonperfüzyon alanlarında 23 bulunur ve ince kanla dolu damarlar olarak görülür. FFA’da aşırı boya sızması göstermez. 2.2.4.2. Proliferatif diyabetik retinopati Başlıca belirtisi neovaskülarizasyondur. Bunlar retina ve optik diskten gelişen, retina yüzeyi veya vitreus içine doğru ilerleyen yeni damarlardır. Neovaskülarizasyon Non-proliferatif değişiklikler, arteriollerde nonperfüzyon ve anormal geçirgenlikle birlikte proliferatif retinopatiye dönüşür. Neovaskülarizasyon en sık orta periferik kapiller non-perfüzyon bölgesi ile bağlantılıdır ve en çok optik diskin 45 derece çevresinde, optik diskin üstünde görülür. Neovaskülarizasyon, disk üstünde veya optik diskin bir disk çapı içinde yerleşen yeni damarlardır. Retina kapillerinin tıkanıklığına bağlı olarak iç retina katlarının iskemisi sonucunda gelişir. İskemik retina dokusunun yeni damar oluşumuna stimüle eden anjiogenik bir madde salınımına yol açtığı ileri sürülmektedir. Başlangıçta endotelyal proliferasyonlar olarak ortaya çıkar, daha sonra internal limitan membrandaki defektlerden geçerek retina ile posterior vitreus korteksi arasındaki potansiyel düzleme uzanırlar. Beraberinde fibröz proliferasyon bulunduğunda traksiyonel retina dekolmanı gelişme riski taşırlar. Hemoraji Kanamalar vitreus jeli içine olduğu kadar, retrohyaloid boşluğa da olabilir 26,27 . Yeni damarlar, sıklıkla arka hyoloide yapışıktır ve retina yüzeyinde veya biraz önünde yerleşmiştir. Arka vitreusa yapışık olan yeni damarlar arka vitre dekolmanında kanarlar. Bu zayıf damarlar üstündeki vitreus traksiyonu kanamalarına yol açar. Bu kan, retina ve dekole arka hyoloid arasından akarak, retina önü veya subhyoloid kanama şeklini alır ve kayık şeklinde görülür. Arka hyoloid veya iç limitan membranın yırtılması ile kan vitreus içine girer. Bu kan zamanla rezorbe olur. Traksiyonel Retina Dekolmanı Optik diskteki neovaskülarizasyon veya retinanın diğer alanlarındaki neovaskülarizasyon ilerledikçe, yeni damarlara karışan fibröz proliferasyon meydana 24 gelir ve arka vitreus yüzüne yapışır. Proliferasyonun artmasıyla fibrovasküler kompleks diskten, özellikle temporal yöne doğru arkadlar boyunca ilerler; diski, üst ve alt arkadlar birleştirir. Eğer bu fibrovasküler kitle büzülürse ve en gergin vitreoretinal yapışıklıklar disk üstünde ise maküla diske doğru çekilir ve maküla dekolmanı gelişir. Fibrovasküler kitlenin proliferasyonu ve büzülmesi ile birlikte vitreus jelinin de büzülmesi, arka vitreus dekolmanda ilerlemeyle birlikte traksiyonel retina dekolmanına yol açar. Bu dekolman en sık maküla dışı bölgelerde görülür. 2.2.5. Diyabetik Retinopatinin Tedavisi Diyabetik retinopati tedavisinde en önemli ilke kan şekeri düzeyinin regülasyonu, metabolik kontrol, varsa diğer hastalıkların (hipertansiyon, kalp, böbrek, hiperlipidemi, her türlü enfeksiyonlar) tedavisi, fiziksel aktivite, düzenli yaşam ve hastanın diyabet konusunda bilinçlendirilmesidir. Başlangıç ve orta derecedeki nonproliferatif diyabetik retinopati olgularında belirli dönemlerde pupilla dilate edilerek fundus muayenesi yapılmalı; mikroanevrizma, hemoraji, sert eksüdalar ve varsa maküla ödemi aranarak kayda alınmalıdır. Hem şiddetli non-proliferatif diyabetik retinopati, hem de proliferatif diyabetik retinopatide rutin olarak fluoresein anjiografi (FFA) uygulanmalıdır. Tedavi gerektiren klinik olarak belirgin maküla ödemi durumlarında, tedaviden önce fluoresein anjiografi çekmek gereklidir. Tedaviden önce fluoresein anjiografi çekilmesinin amaçlarından biri tedavide daha konservatif kalmanın gerektiği ve perifoveal kapiller ağın perfüzyonunun iyi olmadığı durumların saptanmasıdır. Diğer amaç ise tedavi edilmesi gereken retina kalınlaşması ve ödem bölgelerinin daha iyi belirlenmesidir. 2.2.5.1. Laser fotokoagülasyon Fotokoagülasyonun temel prensibi iskemik alanların yakılması sonucu oluşan korioretinal sikatrizasyon ile perfüzyonun dengelenmesi ve yeni damar oluşumunun engellenmesidir. Fotokoagülasyon yöntemleri bulunmadan önce fokal ve diffüz maküla ödemi edilememiştir tedavisinde kullanılan medikal tedavilerin etkinliği tespit 27,34 . Fotokoagülasyon tedavisinin başlama zamanı klinik olarak anlamlı maküla ödeminin oluştuğu zamandır. Maküla merkezinin tehdit edilmediği 25 ödemlerde fotokoagülasyonun kontrol grubuna üstünlüğü gösterilmemiştir 39 . Bu olgularda yakın takip gerekir. Klinik olarak anlamlı maküla ödeminde, maküla merkezinin tehdit altında olduğu olgularda ve diffüz maküla ödeminde fotokoagülasyon endikasyonu mevcuttur. 2.2.5.2. Cerrahi tedavi Diyabetik retinopati komplikasyonlarının tedavisinde pars plana vitrektomi, ilk kez 1970 yılında Machemer tarafından başlatılmıştır. O tarihten beri tanı ve tedavi tekniklerinde belirgin ilerlemeler kaydedilmiş ve cerrahi endikasyonlar gelişmiştir. Diyabetik retinopatide vitrektominin amacı, retina anatomi ve fonksiyonunu düzeltebilmek için traksiyona neden olan güçlerin ortadan kaldırılmasıdır. Vitreoretinal cerrahi kararı hastanın görme derecesi, hastalığın ağırlığı, önceki fotokoagülasyon miktarı, diğer gözün görme derecesi ve stabilizasyonu, ağır postoperatif komplikasyon gelişme riski gibi faktörler değerlendirilerek alınmalıdır. 2.3. DİYABETİK MAKÜLA ÖDEMİ Gelişmiş toplumlarda bir yandan diyabetin görülme sıklığının giderek artması, diğer yandan da modern tedavi yöntemleriyle diyabetlilerin yaşam süresinin uzaması, diyabetik retinopati ve buna bağlı olarak diyabetik maküla ödemi görülme sıklığının artmasına neden olmuştur 40. Diyabetik hasta popülasyonunda diyabetik maküla ödemi prevalansı %10 olarak saptanmıştır. Bu oran diyabetin süresi ile doğrudan ilişkilidir ve 20 yıldan uzun süredir diyabeti olan kişiler arasında prevalans %25’e yükselmektedir. Diyabetik maküla ödemi görülme sıklığı, diyabetin başlangıç yaşıyla yakından ilişkilidir. 30 yaşından önce diyabet tanısı konmuş tip 1 diyabetli hastalarda 15 yaşından önce maküla ödemine rastlanmamıştır. Aynı hasta grubundan, 10 yıldır diyabeti bulunanlar arasında diyabetik maküla ödemi prevalansı %0,5 iken 20 yıldır diyabeti bulunanlar arasında bu oran %29’dur. Maküla ödemi genç başlangıçlı diyabetlilerde daha seyrek iken, erişkin başlangıçlı diyabetlilerde daha sıktır. Erişkin başlangıçlılardan insüline bağımlı olanlarda makülopati görülme ihtimali en yüksek olup tanı esnasında maküla ödemi %5 oranında görülür. İnsüline bağlı olmayan 26 diyabette maküla ödemi riski biraz daha düşüktür. Maküla ödemi non-proliferatif diyabetik retinopatide %3, pre-proliferatif diyabetik retinopati ve erken proliferatif retinopati safhasında %38, proliferatif retinopati aşamasında %71 oranında mevcuttur 27,28,38,50,51 . Diyabetik makülopati non-proliferatif diyabetik retinopatide en büyük görme kaybı nedeni iken tüm diyabetik retinopatililerde vitreus hemorajisi ile birlikte en sık görme kaybı nedenidir. 2.3.1. Semptomlar Diyabetik maküla ödeminin en belirgin semptomu görme keskinliğinde azalmadır. Görme keskinliği 10/10 ile parmak sayma derecesi arasında olabilir. Ancak, diyabetik maküla ödemi bulunan bir gözde, görme keskinliği ile ödemin şiddeti arasında her zaman paralellik bulunmaz. Klinik olarak anlamlı maküla ödemi bulunan gözlerin yaklaşık %20’sinde görme keskinliğinin 10/10 olduğu bildirilmiştir (ETDRS) 51. 2.3.2. Klinik Bulgular Diyabetik maküla ödeminin başlıca üç klinik belirtisi vardır: Retina kalınlaşması Sert eksüda birikintileri Fluoresein sızıntıları Maküla merkezinden itibaren bir disk çapı uzaklıktaki bir alanda yerleşmiş olan herhangi bir retina kalınlaşması veya sert eksüda oluşumları tek başına diyabetik maküla ödemi belirtisi sayılır. Ancak anjiografide saptanan her fluoresein sızıntısı, tek başına maküla ödemi bulgusu olarak kabul edilemez. Fluoresein sızıntıları, retina kalınlaşması veya sert eksüda oluşumlarına eşlik ettikleri takdirde maküla ödeminin klinik bir belirtisi olabilir. Maküla ödemi histopatolojik olarak iki formda gelişir: İç ya da dış kan-retina bariyerinin yıkılması sonucu retina katlarında sıvı birikimi Yaygın iskemi sonucunda o Geriye kalan kapillerlerin dilatasyonu ve permeabilite bozukluğu 27 o İskemi sonucu ortaya çıkan maddelerin yol açtığı retina ödemi Diyabetik maküla ödeminin üç farklı klinik şekli vardır. Bunlar; 1. Fokal maküla ödemi, 2. Diffüz maküla ödemi ve 3. Mikst tip maküla ödemidir 51. 2.3.2.1. Fokal maküla ödemi Maküla merkezinden itibaren bir disk çapı (1500 mikron) uzaklıktaki bir alanda yer alan herhangi bir retina kalınlaşması ya da sert eksüda oluşumları fokal diyabetik maküla ödemi olarak adlandırılır. Retina kalınlaşmasının lokalize olması ile diffüz formdan ayrılır. Başlıca mikroanevrizmalardan ve İRMA’lardan kaynaklanır; yani iç kan-retina bariyerinin yıkılması sonucu ortaya çıkar 27,28,31,40 . Fokal ödem alanı çevrede normal alanlarla çevrilidir. Bazen ödem bulunmayan alanlardan sert eksüdalarla ayrılır. Bu sert eksüdalar daire şeklinde dizilirlerse sirsine retinopati oluşur. Sirsine retinopatinin merkezinde her zaman yoğun sızıntı veren mikroanevrizma kümesi bulunur. Mikroanevrizmalardan sıvı ile birlikte sızan lipoprotein kristalleri retinanın dış pleksiform tabakada birikir. Bu izah tarzı sert eksüdaların neden pek çok olguda fovea çevresinde dairesel tarzda dizildiğini izah eder. Lipoprotein kristalleri bazen fotoreseptörler tabakasına doğru yayılır. Lipoprotein kristallerinin fotoreseptörler tabakasına yayıldığı olgularda prognoz yüz güldürücü değildir. Uzun süre fotoreseptörler tabakası arasında birikmiş olarak kalan lipoprotein kristalleri fotoreseptörler tabakasında fibrozise yol açar ki, bu olgularda prognoz en kötüdür. Sert eksüda birikimi kan lipid seviyesi yüksekliği gibi sistemik patolojilerle yakından ilgilidir 29,31,32,33,40 . Ayrıca kalınlaşmış arka hyaloidin fokal maküla ödemi gelişiminde etkisi de söz konusudur. Klinik uygulamada fokal bir ödemin şiddetini belirlemek ve tedavi kriterlerini daha kolay saptayabilmek amacıyla, ilk kez 1987 yılında “The Early Treatment Diabetic Retinopathy Study Research Group” (Erken Tedavi Diyabetik Retinopati Çalışma Grubu -ETDRS) tarafından “klinik olarak belirgin maküla ödemi” terimi tanımlanmıştır. Klinik olarak anlamlı maküla ödemi görme kaybı tehdidi taşıyan maküla ödemidir. Fokal tipteki bir diyabetik maküla ödeminin, klinik olarak belirgin 28 maküla ödemi olarak kabul edilebilmesi için, aşağıdaki üç kriterden birine uyması gerekmektedir: Foveal avasküler bölge merkezinde veya buranın en fazla 500 mikron uzağında retina kalınlaşmasına neden olan ödem. Foveal avasküler bölge merkezinde veya buranın en fazla 500 mikron uzağında, bitişiğindeki retinada kalınlaşmayla birlikte izlenen sert eksüdalar (retina kalınlaşması kaybolduktan sonra devam eden sert eksüdalar hariç). Herhangi bir bölümü foveal avasküler bölge merkezine bir disk mesafesi uzaklıkta olan, en az bir disk çapı büyüklükte alan ya da alanlarda retina kalınlaşması. Görüldüğü gibi üç kriterde de maküla ödeminin en tipik bulgusu olan retina kalınlaşması esas alınmıştır 17,27,34. 2.3.2.2. Diffüz maküla ödemi Maküla merkezini, yani foveal avasküler zonu da içine alan, iki veya daha fazla disk çapı büyüklükteki retina kalınlaşmaları diffüz diyabetik maküla ödemi olarak adlandırılır. Diffüz maküla ödemi fokal maküla ödemine göre çok daha kompleks bir problemdir. Aşağıda belirtilen şekilde gelişir: Perifoveal bölgedeki kapiller yatakta tıkanma geriye kalan vasküler yapılarda diffüz dilatasyon ve geçirgenlik artışına neden olur. Yani iç kan-retina bariyeri diffüz olarak yıkılır. Bu tıkanma alanları ve diffüz sızıntı FFA ile belirlenebilir 27, 41 . Dış kan-retina bariyerini oluşturan retina pigment epitelinden diffüz sızıntı meydana gelir. Görüntüleme yöntemlerindeki gelişmeler sayesinde gerek iç, gerek dış kan-retina bariyerinde ortaya çıkan diffüz permeabilite bozukluğu gösterilebilir 35,36. Kalınlaşmış arka hyaloidin sıvı akımı üzerindeki olumsuz etkisi ile hyaloid membranın makülaya uyguladığı gerek tanjansiyel, gerek vertikal traksiyon da diffüz maküla ödemi üzerinde etki yaratır 36,42,43,44. Diffüz maküla ödemli gözlerde sert eksüdalar ya hiç yoktur, ya da çok azdır. Ödem rezorbe olurken dahi sert eksüda gelişmez. Bu bulgu dış kan-retina bariyeri ile 29 iç kan-retina bariyerinin diffüz şekilde yıkıldığı hallerde su gibi küçük moleküllerin retinaya sızmalarına karşın, lipoproteinler gibi büyük moleküllerin retinaya sızamadıklarını gösterir. FFA’da geç dönemde göllenme gösteren kistoid aralıklar diffüz maküla ödeminde sık görülmelerine karşın fokal maküla ödeminde nadiren görülür. Diffüz maküla ödemi özellikleri aşağıda gösterilmiştir: Sert eksüdalar azdır ya da yoktur. Kistoid özellikler gösterebilir. Bilateraldir. Simetriktir. Her iki gözde aynı ciddiyetle seyreder. İki gözde de spontane rezorbe olabilir ve nedensiz olarak iki gözde birden nükseder. Diffüz maküla ödeminin oluşmasında, kaybolmasında ve nüksetmesinde bazı sistemik faktörler rol oynayabilirler (kardiyovasküler hastalıklar, sistemik ödematöz hastalıklar, böbrek yetmezliği, pre-eklampsi vb.) Bu şartlar altında sistemik patolojiler, diüretikler, diyaliz, kalp ilaçları ve antihipertansiflerle tedavi edildiğinde ödem bilateral olarak kaybolur 27,34,35,40,50,51. 2.3.3. Tanı Diyabetik maküla ödemi tanısında; Direkt ve indirekt oftalmoskopi, Makülayı merkez alan 30 derecelik renkli ve red-free fundus fotoğrafları, Fundus fluoresein anjiografisi Hruby lensi, 60 ya da 90 D’lik lensler veya Goldman üç aynalı kontakt lensi ile yapılan biyomikroskopi gibi yöntemler faydalıdır. Diyabetik maküla ödeminin en tipik özelliği olan retina kalınlaşmasını saptamada Goldman üç aynalı kontakt lensi ile yapılan kontakt lens biyomikroskopisi en hassas muayene yöntemidir. Şüpheli ya da diğer yöntemlerle herhangi bir bulgunun saptanamadığı olgularda bile, bu yöntemle retina kalınlaşması ve sert eksüda birikintilerini belirlemek ve yarık ışıkla kalınlaşmanın miktarı hakkında fikir sahibi olmak mümkündür. Bu nedenle maküla ödemini saptamada kontakt lens biyomikroskopisi temel muayene yöntemi olarak benimsenmelidir. Fundus fotoğrafında aşağıdaki bulgular izlenebilir: 30 İRMA Mikroanevrizmalar Venöz boncuklanma Sert ve yumuşak eksüdalar FFA aşağıdaki patolojiler hakkında bilgi verir: Fluoresein sızıntısı Kapiller kayıpları Kapiller dilatasyonlar Diyabetik maküla iskemisi ve buna bağlı gelişen iskemik ödemi, diğer maküla ödemi tiplerinden ayırt etmede fundus fluoresein anjiografisi tek muayene yöntemidir 27,45,50,51 . 2.3.4. Diyabetik Maküla Ödeminde Tedavi Klinik olarak belirgin maküla ödemi bulunmayan basit non-proliferatif (background) diyabetik retinopatili gözlere laser tedavisi yapılması gerekmez. Bununla birlikte, bu gözlerin her sene periyodik olarak muayene edilmesi ve hipertansiyon, anemi veya böbrek yetmezliği gibi eşlik eden faktörlerin mümkün olduğunca kontrol altına alınması gerekir. Fotokoagülasyon tedavisi bulunmadan önce fokal ve diffüz maküla ödemi tedavisinde kullanılan medikal tedavilerin etkinliği bulunamamıştır 27,34 . Ancak günümüzde geliştirilen fotokoagülasyon tedavilerinin etkinliğini artırmak için ilave tedbirlerin alınmasının yararlı olduğu bilinmektedir. Kan şekeri regüle edilmeli, HbA-1C seviyesi normale düşürülmelidir. Yoğun sert eksüdalarla gelişen eksüdatif makülopatilerde kan lipid seviyesini düşürmek progresyoun yavaşlatacağı gibi bu tedavinin fotokoagülasyon ile kombinasyonu daha yüz güldürücü sonuçlar verir. Diffüz maküla ödemli olgularda gerekli sistemik kontroller sağlanmadan yapılacak fotokoagülasyon tedavisi yeterli olmayabilir. Bu nedenle renal yetersizlik, hipertansiyon, kalp yetersizliği ve pre-eklampsi gibi hastalıklar tedavi edilmelidir 29,31,32,34,38,40,42. 31 2.3.4.1. Laser fotokoagülasyon Tedavinin görme kaybı riskini %50 oranında azalttığı bilindiğinden, klinik olarak belirgin maküla ödemi bulunan bütün gözlere, görme keskinliği seviyelerine bakılmaksızın laser fotokoagülasyon tedavisi düşünülmelidir. Tedavi öncesinde fluoresein anjiografinin uygulanması, alanın sınırlarının çizilmesi ve sızıntının yaygınlığının tespiti açısından faydalıdır. Bu tetkik aynı zamanda, kötü bir prognozla seyretmekte olan ve tedavi için kontrendikasyon teşkil eden, foveadaki kapiller perfüzyona kapanmış iskemik alanların ortaya çıkarılmasında da yardımcı olmaktadır. Erken Tedavi Diyabetik Retinopati Çalışma Grubu’na (ETDRS) göre laser tedavisi öncesinde dikkate alınması gereken kriterler şunlardır: Klinik olarak belirgin olmayan maküla ödemleri tedavi edilmeksizin izlenir. Foveal avasküler bölge merkezine 500 mikrondan uzak lezyonlarda izlem esnasında ödem artarsa ya da santrale doğru ilerleme olursa fotokoagülasyon kararı verilir. Klinik olarak belirgin maküla ödemlerinde santral tutulum söz konusuysa hiç zaman kaybetmeden fotokoagülasyon uygulanır. Aksi halde 3 yıl içinde 2 sıra görme kaybı oranı %35-45’tir. Eğer santral tutulum söz konusu değilse yine fotokoagülasyon kararı verilir. Ancak aşağıdaki durumlara dikkat edilir: o Lezyon foveal avasküler bölge merkezine 500 mikrondan uzaksa (merkezden 1 disk çapı mesafeye kadar alanda en az bir disk çapında retina kalınlaşması) fotokoagülasyon kararı verilir. Ancak acil değildir. o Kalınlaşma foveal avasküler bölge merkezinden 300-500 mikron mesafede olunca fotokoagülasyon perifoveal kapiller halkayı tahrip etmek riski taşır. Bu nedenle: Görme 0.5’in altındaysa fotokoagülasyon uygulanır. Tedavi kalan görmeyi tahrip etmeyecekse fotokoagülasyon uygulanır. Aksi halde takip edilir. Takip esnasında: Eğer görme daha azalırsa ya da, 32 İRMA Ödemde artma görülürse fotokoagülasyon kararı verilir. ve mikroanevrizmalardan diffüz sızıntılı alanlar gelişirse, fotokoagülasyona karar verilir 15,17,50,51. 2.3.4.2. Cerrahi tedavi Eksüdatif makülopati ile seyreden olgularda en ideal tedavi protokollerinden sonra dahi sert eksüdaların kaybolmadığı olgular vardır. Hatta maküla fotokoagülasyonlarının 6. haftasında makülada sıvı rezorbe olurken, sert eksüda miktarında bir artış söz konusu olabilir. Tedaviye dirençli olgularda eksüdatif makülopati tedavisinde üç ayrı cerrahi müdahale modelinden bahsedilmiştir. Maküladaki sert eksüdaların cerrahi eksizyonu denenmiştir fakat bu yöntemin etkinliğini destekleyici yayınlar ortaya çıkmamıştır 33,43. Kalınlaşmış arka hyaloid zarının gerek sıvı akışını engellemedeki rolü, gerek makülaya uyguladığı traksiyon, gerek fotokoagülasyonun başarısını engellediği düşüncesi ile vitrektomi ve arka hyaloid soyulması ameliyatları uygulanmıştır. Bu operasyonlar sonucunda görmede artış olmasa bile sert eksüdaların kaybolduğunu söyleyenlerin yanı sıra görmenin arttığını bildiren araştırmacılar vardır 41,42,44,46,47. Hyaloid membranda astrosit birikiminin engellenmesinin de ameliyatın başarısında bir faktör olduğu ileri sürülmüştür 44 . Bazı araştırıcılar, bu operasyonun kistoid maküla ödeminde dahi etkili olduğunu bildirmişlerdir. Ayrıca diyabetik maküla ödemi tedavisinde sadece vitreo-retinal ayrılmanın sağlanmasının diyabetik maküla ödeminin spontan gerilemesini sağlayacağı bildirilmiştir 49. Son cerrahi müdahale modeli hyaloid membran ile birlikte internal limitan membranın da soyulmasıdır. Bu araştırma 12 gözde gerçekleştirilmiştir. 16 aylık takipte maküla ödeminde artış ve epiretinal membran izlenmemiştir. Traksiyon güçlerinin serbestleştirilmesi ve fibröz astrositlerin proliferasyonunun engellenmesinin bu başarıyı sağladığı ileri sürülmüştür 36. Katarakt unutulmamalıdır. ameliyatlarının İntrakapsüler ve gebeliğin ameliyat maküla döneminde ödemini yoğun olarak artırdığı görülen makülopatide şiddetlenme, yeni teknolojilerle birlikte azalma gösterse bile bir tehdit 33 olarak varlığını sürdürmektedir. Bu nedenle katarakt ameliyatına karar verilecek olgularda maküla gözden geçirilmeli ve fotokoagülasyon kararı daha erken verilmelidir. Ayrıca diyabetik hamilelerde hamilelik döneminde retinopatinin hızlanacağı ve makülopati gelişeceği unutulmamalıdır. Retinopati hamileliği sonlandırmak için bir gerekçe oluşturmaz. Ancak hamileliğin başlangıcından itibaren doğum sonrası 6. aya kadar bayanlar 3’er aylık aralarla takip edilmeli, gerekirse fotokoagülasyon kararı verilmelidir 40. 2.4. KORTİKOSTEROİDLER Kortikosteroidler prostaglandin sentezini inhibe ederler. Bu etkilerini membran lipidlerinin araşidonik asite dönüşümünden sorumlu katalizör fosfolipaz A2 enzimini inhibe ederek gerçekleştirirler. Bu şekilde steroidler araşidonik asitlerden prostaglandin, prostaglandin endoperoksitleri, lökotrien ve tromboksan gibi inflamasyonun güçlü mediatörlerinin sentezlenmesini engellemiş olmaktadır 52. Lokal olarak vazokonstriktif özellikleri intraselüler ve ekstraselüler ödemin gerilemesini, makrofaj aktivitesinin baskılanmasını ve lemfokin üretiminin azalmasını sağlarlar. Steroidlerin lizozimlerden litik enzim salınmasını da baskıladığı bilinmektedir 53. Glukokortikoidlerin anti-inflamatuar özellikleri lenfositler, makrofajlar, polimorfonükleer lökositler, vasküler endotel hücreleri, fibroblastlar ve diğer hücreler üzerindeki, hücre tipine özel çeşitli etkilerine bağlıdır. Tüm bu hücrelerde steroidler; Hücre zarını geçebilmeli, Hücre içindeki çözünebilir reseptörlere bağlanabilmeli, Glukokortikoid reseptör kompleksinin nükleustaki bağlanma bölgelerine bağlanmasını sağlayacak bir konformasyon değişikliğine yol açabilmeli, Spesifik mesajcı ribonükleik asitlerin transkripsiyonunu artırıp, azaltabilmelidir. Göz içinde bu mRNA’ların kontrolü altında üretilen proteinler henüz bilinmemekte, yalnızca yol açtıkları etkiler tanımlanabilmektedir. Sebep ister travmatik (radyasyon, mekanik veya kimyasal), ister enfeksiyöz, ister immünolojik olsun, steroidler lokal hipertermi, vasküler konjesyon, ödem ve 34 ağrı gibi iltihabi reaksiyonun başlangıç bulgularını doku düzeyinde önler ya da azaltırlar. Steroidler aynı zamanda yeni damar oluşumu, fibroblastik aktivite, kollajen birikimi ve skar dokusu oluşumu gibi geç evre iltihabi reaksiyonları da baskılarlar. Glukokortikoidlerin immün kaynaklı inflamasyonun baskılanmasındaki rolü karmaşıktır. Glukokortikoidlerin allerjik reaksiyonlardan sorumlu IgE’nin, ya da otoimmün reaksiyonlardan sorumlu IgG’nin titreleri üzerinde bir etkisinin bulunmadığı bilinmektedir. Steroidlerin greft reddinde olduğu gibi, hücresel bağışıklığın afferent yolundaki doğal süreçler üzerinde de herhangi bir etkisi bulunmamaktadır. Steroidler göründüğü kadarıyla immün cevabın efferent yolunu etkilemektedir. Örneğin, makrofajların iltihap bölgesine göçlerini önlemektedirler. Sistemik yoldan verilen steroidler, hücresel bağışıklıktan sorumlu T-lenfositler başta olmak üzere, tüm lenfositlerin inflamasyon bölgesine göçünü baskılamaktadırlar. Bununla birlikte, bu etkilerin moleküler düzeydeki post-transkripsiyonel mekanizmaları henüz bilinmemektedir 54. Steroidler korneal greft reddinin baskılanmasında, ön segment cerrahisinden sonra ön kamara reaksiyonunun, filtrasyon blebinin skarlaşmasının, immün ve travmatik iritis veya üveitin önlenmesinde topikal olarak kullanılmaktadır. Ciddi göz inflamasyonlarının tedavisinde de retrobulbar ya da subkonjonktival steroid enjeksiyonları etkili olmaktadır. Steroidler dev hücreli arterit ve ciddi göz içi iltihaplarının tedavisinde ise sistemik olarak kullanılabilmektedir. Akut inflamatuar iskemik optik nöritin steroidlerle tedavisi hala tartışılan bir konu olup, araştırmaları devam etmektedir 54. 2.4.1. Maküla Ödeminin Tedavisinde Kortikosteroidler Kortikosteroidler maküla ödeminin tedavisinde topikal, oral, parenteral, perioküler ve intravitreal enjeksiyon olarak uygulanabilirler. Topikal kortikosteroidler kornea epitelini geçerek ön kamaraya ulaşabilirler. Pomad formları daha uzun süreli steroid salınımı sağlamakla birlikte, ön kamarada ulaşabildikleri konsantrasyon damla formlarına kıyasla daha düşüktür. Topikal kortikosteroidlerin anti-inflamatuar özellikleri özellikle kronik iritis veya iridosiklite bağlı maküla ödemlerinin tedavisinde etkili olabilmektedirler 53,55. Zaman zaman ara üveite bağlı kistoid maküla ödemleri de topikal kortikosteroidlere cevap verebilirler. Ayrıca topikal steroidlerle NSAİ ilaçların kombinasyonunun bu iki ilaçtan biriyle 35 yapılan monoterapiye göre daha etkili olduğuna dair kanıtlar mevcuttur 56. Topikal kortikosteroid kullanımının muhtemel yan etkileri arasında glokom, arka subkapsüler katarakt, enfeksiyonlar ve herpetik keratit nüksleri gösterilebilir. Perioküler steroid enjeksiyonları arka subtenon veya peribulbar yollardan yapılabilir. Daha az sistemik yan etkiyle, daha fazla miktarda ve yüksek konsantrasyonda ilaç uygulamasına ve uzun süreli ilaç salınımına imkan vermesi nedeniyle bu uygulama topikal yoldan daha avantajlıdır. Enjeksiyon bölgesinde uzun süreli maksimum düzeyde etki sağlarlar. Ne var ki, bu yöntemin glob perforasyonu, göz içi basıncı artışı ve katarakt gibi istenmeyen yan etkileri mevcuttur 57,58 . Perioküler enjeksiyon sonrasında steroidlerin göz içine daha çok sklerayı geçerek ulaştığı düşünülmektedir. McCartney ve arkadaşları subkonjonktival enjeksiyon sonrasında steroidlerin kullanmışlardır geçişini izlemek amacıyla otoradyografi yöntemini 59 . Bulgular inflamasyonlu gözlerdeki geçişin sağlam gözlere göre daha hızlı olduğunu göstermiştir. Bu nedenle steroid enjeksiyonlarının gelişigüzel bir yerden değil, inflamasyon bölgesine komşu bölgelerden yapılması önerilmektedir. Arka subtenon bölgeden yapılan enjeksiyonlar orbita tabanına, dolayısıyla maküla bölgesine daha yakın olduklarından, henüz bu iddiayı doğrulayacak veriler bulunmasa da, teorik olarak daha etkili olabilirler. Sistemik kortikosteroidler özellikle bilateral ve dirençli inflamatuar maküla ödemlerinin tedavisinde çok yararlı olmaktadırlar. Maküla ödemlerinin tedavisinde sistemik steroidlere inflamatuar süreci baskılamak için yüksek dozda başlayıp, daha sonra nüksleri önlemek amacıyla dozun yavaşça azaltılması gerekmektedir. Bazı vakalarda sistemik steroid kullanımıyla arka subtenon steroid enjeksiyonları kombine edilerek güçlendirilmiş etki elde edilebilir 55. Sistemik steroid kullanımını müteakip çok çeşitli potansiyel oküler ve sistemik yan etkiye sıkça rastlanmaktadır. Bunlar arasında peptik ülser, osteoporoz, diyabet ve hipertansiyon alevlenmeleri, Cushingoid görünüm ve adrenal bezin baskılanması sayılabilir. Bu ciddi sistemik yan etkiler nedeniyle oral steroidler dikkatle kullanılmalıdır. Uzun süreli, yüksek doz steroid kullanımı planlandığında istenmeyen etkileri en aza indirecek önlemler için mutlaka bir dahiliye uzmanından konsültasyon istenmelidir. Sistemik steroidlerin en yaygın kullanılan formu oral preparatlar olmakla birlikte, ciddi göz içi inflamasyonlarda ve kronik psödofakik kistoid maküla ödemlerinde yüksek doz intravenöz steroid kullanımının olumlu etkilerine dair, az 36 miktarda vakayı kapsayan bazı yayınlar da mevcuttur. Tehrani ve arkadaşları karşılaştırmalı olmayan bir çalışmalarında, üveitik kistoid maküla ödeminin tedavisinde derin intramüsküler metilprednisolon enjeksiyonunun etkisini araştırmışlardır. Yazarlar, sınırlı başarısına rağmen, bu uygulamanın hastaya çok az rahatsızlık verdiğini, oküler ve sistemik yan etkilerinin en az düzeyde olduğunu öne sürmüş ve üveite bağlı tek taraflı maküla ödemi bulunan hastalarda bu yöntemin, hasta uyumu sorununu ortadan kaldırdığı için oral kortikosteroidlere alternatif olabileceğini savunmuşlardır 52,60. Göz içi yavaş salınımlı kortikosteriod implantları, tekrarlanan perioküler ve sistemik steroid uygulamalarını tolere edemeyen ve takibi zor olan hastalar için umut verici bir tedavi yöntemi olarak yakın zamanda ortaya çıkmıştır. Bu materyallerin toksik olmadığı ve uzun süre boyunca göz içinde sabit ilaç konsantrasyonu sağladıkları insan ve deney hayvanı modelleri üzerinde gösterilmiştir. Jaffe ve arkadaşları ciddi üveitli 7 gözdeki (5 hasta) çalışmalarında 2 mg ve 15 mg fluosinolon asetonid içeren, biyodegradabl olmayan yavaş salınımlı materyalleri göz içine yerleştirmişlerdir. Ortalama 10 aylık takip süresi sonunda intraoküler inflamasyonun azalması, dolayısıyla anti-inflamatuar ilaç ihtiyacının azalması, görme keskinliğinin korunması ya da artması ve maküla ödeminin düzelmesi gibi olumlu etkiler gözlenmiştir. Ne var ki, materyalin yerleştirilmesi sırasında tüm gözlerde katarakt ekstraksiyonu da uygulanmış olmasından dolayı görme keskinliğindeki artış doğrudan fluosinolon asetonide bağlanamamaktadır. Bu tedavi yönteminin muhtemel komplikasyonları arasında regmatojen retina dekolmanı, vitre içi kanama, materyal kaçağı, endoftalmi, göz içi basıncı yükselmesi ve sütür açılması sayılabilir. Uzun dönemli takip sonuçlarının, fayda ve risklerinin daha doğru değerlendirilebilmesi amacıyla halihazırda A.B.D., Avrupa, Asya ve Avustralya’da büyük çaplı, kontrollü ve randomize çalışmalar yürütülmektedir 61,62,63,64. Yaşa bağlı maküla dejenerasyonu tedavisinde intravitreal kortikosteroidlerle elde edilen ümit verici sonuçlar, hekimleri aynı yöntemi kronik üveite bağlı dirençli maküla ödemi, son zamanlarda da diyabetik ve psödofakik maküla ödemi bulunan gözlerde de denemeye yöneltti. Young ve arkadaşlarının üveitik maküla ödemi bulunan 6 gözdeki, randomize olmayan, prospektif pilot çalışmasında tek seanslık 4 mg intravitreal triamsinolon asetat uygulamasıyla tüm hastalarda maküla ödeminin anjiografik olarak düzeldiği ve 3 aylık takip sonunda görme keskinliklerinde medyan 37 3 sıralık artış gözlendiği bildirilmiştir. Ne var ki, 12 ay sonunda gözlerin dördünde maküla ödemi tekrarlamış ve görme keskinliği enjeksiyon öncesi düzeye inmiş, diğer iki hastada ise gelişen katarakt nedeniyle makülanın durumu değerlendirilememiştir. Geleneksel yöntemlere yanıt vermeyen, uzun süren inflamatuar kistoid maküla ödemli vakaları içeren diğer serilerde de intravitreal triamsinolon asetat ile OCT yardımıyla gösterilmiş tam anatomik iyileşme ve belli düzeyde fonksiyonel iyileşmenin sağlanabileceği ortaya konmuştur 65,66,67,68. İntravitreal triamsinolon asetat enjeksiyonu diffüz diyabetik maküla ödemlerinin tedavisinde de yalnız başına veya laser fotokoagülasyonu ile kombine olarak kullanılmıştır. Martidis ve arkadaşlarının prospektif çalışmalarında intravitreal 4 mg triamsinolon asetat enjeksiyonu sonrasındaki 3 ve 6 aylık takipler sonunda görme keskinliklerinde sırasıyla 2,4 ve 1,3 Snellen sırası artış bildirilmiştir. Bu takipler sonunda santral maküla kalınlığının da anatomik olarak normale döndüğü OCT ölçümleriyle kanıtlanmıştır. Daha sonra Jonas ve arkadaşları, diğer araştırmacılardan farklı olarak, 4 mg yerine 15 mg triamsinolon asetatı diyabetik maküla ödemi bulunan gözlere intravitreal olarak enjekte etmiştir. Bu çalışmada da, ortalama 6 aylık takip süresi sonunda enjeksiyon öncesine göre görme keskinliklerinde anlamlı artış ve fluoresein sızıntısında bariz gerileme bildirilmiştir. Ne var ki, yazarlar triamsinolon asetat enjeksiyonunu takip eden 5. aydan sonra görme keskinliğindeki iyileşme trendinin tersine döndüğü uyarısını yapmaktadırlar. Enjeksiyon sonrasında vakaların %36’sında göz içi basıncının 21 mmHg’nın üzerine çıktığı görülmekle birlikte, oküler hipertansiyonun göz içindeki steroid kristalleri yok oluncaya kadar topikal anti-glokomatöz ilaçlarla başarıyla kontrol edildiği bildirilmiştir. İntravitreal steroid enjeksiyonunun doğurabileceği diğer potansiyel komplikasyonlar olarak katarakt oluşumunun hızlanması ve kortizon kristallerinin maküla bölgesinde birikmesi gösterilmektedir. Son komplikasyon hastaların enjeksiyon sonrası en az iki saat başlarını dik pozisyonda tutmalarıyla önlenebilmektedir 65,68,69,70,71. 2.4.2. Yan Etkiler Glukokortikoidler tüm vücutta olduğu gibi gözde de çeşitli istenmeyen etkilere yol açabilmektedir. Steroidlerin gözdeki bilinen yan etkileri şunlardır: 38 Glokom Arka subkapsüler katarakt Koruyucu bağışıklık mekanizmalarının baskılanması sonucu, bakteriyel ve viral (özellikle herpetik) enfeksiyonların alevlenmesi Pitoz Midriyazis Skleral melting Göz kapağı cildinde atrofi Oral steroid dozlarının vücutta yol açabileceği yan etkiler ise şunlardır: Pitüiter-adrenal aksın baskılanması Hipergliseminin yol açtığı glukoneogenez, kaslarda atrofi ve osteoporoz Vücuttaki yağ dokusu dağılımının periferden merkeze doğru yer değiştirmesi Santral sinir sistemi üzerinde, öfori gibi, etkiler Uyku bozuklukları Femur başının aseptik nekrozu Peptik ülser Diyabet Nadiren psikoz Steroide bağlı göz içi basıncı artışı topikal, perioküler, nazal ve sistemik kullanımlarda görülebilmektedir. Bu etkinin düzeyi kişiden kişiye farklılık göstermektedir: 6 haftalık topikal deksametazon kullanımı hastaların yaklaşık % 4’ünde göz içi basıncını 31 mmHg’nın üzerine yükseltmektedir. Steroidlerin aközün trabeküler ağdan dışarı akımını nasıl zorlaştırdığı henüz bilinmemektedir. Laboratuvar deneyleri trabekül hücreleri içinde DNA replikasyonunun arttığını, aynı zamanda bir takım hatalı polipeptidlerin üretildiğini ortaya koymuştur. Steroidlere verilen cevap tedavinin süresi, sıklığı ve yolu ile kullanılan ilacın gücüne bağlıdır. Steroide bağlı göz içi basıncı artışına 5 günden kısa süreli kullanımlarda hemen hiç rastlanmazken, iki haftadan kısa süreli kullanımlarda çok nadir rastlanmaktadır. Göz içi basıncının steroid tedavisinin geç dönemlerinde de yükselebileceği genellikle dikkate alınmaz; fakat tedavinin ilk 6 haftasında basınç 39 artışının olmaması, bundan birkaç ay sonra artış olmayacağı anlamına gelmemektedir. Bu nedenle, iyatrojenik glokomatöz sinir hasarını önlemek için, kronik steroid tedavisi süresice belli aralıklarla göz içi basıncı kontrol edilmelidir. İlacın bir yıldan az kullanılması durumunda steroide bağlı göz içi basıncı artışı tedavinin kesilmesinden sonra genellikle düzelmektedir. 18 aydan uzun süren tedavilerde ise kalıcı göz içi basıncı yükselmesi sık görülür. Geri dönüşümlü vakalarda, göz içi basıncı ilacın kesilmesini takip eden iki hafta içinde normale dönmektedir 53,54. 40 3. GEREÇ VE YÖNTEM Yaşları 52 ila 75 arasında değişen (ort: 64,3 ±5,9) tip 1 ve tip 2 diyabetli 30 hastanın (18 kadın, 12 erkek) klinik muayene ve FFA ile tanı konan diyabetik diffüz maküla ödemli 39 gözü dahil edildi. Diffüz maküla ödemi tanısı için ödemin maküla merkezini, yani foveal avasküler bölgeyi de kapsayacak şekilde, iki veya daha fazla disk çapı büyüklükteki bir alana yayılmış olması şartı arandı. Hastalar Mayıs 2003Ekim 2004 tarihleri arasında İstanbul Kartal Eğitim ve Araştırma Hastanesi 2. Göz Kliniği Retina Birimi’nde takip edildi. Çalışmaya daha önce laser fotokoagülasyon tedavisi uygulanmış, fakat maküla ödemlerinde düzelme gözlenmemiş olan gözler dahil edildi. Olgulardan 28’ine birer, 11’ine ise ikişer kez laser fotokoagülasyon tedavisi uygulanmıştı. Son laser seansının üzerinden altı aydan kısa süre geçmiş olan gözler çalışmaya dahil edilmedi. Glokom veya oküler hipertansiyon öyküsü olan, kataraktlı veya vitroretinal traksiyon bulgusu olan gözler çalışmaya dahil edilmedi. Gözlerden hiçbiri daha önce herhangi bir nedenden dolayı opere edilmemişti (Tablo 1). Çalışmaya dahil edilen hastalara diyabetik retinopati ve muhtemel seyri ile ilgili bilgi verildi. Gözlerinin tedavi öncesindeki durumu, o ana kadar uygulanan tedavilerin etkinliği ve tedavi seçenekleri anlatıldı. Hastalar intravitreal triamsinolon asetonidin uygulanış biçimi, beklenen etki ve olası komplikasyonları hakkında bilgilendirildi ve işlemin gerçekleştirilmesi için hastalardan onay alındı. İntravitreal triamsinolon asetonid enjeksiyonundan bir gün önce tüm gözlerde Snellen eşeli ile düzeltilmiş görme keskinliği ve aplanasyon tonometrisi ile göz içi basıncı ölçümü yapıldı. Biyomikroskopik ön segment muayenesinin ve indirekt oftalmoskopi ile yapılan arka segment muayenesinin bulguları kaydedildi. Tüm gözlere enjeksiyondan ortalama 9,7 ±4,5 gün önce fundus fluoresein anjiografisi çekildi. Diffüz maküla ödeminin tedavisi için tüm gözlere birer kez 4 mg triamsinolon asetonid (Kenakort retard ampul 40 mg/ml) enjeksiyonu uygulandı. İşlem klinik bünyesindeki ameliyathanede, steril şartlarda, aynı hekim tarafından gerçekleştirildi. İntravitreal enjeksiyonun göz içi basıncında akut yükselmeye sebebiyet verebileceği düşüncesiyle işlemden önce göz içi basınçları düşürüldü. Bunun için işlemden önceki 41 gece hastaların asetazolamid 250 mg tablet almaları sağlandı ve enjeksiyondan hemen önce gözlere parmak masajı uygulandı. Enjeksiyon öncesi göze topikal proparakain damlatıldı ve göz %5’lik povidon iyodin solüsyonuyla yıkandı. Proparakain solüsyonuna batırılmış pamuk uçlu bir aplikatör enjeksiyondan önce 5 ila 10 saniye süreyle enjeksiyon bölgesine, skleraya basınç uygulamadan tatbik edildi. 0,1 ml içinde 4 mg triamsinolon asetonid insülin enjektörü ve 30 gauge’luk bir iğne ile limbusun 4 mm gerisinden vitre içine verildi. Enjeksiyon sonrası iğne geri çekildikten hemen sonra ilacın veya vitrenin geri sızmasını ve konjonktiva kanamasını önlemek için enjeksiyon noktasına pamuk uçlu aplikatör ile hafifçe, kısa süreli basınç uygulandı. Enjeksiyondan hemen sonra indirekt oftalmoskopi ile süspansiyonun vitre içindeki dağılımı ve optik sinir başının perfüzyonu kontrol edildi. İntravitreal triamsinolon asetonid enjeksiyonunun ertesi günü tüm hastalar kontrole çağrıldı. Biyomikroskopi, göz içi basıncı ölçümü ve indirekt oftalmoskopik muayene ile herhangi bir komplikasyonun olup olmadığı araştırıldı. Göz içi basıncı yüksek bulunan gözlere topikal monoterapi başlanarak, basınç normale düşene kadar haftalık kontrol gerçekleştirildi. Hastalar gözlerinde ani ve beklenmedik görme azalması, ağrı, kızarıklık gibi şikayetlerin oluşması durumunda vakit kaybetmeden kliniğe başvurmaları konusunda uyarıldı. Tedaviye cevabın izlenmesi için hastalar enjeksiyon sonrası birinci, üçüncü ve altıncı aylarda kontrole çağırıldı. Takiplerde Snellen eşeli ile düzeltilmiş görme keskinlikleri, aplanasyon tonometrisi ile göz içi basınçları, biyomikroskopik muayene ile katarakt oluşumu değerlendirildi ve veritabanına kaydedildi. İndirekt oftalmoskopik muayene ile vitre içindeki süspansiyonun durumu ve makülanın görünümü değerlendirildi ve kaydedildi. Birinci, üçüncü ve altıncı aylarda kontrol fundus fluoresein anjiografileri çekildi ve maküla bölgesinde sızıntı ve geç dönem göllenme olup olmadığı izlendi. Takiplerde göz içi basıncı 21 mmHg’nın üzerinde ölçülen hastalara topikal betaksolol başlandı. Çalışmaya dahil edilen tüm gözler en az 6 ay süreyle (ort: 9,2 ±2,5 ay) takip edildi. Çalışmada elde edilen veriler bilgisayardaki veritabanına kaydedildi ve SPSS for Windows 11.5 programı yardımıyla tanımlayıcı istatistiksel analizleri gerçekleştirildi. 42 Yaş Cinsiyet Hasta (E/K) Olgu (E/K) Takip Süresi Başvurudaki Görme Keskinliği Başvurudaki Göz İçi Basıncı Önceden Uygulanmış Laser Seansı Tek Seans İki Seans Tablo 1: Hasta özellikleri 52-75 12/18 15/24 6-14 ay 28 olgu 11 olgu Ortalama ±SD 64,3 ±5,9 9,74 ±2,23 0,21 ±0,15 15,38 ±2,40 43 4. BULGULAR Çalışmaya dahil edilen 30 hastanın (39 göz) hepsi Mayıs 2003-Mayıs 2005 tarihleri arasında, en az 6 aylık takip süresini tamamladı. Bu süre içinde, herhangi bir sebeple çalışma kapsamından çıkarılan göz olmadı. Yaşları 52 ila 75 arasında (ort: 64,3 ±5,9) değişen 30 hastanın 18’i kadın, 12’si erkekti. Gözlerin intravitreal triamsinolon enjeksiyonundan bir gün önceki görme keskinlikleri ortalaması 0,21 ±0,15, göz içi basınçları ortalaması 15,38 ±2,40 mmHg olarak bulundu. Enjeksiyon, gözlere daha önce uygulanmış olan son laser seansından ortalama 8,8 ay (en az 6, en çok 14 ay) sonra gerçekleştirildi. Tüm gözlerin tedavi öncesi FFA’larında maküla merkezini, yani foveal avasküler bölgeyi de kapsayacak şekilde, iki veya daha fazla disk çapı büyüklükteki bir alana yayılmış diffüz sızıntı izlenmekteydi (Tablo 1). Gözlerin birinci, üçüncü ve altıncı aylarda yapılan düzeltilmiş görme keskinliği ölçümleri sırasıyla ortalama 0,35 ±0,16; 0,38 ±0,18 ve 0,32 ±0,16 olarak bulundu (Şekil 1). Birinci, üçüncü ve altıncı aylardaki görme keskinlikleri ile işlem öncesindeki görme keskinlikleri arasındaki farklar istatistiksel olarak anlamlı bulundu (p<0,05). Düzeltilmiş görme keskinliklerinde birinci ayda ortalama 0,13 ±0,12; üçüncü ayda ortalama 0,17 ±0,12 ve altıncı ayda ortalama 0,11 ±0,11’lük artış izlendi (Şekil 2). Birinci ay sonunda 31 gözün görme keskinliğinde artış tespit edildi (%79,5). 5 gözün görme keskinliğinde değişiklik olmadı (%12,8). 3 gözün görme keskinliğinde bir sıra gerileme izlendi (%7,7). Üçüncü aydaki kontrol muayenelerinde, 35 gözün görme keskinliğinin tedavi öncesine göre arttığı tespit edilirken (%89,7), 4 gözün görme keskinliğinde değişiklik izlenmedi (%10,3). Altıncı ayda, tedavi öncesine göre 26 gözün görme keskinliğinde artış (%66,7), 1 gözünkinde ise azalma (%2,6) mevcuttu. Altıncı ayda 12 gözün görme keskinliğinin işlemden önceki seviyede olduğu gözlendi (%30,8). Tedavi sonrası birinci ayda çekilen FFA’larında 39 olgudan 25’inde (%64,1) maküla bölgesindeki sızıntı ve geç dönem göllenme bulgularında bariz düzelme izlendi. Üçüncü ayda çekilen kontrol anjiografilerinde 39 gözün 28’inde (%71,8), altıncı ayda ise 22’sinde (%56,4) belirgin düzelme izlendi (Şekil 3a-b, 4a-b, 5a-b). 44 Enjeksiyon sonrası birinci aydaki ölçümlerde ortalama göz içi basıncı 19,10 ±3,41 mmHg olarak bulunurken göz içi basınçlarında ortalama %24,2’lik artış gözlendi. Bu değer üçüncü aydaki ölçümlerde ortalama 17,59 ±3,28 mmHg (% 14,1’lik artış), altıncı ayda ise 17,46 ±2,26 mmHg (%12,2’lik artış) olarak bulundu (Şekil 6). Takip süresince 12 gözde göz içi basıncının 21 mmHg’nın üzerine çıktığı görüldü ve bunlara topikal betaksolol tedavisi başlandı. Postoperatif altıncı ayda yalnızca üç gözde göz içi basıncı 22 mmHg olarak ölçüldü. Bu üç gözün göz içi basınçları topikal monoterapi ile 9. ayda 21 mmHg’nın altına düştü. Takip süresince ölçülen en yüksek göz içi basıncı 28 mmHg idi ve işlem sonrası birinci ayda ölçülen bu basınç topikal monoterapi ile kontrol altına alındı (Tablo 2). Çalışma grubundaki gözlerden ikisinde altıncı ayda katarakt gelişimi gözlendi (%5,1). Enjeksiyona bağlı retina dekolmanı, vitre içi kanama veya endoftalmi gibi komplikasyonlara rastlanmadı. 45 0,5 DÜZELTİLMİŞ GÖRME KESKİNLİKLERİ 0,4 0,38 0,35 0,32 0,3 0,21 0,2 0,1 0 Önce 1. Ay 3. Ay 6. Ay Şekil 1: İntravitreal triamsinolon enjeksiyonu öncesi ve sonrasında düzeltilmiş görme keskinlikleri (ortalama). 46 0,18 0,16 0,17 DÜZELTİLMİŞ GÖRME KESKİNLİĞİNDEKİ ARTIŞ 0,14 0,13 0,12 0,1 0,11 0,08 0,06 0,04 0,02 0 1. Ay 3. Ay 6. Ay Şekil 2: İntravitreal triamsinolon enjeksiyonundan sonra düzeltilmiş görme keskinliklerindeki artış (ortalama). 47 Şekil 3: İntravitreal triamsinolon enjeksiyonu öncesi ve sonrası FFA’lar (Vaka 16) 48 Şekil 4: İntravitreal triamsinolon enjeksiyonu öncesi ve sonrası FFA’lar (Vaka 27) 49 Şekil 5: İntravitreal triamsinolon enjeksiyonu öncesi ve sonrası FFA’lar (Vaka 37) 50 20 19,1 GÖZ İÇİ BASINCI (mmHg) 18 17,59 17,46 3. Ay 6. Ay 16 15,38 14 12 10 Önce 1. Ay Şekil 6: İntravitreal triamsinolon enjeksiyonu öncesi ve sonrasında göz içi basıncı ortalamaları. Olgu 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 Cinsiyet E E K E K K E K K E E K K E K K K E E K Yaş 52 52 65 70 75 56 68 65 65 62 62 71 71 65 67 69 69 63 63 59 Vo (0) 0,2 0,5 0,1 0,1 0,05 0,2 0,5 0,3 0,2 0,1 0,2 0,05 0,05 0,6 0,4 0,2 0,3 0,4 0,05 0,1 TO (0) 14 16 18 14 16 18 12 14 16 15 13 17 18 19 14 12 10 18 15 19 Laser 1 2 1 2 1 2 2 2 2 1 1 1 1 2 1 2 1 1 2 1 Vo (1) 0,4 0,7 0,4 0,3 0,2 0,2 0,7 0,5 0,3 0,4 0,3 0,2 0,4 0,7 0,3 0,4 0,3 0,6 0,1 0,2 Vo (3) 0,5 1 0,4 0,2 0,2 0,2 0,7 0,5 0,3 0,5 0,3 0,1 0,4 0,7 0,4 0,3 0,3 0,5 0,1 0,4 Vo (6) 0,6 0,8 0,3 0,2 0,2 0,2 0,5 0,4 0,3 0,3 0,3 0,05 0,4 0,6 0,4 0,3 0,3 0,6 0,05 0,3 TO (1) 28 22 20 18 16 17 17 17 16 24 20 19 17 19 16 17 14 23 19 21 TO (3) 26 24 18 26 15 14 15 16 18 19 24 14 14 13 15 16 18 20 18 19 TO (6) 22 22 18 18 16 14 16 18 21 20 16 14 19 19 18 19 19 14 17 18 AG ilaç 1 0 0 0 0 0 0 0 1 1 0 0 0 0 1 1 0 0 0 Katarakt 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 Takip 9 12 13 7 8 8 7 14 8 8 9 8 7 9 11 14 9 10 10 9 Tablo 2: Hasta verileri Vo (0): Enjeksiyon öncesi düzeltilmiş görme keskinliği, Vo (1): Enjeksiyondan 1 ay sonraki düzeltilmiş görme keskinliği, Vo (3): Enjeksiyondan 3 ay sonraki düzeltilmiş görme keskinliği, Vo (6): Enjeksiyondan 6 ay sonraki düzeltilmiş görme keskinliği, TO (0): Enjeksiyon öncesi göz içi basıncı, TO (1): Enjeksiyondan 1 ay sonraki göz içi basıncı, TO (3): Enjeksiyondan 3 ay sonraki göz içi basıncı, TO (6): Enjeksiyondan 6 ay sonraki göz içi basıncı, Laser: İşlem öncesi uygulanan toplam laser seansı, AG ilaç: Antiglokomatöz ilaç (Betoptic damla 2x1), Katarakt: Takiplerde katarakt oluşumu, Takip: Takip süresi Olgu 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 Cinsiyet E K K K K E K K E K E E K K K K E K K Yaş 64 68 72 53 53 59 64 67 55 68 59 68 68 66 64 63 68 70 70 Vo (0) 0,3 0,2 0,1 0,4 0,1 0,2 0,15 0,2 0,3 0,2 0,1 0,2 0,5 0,05 0,1 0,05 0,2 0,1 0,2 TO (0) 16 12 18 18 15 14 11 16 14 20 15 15 13 14 16 17 13 18 17 Laser 1 1 1 2 1 1 1 1 1 1 1 2 1 1 1 1 1 1 1 Vo (1) 0,2 0,6 0,2 0,5 0,2 0,2 0,4 0,4 0,5 0,3 0,3 0,2 0,4 0,1 0,3 0,2 0,4 0,3 0,2 Vo (3) 0,4 0,7 0,3 0,5 0,3 0,3 0,3 0,3 0,5 0,3 0,3 0,3 0,5 0,2 0,3 0,3 0,4 0,3 0,4 Vo (6) 0,4 0,5 0,3 0,4 0,3 0,2 0,2 0,3 0,4 0,2 0,3 0,2 0,4 0,05 0,3 0,2 0,3 0,3 0,3 TO (1) 20 18 24 22 23 18 16 16 18 14 19 17 17 18 26 16 15 25 23 TO (3) 17 14 17 19 18 14 16 16 18 17 17 17 16 14 19 15 17 22 21 TO (6) 18 15 17 16 17 16 14 18 15 19 16 18 14 15 18 17 18 20 22 AG ilaç 0 0 1 1 1 0 0 0 0 0 0 0 0 0 1 0 0 1 1 Katarakt 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 Takip 11 12 13 13 13 10 7 11 7 11 10 12 12 8 6 7 9 10 8 Tablo 2 (devam): Hasta verileri Vo (0): Enjeksiyon öncesi düzeltilmiş görme keskinliği, Vo (1): Enjeksiyondan 1 ay sonraki düzeltilmiş görme keskinliği, Vo (3): Enjeksiyondan 3 ay sonraki düzeltilmiş görme keskinliği, Vo (6): Enjeksiyondan 6 ay sonraki düzeltilmiş görme keskinliği, TO (0): Enjeksiyon öncesi göz içi basıncı, TO (1): Enjeksiyondan 1 ay sonraki göz içi basıncı, TO (3): Enjeksiyondan 3 ay sonraki göz içi basıncı, TO (6): Enjeksiyondan 6 ay sonraki göz içi basıncı, Laser: İşlem öncesi uygulanan toplam laser seansı, AG ilaç: Antiglokomatöz ilaç (Betoptic damla 2x1), Katarakt: Takiplerde katarakt oluşumu, Takip: Takip süresi 5. TARTIŞMA DMÖ artan vasküler geçirgenlik nedeniyle, retinal kapillerlerden intraretinal ve subretinal mesafelere olan sızıntı sonucu ortaya çıkmaktadır. Bu sızıntı mikroanevrizmalardan kaynaklandığında sınırlı bölgeleri, kan-retina bariyerindeki yaygın bozulmadan kaynaklandığında ise daha geniş alanları ekileyebilmektedir 4,72 . Fokal maküla ödemi vakaları laser fotokoagülasyonu ile büyük oranda kontrol altına alınabilmekte, fakat diffüz maküla ödemi bulunan gözler bu tedaviye çoğu kez direnç göstermektedir 1,73. Diffüz DMÖ’nin patogenezi kesin olarak bilinmemekle birlikte retinanın iskemik bölgelerinden salınan endojen faktörlerin kapiller geçirgenliği artırdığı, bunun da ödeme yol açtığı düşünülmektedir 4. Kortikosteroidlerin araşidonik asit yolunu inhibe ederek, damar geçirgenliğini artırıcı etkisi bulunan prostaglandinlerin salınımını azalttığı bilinmektedir. Ayrıca kortikosteroidlerin damar geçirgenliğini artırdığı bilinen vasküler endotel büyüme faktörünün salınımını da azaltabileceği öne sürülmektedir. Bir kortikosteroid süspansiyonu olan triamsinolon asetonid uzun zamandan beri kistoid maküla ödeminin tedavisinde, perioküler olarak uygulanmaktadır. Triamsinolon asetonidin diffüz DMÖ’nin tedavisinde kullanılması, deneysel olarak kanıtlanmış olan kan-retina bariyerinin yıkımını yavaşlatıcı etkisi sayesinde diffüz maküla ödemini gerileteceği mantığına dayandırılmaktadır 74. Triamsinolonun subtenon enjeksiyon sonrasında yeterli derecede emilemediği ve kan-retina bariyeri üzerinde belirgin etkisi bulunmadığı gösterilmiştir 74 . İntravitreal enjeksiyon sonrasında ise etki bölgesine çok kısa sürede ulaşan ilacın vitre içinde 21 ila 41 gün arası depo formunda kalarak, mümkün olabilecek en yüksek seviyede etki gösterdiği hayvan deneylerinde kanıtlanmıştır 75,76. Öte yandan, triamsinolon asetonidin vitre içindeki yarılanma ömrünün diğer kortikosteroid preparatlarına kıyasla çok daha uzun olduğu gösterilmiştir. Öyle ki, triamsinolonun vitre içi yarılanma ömrü 1,6 gün iken deksametazonunki 2,5 saattir 76. Diffüz DMÖ tanısıyla intravitreal triamsinolon enjeksiyonu gerçekleştirilen 39 gözün 6 aylık takipleri sonucunda intravitreal olarak enjekte edilen triamsinolon asetonidin görme keskinliği ve FFA sonuçları üzerinde olumlu etki yaptığı gözlendi. Enjeksiyondan 1 ay sonra yapılan muayenede hastaların görme keskinliğinde Snellen eşelinde ortalama 1,3 sıra artış gözlemlendi. Görme keskinliği ölçümlerinde 6. ayda izlenen artış ise ortalama 1,1 sıra idi. 6 aylık takip süresi sonunda hastalardan yalnızca birinin görme keskinliğinde 1 sıra gerileme gözlendi. Enjeksiyon öncesi bir kez, enjeksiyon sonrası ise birinci, üçüncü ve altıncı aylarda fundus fluoresein anjiografisi çekilen gözlerin enjeksiyon sonrası birinci ayda %64,1’inde, üçüncü ayda %71,8’inde, altıncı ayda ise %56,4’ünde ilk anjiografilerine kıyasla maküla ödeminde belirgin azalma izlendi. Bu çalışmada intravitreal triamsinolon asetonidin diffüz DMÖ vakalarında, görme keskinliği ölçümlerine ve FFA sonuçlarına dayanılarak incelenen etkisi daha önce benzer hasta gruplarında yapılan çalışmaların sonuçlarıyla uyumlu bulunmuştur. Martidis A ve arkadaşlarının laser fotokoagülasyona dirençli 16 gözü kapsayan çalışmasında görme keskinliklerinde enjeksiyon sonrası 3. ayda ortalama 2,4 satır, 6. ayda ise ortalama 1,3 satır iyileşme gözlemlenmiştir 71 . Aynı çalışmada OCT ile yapılan ölçümlerde maküla kalınlıklarında 3. ay sonunda %55, 6. ay sonunda %38 azalma tespit edilmiştir. Ciardella AP ve arkadaşlarının laser fotokoagülasyonuna cevap vermeyen 30 DMÖ vakasını içeren çalışmalarında da benzer şekilde, enjeksiyon öncesi ortalama 0,17 olan görme keskinlikleri 1., 3. ve 6. aylarda sırasıyla 0,34, 0,36 ve 0,31 olarak ölçülmüş, maküla kalınlığı ölçümlerinde de belirgin gerileme tespit edilmiştir 77. Massin P ve arkadaşlarının diffüz DMÖ bulunan 15 gözü kapsayan çalışmalarında da, OCT ile yapılan ölçümlerde enjeksiyon öncesi ortalama 509,6 µm olan santral maküla kalınlığının, enjeksiyon sonrası 1. ayda ortalama 207,3 µm’ye, 3. ayda ise ortalama 207,0 µm’ye gerilediği gösterilmiştir 78. Ferrari MT ve arkadaşlarının 6 göz içeren benzer bir grupta yaptıkları çalışma ortalama 4 aylık takip süresinde görme keskinliğinde anlamlı artışla birlikte preoperatif 640,8 µm olan maküla kalınlıkları ortalamasının postoperatif ölçümlerde 312,2 µm’a gerilediği belirtilmiştir 79 . Aynı çalışmada, enjeksiyon öncesi ve enjeksiyon sonrası çekilen FFA’ları karşılaştırılmış, sızıntı ve geç dönem göllenme bulgularında düzelme izlendiği ifade edilmiştir. Son olarak, Sutter FKP ve arkadaşları, klasik laser tedavisine yanıt vermeyen diffüz DMÖ bulunan 69 gözde yaptıkları plasebo kontrollü bir çalışmada intravitreal triamsinolon asetonid uygulanan 33 gözün 18’inin (%55) görme keskinliğinde üç ay sonunda 5 veya daha fazla harflik artış gerçekleştiğini gözlemlemişlerdir. Aynı çalışmadaki plasebo grubunda yer alan 32 gözün ise 5’inin (%16) görme keskinliğinde bu derecede artış izlenmiştir. Bu çalışmada ayrıca intravitreal triamsinolon asetonidin maküla ödemini gerilettiği gerek indirekt oftalmoskopla subjektif derecelendirme yöntemiyle, gerekse OCT ölçümleriyle ortaya konmuştur 81. Bu çalışmada takip edilen vakaların 6. aydaki kontrol muayenelerinde gerek görme keskinliklerindeki iyileşme eğiliminin, gerekse FFA’larındaki sübjektif düzelme bulgularının, 1. ve 3. aylarla kıyaslandığında gerileme sürecine girdiği görülmüştür. 6. aydaki bulgular preoperatif döneme göre daha olumlu olmakla birlikte, diğer çalışmalarda da tespit edildiği şekilde vitre içindeki depo triamsinolon asetonidin etkisinin 3. aydan sonra giderek azaldığı düşünülmektedir. Jonas JB ve arkadaşlarının çalışmasında intravitreal uygulanan 20-25 mg triamsinolon asetonidin diffüz DMÖ bulunan gözlerdeki yaklaşık etki süresi 7-8 ay olarak tespit edilmiştir 80. Bizim çalışmamızda bu sürenin daha kısa olması vitre içine uygulanan triamsinolon asetonid miktarının daha az (4 mg) olması ile açıklanabilir. Nitekim 4 mg triamsinolon uygulayan Martidis A ve ark. ile Massin P ve ark.’nın çalışmalarında da bulgulardaki iyileşme eğiliminin 6. aya doğru gerilediği belirtilmiştir 71,78. İntravitreal steroid uygulaması her ne kadar DMÖ’nde gerileme ve görme keskinliğinde artış sağlıyorsa da, şu ana kadar yayınlanmış olan çalışmalarda da ortaya konduğu üzere, bu etkisi kalıcı olamamaktadır. İntravitreal triamsinolon asetonidin uygulamadan sonraki üçüncü ay civarında tamamen çözündüğü, altıncı ay civarında ise etkisini kaybetmeye başladığı düşünülmektedir. Etkisinin tam olarak ne kadar sürdüğü uzun süreli takiplerle henüz ortaya konmamış olmakla birlikte, bu tedavinin maküla ödemine neden olan patolojik süreci durdurması veya geriye döndürmesi zaten beklenmemektedir. Diyabetik hasarın yol açtığı, kan-retina bariyerindeki yaygın bozulmanın neden olduğu artmış vasküler geçirgenlik ve sızıntılar steroid etkisiyle bir süre baskılanabilse dahi, bir süre sonra, bu etki sona erdiğinde kaçınılmaz biçimde, yeniden ortaya çıkacaktır. Dolayısıyla, diffüz DMÖ’nin tedavisinde tek doz intravitreal steroid uygulamasının ancak semptomların geçici bir süre kontrol altına alınmasını sağlayacağı düşüncesindeyiz. Bu kontrol, örneğin tekrarlanacak laser fotokoagülasyon tedavisi öncesinde, laserin etkinliğini azalttığı bilinen ödemin giderilmesine ve böylece laserin daha stabil bir alanda uygulamasına imkan tanıyabilecektir. Maküla ödeminin uzun süreli kontrolü için, vitre içindeki steroidin etkinliği kaybolmaya başladığında enjeksiyonun yenilenmesi de başvurulan yöntemler arasındadır. Ne var ki, henüz bu uygulamanın etkinliğine ve güvenilirliğine dair herhangi bir çalışma yayınlanmamıştır. Uygulama tekrarının etkinliğinin ve yan etkilerinin anlaşılması daha uzun takip süreli yeni çalışmalarla mümkün olacaktır. İntravitreal triamsinolon asetonid enjeksiyonunun muhtemel komplikasyonları enjeksiyon işlemine ve vitre içindeki kortikosterid süspansiyonuna bağlı olmak üzere iki grupta incelenebilir. Enjeksiyon işlemine bağlı komplikasyonlar arasında retina dekolmanı, vitre içine kanama ve endoftalmi sayılabilir. Çalışmamızda bu komplikasyonlardan herhangi biri oluşmamıştır. Kortikosteroide bağlı olduğu düşünülen başlıca komplikasyonlar göz içi basıncında yükselme ve katarakt gelişimidir. Martidis A ve arkadaşları 71 , intravitreal triamsinolon uygulaması sonrası altıncı ayda göz içi basınçlarında ortalama %13’lük artış izlendiğini, takip ettikleri 8 gözden birinde göz içi basıncının 21 mmHg’nın üzerinde seyrettiğini bildirmişlerdir. Aynı gruptaki 8 hastadan birinde altıncı ay sonunda katarakt geliştiği ifade edilmiştir. Massin P ve arkadaşlarının çalışmasında da 12 gözün 6’sında göz içi basıncının 25 mmHg’nın üzerine çıktığı, fakat topikal monoterapi ile yeterli kontrolün sağlandığı bildirilmiştir 78. Sutter FKP ve arkadaşları ise intravitreal triamsinolon enjekte ettikleri 33 gözün 10’unda göz içi basıncının 5 mmHg’dan fazla yükseldiğini, 6 hastada ise 25 mmHg’nın üzerine çıktığını, bunların hepsinin topikal monoterapi ile kontrol altına alındığını açıklamışlardır. Aynı gruptaki 1 hastada katarakt, 1 hastada ise endoftalmi geliştiği bildirilmiştir. Çalışmamızda enjeksiyon sonrası ölçümlerde göz içi basınçları 21 mmHg’nın üzerine çıkan 12 vakada (%30,8) göz içi basınçları topikal monoterapi (betaksolol) ile normal sınırlara geriledi. Birinci ay sonuda ortalama göz içi basıncı 19,10 ±3,41 mmHg olarak ölçüldü. Üçüncü ve altıncı aylardaki göz içi basıncı ölçümleri de sırasıyla 17,59 ±3,28 mmHg ve 17,46 ±2,26 mmHg olmak üzere, kabul edilebilir sınırlar içindeydi. Çalışma grubumuzda yer alan 39 gözden 2’sinde altıncı ayda katarakt gelişimi gözlendi ve hastalardan biri dokuzuncu, diğeri on birinci ayda katarakt için opere oldu. İntravitreal kortikosteroid enjeksiyonunun bilinen bu komplikasyonları laser fotokoagülasyonuna yanıt vermeyen diffüz maküla ödemli gözlerde, kronik ödemden kaynaklanacak kalıcı görme kaybı riski göz önüne alındığında kabul edilebilir bulunmaktadır. 6. SONUÇ Sonuç olarak, laser fotokoagülasyona cevap vermeyen diffüz DMÖ’nde intravitreal triamsinolon asetonidin geçici bir süre için de olsa, gerek anatomik, gerekse görsel düzelme sağlayan, tecrübeli hekimler için uygulaması kolay, maliyeti düşük ve komplikasyonları kabul edilebilir düzeyde bir tedavi yöntemi olduğu ifade edilebilir. Ne var ki, esas patoloji tedavi edilmediği sürece, DMÖ’nin bu yolla kısa süreli kontrolünün uzun dönemli prognoza olumlu etki yapması beklenmemelidir. Tekrarlanan intravitreal triamsinolon asetonid enjeksiyonlarının uzun dönemdeki etkinliği ve yan etkileri ortaya konmadıkça bu tedavinin diyabetik maküla ödemlerinde uygulanan klasik tedavilere alternatif olabilmesi mümkün görünmemektedir. Tekrarlanan vitre içi steroid enjeksiyonlarının ve tek doz vitre içi steroid enjeksiyonu sonrası laser fotokoagülasyonunun etkinlikleri uzun dönemli takipleri içeren yeni çalışmalarla araştırılmalıdır. 7. KAYNAKLAR 1. Photocoagulation for diabetic macular edema. Early Treatment Diabetic Retinopathy Study report number 1. Early Treatment Diabetic Retinopathy Study Research Group. Arch Ophthalmol 1985; 103: 1796-806. 2. Moss SE, Klein R, Klein BEK. The 14-year incidence of visual loss in a diabetic population. Ophthalmology 1998; 105: 998-1003. 3. Klein R, Klein BE, Moss SE. Visual impairment in diabetes. Ophthalmology 1984; 91: 1-9. 4. Bresnick GH. Diabetic maculopathy: a critical review highlighting diffuse macular edema. Ophthalmology 1983; 90: 1301-17. 5. Lee CM, Olk RJ. Modified grid laser photocoagulation for diffuse diabetic macular edema: long-term visual results. Ophthalmology 1991; 98: 1594-602. 6. Pendergast SD, Hassan TS, Williams GA, et al. Vitrectomy for diffuse diabetic macular edema associated with a taut premacular posterior hyaloid. Am J Ophthalmol 2000; 130: 178-86. 7. Stern AL, Taylor DM, Dalburg LA, Cosentino RT. Pseudophakic cystoid maculopathy: a study of 50 cases. Ophthalmology 1981; 88: 942-6. 8. Tano Y, Chandler D, Machemer R. Treatment of intraocular proliferation with intravitreal injection of triamcinolone acetonide. Am J Ophthalmol 1980; 90: 810-6. 9. Jonas JB, Hayler JK, Panda-Jonas S. Intravitreal injection of crystalline cortisone as adjunctive treatment of proliferative vitreoretinopathy. Br J Ophthalmol 2000; 84: 1064-7. 10. Danis RP, Bingaman DP, Yang Y, Ladd B. Inhibition of preretinal and optic nerve head neovascularization in pigs by intravitreal triamcinolone acetonide. Ophthalmology 1996; 103: 2099-104. 11. Danis RP, Ciulla TA, Pratt LM, Anliker W. Intravitreal triamcinolone acetonide in exudative age-related macular degeneration. Retina 2000; 20: 244-50. 12. Moore KL, Persaud TVN. The Developing Human. pp. 423-429, W.B. Saunders, Philadelphia, USA, 1993. 13. Bengisu Ü. Göz Hastalıkları. s. 161-166, Palme Yayıncılık, Ankara, 1989. 14. Tasman W, Jaeger EA, Rullo C, Montzka D, Zacierka MD. Duane’s Clinical Ophthalmology. JB Lippincott Company, 1994. 15. Albert DM, Jakobiec FA. Clinical Practice Principles and Practice of Ophthalmology. W.B. Saunders Company, 1994. 16. Yanoff M, Duker JS. Ophthalmology, Second Edition. Mosby, St.Louis, USA, 2004. 17. Flynn HW, et. al. Basic and Clinical Science Course, Section 12, Retina and Vitreous. American Academy of Ophthalmology, San Francisco, USA, 20032004. 18. Williams PL, Warwick R. Gray’s Anatomy. pp. 1163-1176, Churchill Livingstone, London, 1980. 19. Aydın P, Akova YA. Göz Hastalıkları. s. 34-35, Güneş Kitabevi, Ankara, 2001. 20. Aydın P, Akova YA. Göz Hastalıkları. s. 15-18, Güneş Kitabevi, Ankara, 2001. 21. Klein R, Klein B. Epidemiyology of proliferative diabetic retinopathy. Diabetes care. 1992;15:1875-91. 22. Damcı T. İnsülin Tedavisi. Diabet, Obezite ve Metabolizma Hastalıkları. İstanbul: Diabet, Obezite ve Metabolizma Hastalıkları Sempozyumu, 2000:37-46. 23. Klein R, Klein B, Moss S, et al. The Wisconsin epidemiologic study of diabetic retinopaty. XIV. Ten year incidence and progression of diabetic retinopathy. Arch Ophthalmol 1994;112:1217-28. 24. Yanco L, Goldbourt V, Michaelson C, et al. Prevalance and 15 year incidence of retinopathy and associated characteristics in middle-aged and elderly diabetic men. Br J Ophtalmol 1983;67:759-65. 25. Klein R, Klein BEK, Moss SE, et al. The Wisconsin epidemiologic study of diabetic retinopathy. II. Prevelance and risk of diabetic retinopathy when age is less than 30 years. Arch Ophthalmol 1984;102:520-6. 26. Özkan Ş, Akar S. Diabetik Retinopati. İstanbul: Türk Oftalmoloji Derneği, 2000:11-5. 27. Bresnick, G.H.: Background diabetic retinopathy. Retina. 1994:1277-1318. The mosby Co. Toronto. 28. Fong, D.S, Ferris, F.L, Davis, M.D. and chew, E.Y.: ETDRS report no 24. Causes of severe visual loss in the early treatment diabetic retinopathy study. Am J Ophthal. 1999. Feb. 127 (2):137-61. 29. Klein, B.E, Klein R and Moss SE: Is serum cholesterol associated with progression of diabetic retinopathy or macular edema in persons with younger onset diabetes of long duration. Am J Ophthalmol 1999;128 (8):652-4. 30. Chew EY, Klein ML, Ferris FL, Remaley NA, Murphy RP, Chantry K, Hoogwert BJ and Miller D.: Association of elevated serum lipid levels with retinal hard exudate in diabetic retinopathy. ETDRS Report. Arch Ophthalmol 1996; 114 (9):1079-84. 31. Davis D, Fisher MR, Gangnon RE, Banton F, Aiello LM, Chew EY, Ferris L and Knatterud GL. Risk factors for high risk proliferative diabetic retinopathyand severe visual loss: ETDRS Report 18. Invest Ophthalmol Vis Sci 1998;39 (2): 233-52. 32. Browning DJ, Zhang Z, Benfield JM and Scott AO.:The effect of patient characteristics on response to focal laser treatment for diabetic macular edema. Ophthalmology. 1997;104 (3):466-72. 33. Takagi H, Otani A, Kiryu J and Ogura Y.: New surgical approach of removing massive foveal hard exudates in diabetic macular edema. Ophthalmology 1999;106 (2):249-56. 34. Aiello LM, Covallareno JD, Aiello LP and Bursell SF.: Diabetic Retinopathy. Retina. Vitreous. Macula. WB Saunders Co. Toronto 1999:316-44. 35. Arend O, Remky A, Harris A, Bertram B, Reim M, Wolf S. Macular microsirculation in cystoid maculopathy of diabetic patiens. Br J Ophthalmol 1995; 79 (7):628-32. 36. Gandorfer A, Messmer EM, Ulbig MW, Kampik A. Resolution of diabetic macular edema after surgical removal of the posterior hyaloid and the inner limiting membrane. Retina 2000; 20 (2):126-33. 37. Rosenblatt BJ, Benson WE. Diabetic Retinopathy. In: Yanoff M, Duker JS Ophthalmology second edition St Louis: Mosby, 2004:877-86. 38. Vitale S, Maguire MG, Murphy RP, Hiner CJ, Rourke L, Sackett C and Patz A. Clinically significant macular edema in type 1 diabetes incidence and risk factors. Ophthalmology 1995:102 (8):1170-6. 39. The ETDRS Group: Focal photocougulation treatment of diabetic macular edema. Relationship of treatment effect to fluoroscein angiography and other retinal characteristic at baseline. Report no: 19 Arch. Ophthalmol 1995 Sep. 13 (9):1144-55. 40. Thomas AC, Armando GA, Bernard Z. Diabetic retinopathy and diabetic macular edema. Diabetes Care 2003; 26: 2653-64. 41. Kadonosono K, Hoh N, Ohno S. Perifoveal microcirculation before and after vitrectomy for diabetic cystoid macular edema. Am J Ophthalmol 2000; 130: 740-4. 42. Chung MY. Surgical treatment for severe diabetic macular edema with massive hard exudates. Retina 2000; 20: 126-33. 43. Nasrallah FP, Jalkh AE, Van Coppenolle F et al. The role of the vitreous in diabetic macular edema. Ophthalmology 1998; 95: 1335-59. 44. Pandergast SD, Hassan TS, Williams GA, Cox MS, Morgerio RR, Ferrone PJ, et al. Vitrectomy for diffuse diabetic macular edema associated with a taut premacular posterior hyaloid. Am J Ophthalmol 2000; 130: 175-86. 45. Kylstra JA, Brown JC, Jaffe GJ, Cox TA, Gallemone R, et al. The importance of fluorescein angiography and other retinal characteristic at baseline. Report No: 19. Arch Ophthalmol 1995; 13: 46. Zewis H, Abrams GW, Blumenkranz MS, Campro RV. Vitrectomy for diabetic macular traction and edema associated with posterior hyaloid traction. Ophthalmology 1992; 99: 753-59. 47. Harbour JW, Smiddy WE, Flynn HW, Rubsaman PE. Vitrectomy for macular edema associated with a thickened and taut posterior hyaloid membrane. Am J Ophthalmol 1996; 1210: 405-13. 48. Ikeda T, Sato K, Katano T, Hayashi Y. Vitrectomy for cystoid macular edema with attached posterior hyaloid. Curr Opinion 1998; 9: 71-75. 49. Hikichi T, Fujio N, Akiba J, Azuma Y, et al. Association between the short term natural history of diabetic macular edema and vitreomacular relationship in type 2 diabetes mellitus. Ophthalmol 1997; 104: 473-8. 50. Bayraktar MZ. Diyabetik Maküla Ödemi ve Tedavisi, Maküla Hastalıkları. Türk Oftalmoloji Derneği, Ankara, 2001. 51. Menteş J. Diyabetik Makülopati ve Tedavisi. Ed: Özkan Ş, Akar S, Diyabetik Retinopati. Türk Oftalmoloji Derneği, İstanbul, 2000. 52. Abe T, Hayasaka S, Nagaki Y, et al. Pseudophakic cystoid macular edema treated with high-dose intravenous methylprednisolone. J Cataract Refract Surg 1999; 25:1286–8. 53. Tranos PG, Wickremasinghe SS, Stangos NT, Topouzis F, et al. Macular edema. Surv Ophthalmol 2004; 49: 470-90. 54. Cibis GW, Abdel-Latif AA, Bron AJ, et. al. Basic and Clinical Science Course, Section 2, Fundamentals and Principles of Ophthalmology. American Academy of Ophthalmology, San Francisco, USA, 2003-2004. 55. Tessler H, Lam S. Cystoid macular edema. in Pepose JS, Holland GN, Wilhelmus KR, (eds): Ocular Infection and Imunity. pp. 553–89, CV Mosby, St Louis, 1996. 56. Heier JS, Topping TM, Baumann W, et al: Ketorolac versus prednisolone versus combination therapy in the treatment of acute pseudophakic cystoid macular edema. Ophthalmology 2000; 107: 2034–8. 57. Nussenblatt RB. The natural history of uveitis. Int Ophthalmol 1990 ;14 : 303–8. 58. Yoshikawa K, Kotake S, Ichiishi A, et al. Posterior sub-tenon injections of repository corticosteroids in uveitis patients with cystoid macular edema. Jpn J Ophthalmol 1995; 39: 71–6. 59. McCartney HJ, Drysdale IO, Gornall AG, Basu PK. An autoradiographic study of the penetration of subconjunctivally injected hydrocortisone into the normal and inflamed rabbit eye. Invest Ophthalmol Vis Sci 1965; 4: 297–302. 60. Wakefield D, McCluskey P, Penny R. Intravenous pulse methylprednisolone therapy in severe inflammatory eye disease. Arch Ophthalmol 1986; 104: 847–51. 61. Hainsworth DP, Pearson PA, Conklin JD, Ashton P. Sustained release intravitreal dexamethasone. J Ocul Pharmacol Ther 1996; 12: 57–63. 62. Jaffe GJ, Ben-Nun J, Guo H, et al. Fluocinolone acetonide sustained drug delivery device to treat severe uveitis. Ophthalmology 2000; 107: 2024–33. 63. Jaffe GJ, Pearson PA, Ashton P. Dexamethasone sustained drug delivery implant for the treatment of severe uveitis. Retina 2000; 20: 402–3. 64. Jaffe GJ, Yang CH, GuoH, et al. Safety and pharmacokinetics of an intraocular fluocinolone acetonide sustained delivery device. Invest Ophthalmol Vis Sci 2000; 41: 3569–75. 65. Antcliff RJ, Spalton DJ, Stanford MR, et al. Intravitreal triamcinolone for uveitic cystoid macular edema: an optical coherence tomography study. Ophthalmology 2001; 108: 765–72. 66. Challa JK, Gillies MC, Penfold PL, et al. Exudative macular degeneration and intravitreal triamcinolone: 18 month follow up. Aust NZ J Ophthalmol 1998; 26: 277–81. 67. Penfold PL, Gyory JF, Hunyor AB, Billson FA. Exudative macular degeneration and intravitreal triamcinolone. A pilot study. Aust NZ J Ophthalmol 1995; 23: 293–8. 68. Young S, Larkin G, Branley M, Lightman S. Safety and efficacy of intravitreal triamcinolone for cystoid macular oedema in uveitis. Clin Experiment Ophthalmol 2001; 29: 2–6. 69. Jonas JB, Kreissig I, Sofker A, Degenring RF. Intravitreal injection of triamcinolone for diffuse diabetic macular edema. Arch Ophthalmol 2003; 121: 57–61. 70. Jonas JB, Sofker A. Intraocular injection of crystalline cortisone as adjunctive treatment of diabetic macular edema. Am J Ophthalmol 2001; 132: 425–7. 71. Martidis A, Duker JS, Greenberg PB, et al. Intravitreal triamcinolone for refractory diabetic macular edema. Ophthalmology 2002; 109: 920–7. 72. Bresnick GH. Diabetic macular edema: a review. Ophthalmology 1986; 93: 989-97. 73. McDonald HR, Schatz H. Grid photocoagulation for diffuse macular edema. Retina 1985; 5: 65-72. 74. Wilson CA, Berkowitz BA, Sato Y, et al. Treatment with intravitreal steroid reduces blood-retinal barrier breakdown due to retinal photocoagulation. Arch Ophthalmol 1992; 110: 1155-9. 75. Schindler RH, Chandler D, Tresher R, Machemer R. The clearence of intravitreal triamcinolone acetonide. Am J Ophthalmol 1982; 93: 415-7. 76. Scholes GN, O’Brien WJ, Abrams GW, Kubicek MF. Clearence of triamcinolone from vitreous. Arch Ophthalmol 1985; 103: 1567-9. 77. Ciardella AP, Klancnik J, Schiff W, et al. Intravitreal triamcinolone for the treatment of refractory diabetic macular oedema with hard exudates: an optical coherence tomography study. Br J Ophthalmol 2004; 88: 1131-6. 78. Massin P, Audren F, Haouchine B, et al. Intravitreal triamcinolone acetonide for diabetic diffuse macular edema. Ophthalmology 2004; 111: 218-24. 79. Ferrari MT, Sborgia L, Furino C, et al. Intravitreal triamcinolone acetonide: valuation of retinal thickness changes measured by optical coherence tomography in diffuse diabetic macular edema. Eur J Ophthalmol. 2004; 14: 321-4. 80. Jonas JB, Degenring RF, Kamppeter BA, et al. Duration of the effect of intravitreal triamcinolone acetonide as treatment for diffuse diabetic macular edema. Am J Ophthalmol. 2004; 138: 158-60. 81. Sutter FKP, Simpson JM, Gillies MC. Intravitreal triamcinolone for diabetic macular edema that persists after laser treatment. Ophthalmology 2004; 111: 2044-49.