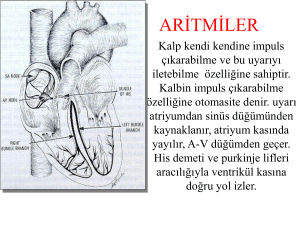
Uzmanlık Tezi Dr. Ergün ŞİMŞEK İSTANBUL
advertisement

T.C. SAĞLIK BAKANLIĞI HAYDARPAŞA NUMUNE EĞİTİM VE ARAŞTIRMA HASTANESİ 2. İÇ HASTALIKLARI KLİNİĞİ ŞEF: UZM. DR. REFİK DEMİRTUNÇ DEKOMPANSE KALP YETERSİZLİĞİNDE LEVOSİMENDAN VE DOBUTAMİN’İN QT DİSPERSİYONU ÜZERİNE ETKİSİ Uzmanlık Tezi Dr. Ergün ŞİMŞEK İSTANBUL - 2008 TEŞEKKÜR Uzmanlık eğitimim süresince bilgi ve deneyimlerini bizlerle paylaşan hocalarım; 2. Dahiliye Servisi Klinik Şefi Sn. Dr. Yıldız BARUT’a, Sn. Doç. Dr. H. Mehmet SÖKMEN’e, 3. Dahiliye servisi Klinik Şefi Sn Dr. Refik DEMİRTUNÇ’a, ; Rotasyonlarım süresince deneyimlerinden yararlandığım Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Kliniği Şefi Sn Doç. Dr. Paşa GÖKTAŞ’a, Biyokimya ve Klinik Biyokimya Klinik Şefi Sn Dr. Sacide ATALAY’a, Dr. Siyami Ersek Göğüs Kalp ve Damar Cerrahisi Eğitim ve Araştırma Hastanesi Kardiyoloji Klinik Şefi Sn. Dr. Tanju ULUFER’e, Dr. Lütfü Kırdar Kartal Eğitim ve Araştırma Hastanesi, Göğüs Hastalıkları ve Tüberküloz Kliniği Şefi Sn Doç. Dr. Benan ÇAĞLAYAN’a; Tezimin hazırlanması sırasında yardımlarından dolayı Sn Dr. Dursun DUMAN’a, Asistanlığım süresince bilgi ve deneyimlerinden faydalandığım uzmanlarım; Sn. Dr. Ali ÖZDEMİR’e, Sn. Dr. A. Tayfun KESKİN’e, Asistanlığım süresince beraber çalıştığım asistan arkadaşlarıma, Servisimizin sorumlu hemşiresi Sn. Varidet DAYANÇ’a, bütün hemşire ve personeline; Her zaman yanımda olan aileme teşekkürlerimi sunarım. Dr. Ergün ŞİMŞEK 2 İÇİNDEKİLER GİRİŞ VE AMAÇ ............................................................ 4 GENEL BİLGİLER ......................................................... 6 MATERYAL VE METOD .............................................. 59 BULGULAR .................................................................... 61 TARTIŞMA VE SONUÇ................................................. 65 ÖZET ...................................................................... 69 KAYNAKLAR ................................................................ 71 3 GİRİŞ Kalp yetersizliği (KY), kalp fonksiyonlarının akut yada kronik bozulmasına bağlı olarak gelişen semptomlar kompleksidir. Kardiyak atım hacminin dokuların metabolik ihtiyacını karşılayamayacak seviyede azalması, kalp yetersizliği semptomların olusumuna neden olur. KY, sıklıkla değisik kardiyak hastalıkların seyrinde, son evrede ortaya çıkar ve önemli bir mortalite ve morbidite nedeni olarak kabul edilir. Kalp yetersizliğinin prevalansı, Avrupa ve Kuzey Amerika’yı da içeren birçok ülkede yaklaşık % 2 oranında bildirilmiştir ve bu oran ileri yaşlarda daha da artmaktadır (1). Bir yılda, 1 milyon kişilik bir popülasyonda 3000 ile 5000 arasında yeni tanı konulmakta ve bütün tıbbi başvuruların %20’lik kısmını KY olusturmaktadır (1). KY’nin ilerlemesi, yaşam kalitesinin azalması, tekrar hastaneye yatışların, morbidite ve mortalitenin artışı ile birliktedir. KY hastalarının %40’ı son 1 yıl içinde hastaneye yatmaktadır ve bunların önemli bir kısmı akut dekompanzasyona bağlıdır. Tedavideki gelişmelere rağmen 5 yıllık mortalite %60’a yakındır ve bu oran çoğu maliğnitenin mortalitesinden daha yüksektir (2). Ortalama insan ömrünün uzaması ve kalp hastalıklarının tedavisindeki gelişmeler, kardiyak hastalıkların seyrinde son evre olarak kabul edilen kalp yetersizliği insidansında artışa neden olmuştur(3,4). Neden olduğu mortalite ve morbiditenin yanı sıra sağlık harcamalarını arttırmasıyla ülke ekonomileri için önemli bir mali yük olusturan sürekli takip ve ilaç kullanımıyla, hastanede yatarak tedavi gerekliliği bu hasta populasyonunda oldukça sıktır. Kalp Yetersizliği’nin dekompanzasyonunda tedavi diüretik, nitrat ve pozitif inotropları içeren yoğun intravenöz tedaviden olusur. Bugüne kadar sıklıkla kullanılan inotropik ajanlar [beta agonistler ve fosfodiesteraz III inhibitörleri (PDE III inh.)] semptomları ve morbiditeyi azaltmalarına rağmen önemli dezavantajlara sahiptirler ve en önemlisi mortaliteyi arttırmışlardır (5,6). Bu nedenle dekompanse KY tedavisinde, ideal bir inotrop ajan arayışı halen devam etmektedir. Yakın zamanda kullanıma giren ve kalsiyum duyarlaştırıcı bir inotropik ajan olan levosimendanın diğer inotropik ajanlara göre daha etkili ve güvenilir bir tedavi olduğu öne sürülmüştür. Levosimendanın dekompanse KY’de etkinlik ve güvenilirliği ile ilgili bilgiler temel olarak 103 hastaya levosimendan verildigi ve dobutamin ile karsılastırıldığı Levosimendan Infusion versus Dobutamine (LIDO) çalışmasına dayanmaktadır (7). 4 Ancak tüm dünyada ve ülkemizde bu ajanla ilgili henüz yeterli deneyim ve bilgi birikimi mevcut degildir. ÇALIŞMANIN AMACI Günümüzde, İleri evre kalp yetersizliğinde konvansiyonel tedaviye (Anjiotensin Reseptör Blokeri(ARB), Diüretik, Digital, Anjiotensin Converting Enzim İnhibitörü (ACEI)) yanıt alınamayan hastalarda Levosimendan mı yoksa Dobutaminin mi tercih edilmesi konusu kesinlik kazanmamıştır ve her iki ilaçta kullanılmaktadır. Son dönemde yapılan ve Levosimendan ile Dobutamin’in çeşitli kalp fonksiyonları (kardiak debi, klinik düzelme, mortalite, elektrokardiyoğrafik bulgular vs.) üzerine etkisini karşılaştıran çalışmalarda Levosimendanın daha avantajlı olduğu bildirilmiştir.(8,9). Sol ventrikül sistolik fonksiyon bozukluğu nedeniyle kalp yetersizliği olan hastaların ventrikül aritmileri ve ani ölüm açısından yüksek riske sahip olduğu bilinmektedir(10). Deneysel ve klinik çalışmalar, ventrikül aritmilerinin gelişiminde homojen olmayan miyokardiyal repolarizasyonun önemli bir rol oynadığını göstermiştir(11,12). Repolarizasyon dispersiyonunun bir göstergesi olan QT dispersiyonu, ventrikül aritmilerinin gelişimi açısından önemli bir belirteç olarak düşünülmektedir(13). Artmış QT dispersiyonu birçok hasta ve hastalık grubunda ciddi aritmi ve ani ölüm riski ile ilişkili bulunmuştur(14-16). Bu çalışmamızda dekompanse kalp yetersizliği hastalarında güncel bir inotropik ajan olan levosimendan ile dobutamin tedavilerinin, ventrikül aritmilerinin gelişimi açısından önemli bir belirteç olan elektrokardiyografik bulgulardan QT dispersiyonu üzerine etkisini değerlendirmeyi amaçladık. 5 GENEL BİLGİLER KALP YETERSİZLİĞİ Kalp Yetersizliği Tanımı ve Epidemiyoloji: Kalp yetersizliği hemodinamik anomaliler, bozulmuş egzersiz kapasitesi, nörohormonal aktivasyon ile hızlı progresyon gösteren ve kalbin, dokuların ihtiyacı olan sistemik perfüzyonu sağlayamayacak düzeyde mekanik yetersizliği sonucu yüksek mortaliteyle seyreden bir sendromdur. Kalp yetersizliği dünyada yaklaşık 15 milyon insanı etkileyen yaygın bir hastalıktır. Kalp yetersizliği sıklığı yaşla birlikte artmaktadır. 50-60 yaş arası grupta sıklığı %1-2 iken, 75 yaş üzerinde %10’a ulaşmaktadır. Tüm kalp yetersizliklerinin ortalama %80’i 65 yaş ve üzerindeki kişilerde görülmektedir. Framingham çalışmasına göre; 50-59 yaş arası her 1000 erkekte 3, 1000 kadında 2, 80-89 yaş arası her 1000 erkekte 27, 1000 kadında 22 hastada kalp yetersizliği saptanmıştır ve kadın/erkek oranı 1/3 olarak bulunmuştur. ABD’de her yıl ortalama 45.000 hastanın ölüm nedeni olarak kalp yetersizliği bildirilmekte ve her geçen yıl bu sayı popülasyonun yaşlanması ve kardiyovasküler hastalıklardan sağkalım oranlarının artması nedeniyle artmaktadır. Ayrıca hem tıbbi masraflar hem de iş gücü kaybı ekonomiyi olumsuz etkilemektedir(17,18). Etiyoloji ve Patofizyoloji: Kalp yetersizliği, kalbin dokuların ihtiyacı olan yeterli miktarda kanı pompalayamaması veya bunu sadece yüksek doluş basınçları ile gerçekleştirebildiği bir tablodur. Kalbin dokuların ihtiyacı olan kanı pompalayamaması; yapısal anomaliler, yetersiz kardiyak doluş ve/veya kontraktil yetersizliğe bağlı meydana gelebilir. Adaptasyon mekanizmaları kan volümünü, kardiyak doluş basınçlarını, kalp hızını ve kas kitlesini artırarak normal fizyolojiyi sağlamaya çalışır. Ancak bu adaptif mekanizmaların da katkısıyla kalbin kontraksiyon ve relaksasyon kapasitesi daha da bozulmakta ve kalp yetersizliği hızlı ilerleme göstermektedir(18). 6 Tablo 1: Kalp yetersizliğinin mekanizmaları ve altında yatan nedenler; ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Miyokard hasarı ile kalp yetersizliği yapanlar: İskemik kalp hastalıgı Kardiyomiyopatiler Miyokardit Ventrikül yüklenmesi: Basınç yüklenmesi: Sistemik hipertansiyon Aort darlıgı Aort koarktasyonu Pulmoner hipertansiyon Pulmoner darlık Volüm yüklenmesi: Mitral yetersizliği Aort yetersizliği Ventriküler septal defekt Patent ductus arteriozus Atriyal septal defekt Ventrikül dolusuna karsı obstrüksiyon ve restriksiyon: Mitral darlıgı Atriyal miksoma Sag ventrikül infarktüs Konstrüktif perikardit Kalp tamponadı Diger: Cor pulmonale Tirotoksikoz Yüksek debili kalp yetersizliği ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 7 Konjestif Kalp Yetersizliğinin Mekanizmaları: Familyal kardiyomiyopati: Miyositteki sarkomerik protein ve kalsiyum tutucu mekanizmanın fetal paterndeki gen ekspresyonuna çevrilmesi (nörohormonal sitokin anomalisi ve hemodinamik yüklenme ile) sonucu oluşan bozulmadır. Miyositlerin kalsiyum yüklenmesi: Hemodinamik yüklenme sarkoplazmik retikular ATPase’ın ve miyosit plazmalemmasındaki Na-Ca transporter ekspresyonunun ve aktivitesinin azalmasına yol açar. Sonuçta sitoplazma içindeki kalsiyum miktarı artar sistolik disfonksiyon ve relaksasyon kusuru gelişir. Miyokardiyal hücre ölümü; Apoptozis ve Nekrozis: apoptozis programlanmış hücre ölümüdür ve yaşlanma, iskemi, nörohümoral ve sitokin aktivitesinde artış ve hemodinamik yüklenme sonucunda meydana gelir. İskemik miyokardiyal nekroz daha lokalize skar oluşumuna neden olur. Yaşayan hüclerin üzerindeki artmış hemodinamik yük ve ventriküler remodeling hücre ölümü sonucu oluşan kalp yetersizliğinin en önemli mekanizmalarıdır. Hemodinamik yüklenme ve sitoskeletal proteinleri kodlayan genlerde mutasyon sonucu meydana gelen sitoskeletal anomaliler de miyosit sitoplazması ve kardiyak remodeling üzerine olumsuz etkilerle yetmezliğe sebep olmaktadır. Ektraselüler matriks proliferasyonu: Matriks metalloproteinaz(MMP) aktivitesinin artışı ekstraselüler matriks proteinlerini artırır ve intersitisyel fibrozis oluşur. Fibrozis kontraksiyon ve relaksasyon kusuruna neden olur. Anjiyotensin dönüştürücü enzim inhibitörleri (ACE-I) ve MMP inhibitörleri bu konuda faydalı olabilirler. Sipronalaktonun etki mekanizmasında ekstraselüler matriks turn-over’ının azalması da rol oynayabilir. Miyokardiyal enerji ihtiyacı ve sunumu arasındaki dengesizlik: Akut iskemik sendromlu hastalardaki kalp yetersizliği mekanizmalarından birisi de yüksek enerjili fosfat depolarının azalmasıdır. Hipertansiyon ve aort stenozunda subendokardiyal alanda enerji depolarında azalma gösterilmiştir. Mitral yetersizliğinde kardiyak kreatininfosfat/adenozintrifosfat (CP/ATP) depolarında noninvazif olarak MR spektroskopi ile azalma gösterilmiş ve ventrikül çapları arttıkça ve ventrikül fonksiyonu bozuldukça bu azalmanın fazlalaştığı gösterilmiştir. Ayrıca dilate kardiyomiyopatide CP/ATP oranının multivaryant analizde yaşam beklentisinin bağımsız belirleyicisi olduğu saptanmıştır(19). 8 Sınıflama: 1-Sebep ve sonuç ilişkisine dayanarak kalp yetersizliği çeşitli alt gruplarda ncelenebilir. Bunlar: - Sağ /Sol - Akut /Kronik - Düşük Atımlı /Yüksek Atımlı - Sistolik /Diyastolik - İskemik /Noniskemik Kalp Yetersizliği olarak sınıflandırılabilir(18). Sağ /Sol Kalp Yetersizliği: Konjestif kalp yetersizliğinde teori, sıvı birikiminin etkilenen boşluğun gerisinde gerçekleşmesi üzerine kurulur. Pulmoner konjesyona bağlı semptomlar ve plevral efüzyon öncelikli olarak sol kalp ile ilişkiliyken, pretibiyal ödem, hepatomegali, asit daha çok sağ kalp yetersizliğinin sonucudur. Sıvı birikimi, glomerüler filtrasyon hızının azalması ve renin anjiyotensin sisteminin aktivasyonu sonucu gerçekleşir. Azalmış kardiyak output glomerüler filtrasyon hızını azaltarak renin ve aldosteron salınımını artırır. Venöz konjesyon ve azalmış kan akımı nedeniyle oluşan hepatik yetersizlik aldosteron metabolizmasını etkileyerek aldosteronun daha da artmasına neden olur. Sonuç su ve tuz tutulumudur. Akut/Kronik Kalp Yetersizliği: Kalp yetersizliğinin klinik bulgularının şiddeti ve semptom gelişme sıklığı adaptif mekanizmaların gelişebilmesi için yeterli zamanın varlığına dayanır. Örneğin öncesinde tamamen normal olan bir kişide aniden gelişen anatomik veya fonksiyonel bir patoloji (miyokard infarktüsü, yüksek ventrikül cevaplı taşiaritmi, infektif endokardite sekonder kapak rüptürü) kardiyak outputta ciddi bir azalma, yetersiz organ perfüzyonu veya etkilenen ventrikülün gerisinde akut konjestif semptomları meydana getirecektir. Ancak aynı olaylar zaman içinde gerçekleştiğinde kardiyak remodeling, nörohormonal aktivasyon gibi birçok adaptif mekanizma ile uzun zaman düşük kardiyak output ve anotomik anomali tolere edilecektir. 9 Düşük/Yüksek Atımlı Kalp Yetersizliği: İstirahatte düşük atımlı kalp yetersizliği birçok kardiyovasküler hastalık sonucu oluşan kalp yetersizliğinin karakteristik bulgusudur (konjestif kalp yetersizliği, hipertansiyon, koroner arter hastalığı, kardiyomiyopati). Tirotoksikoz, arteriyal-venöz fistül, anemi, Beriberi, Paget’s hastalığı gibi birçok hastalık yüksek atımlı kalp yetersizliğine yol açabilir. Düşük atımlı kalp yetersizliği soğuk ve siyanotik ekstremitelerle karakterizedir, nabız basıncı daralmıştır ve arter-ven oksijen saturasyon farkı artmıştır. Yüksek atımlı kalp yetersizliğinde ekstremiteler genellikle sıcak ve kızarıktır ve nabız basıncı genişlemiştir ve arter-ven oksijen saturasyon farkı normaldir. Sistolik/Diyastolik Kalp Yetersizliği: Kalp yetersizliği kalbin pompa fonksiyonunu etkileyen sistolik fonksiyonda veya doluşunu etkileyen diyastolik fonksiyonda bozulma sonucu meydana gelebilir. Klasik kalp yetersizliği kasılma fonksiyonunda bozulma sonucudur. Diyastolik fonksiyon bozukluğu sol ventrikül relaksasyonunda bozulma ve relaksasyon sürecinin ancak yüksek intrakardiyak basınçlar altında gerçekleşebilmesidir. Bu durum geçici olarak iskemik sebepli veya kalıcı olarak hipertrofi, depo hastalıkları veya restriktif kardiyomiyopatide görülebilir. Sistolik kalp yetersizliğinin klinik bulguları uygunsuz kardiyak atım ve sekonder su-tuz tutulumuna bağlıdır, diyastolik kalp yetersizliğinin klinik bulguları yüksek ventrikül basınçları nedeniyle venöz basınçların artışına bağlı olarak sistemik ve pulmoner konjesyon ile meydana gelir. Epidemiyolojik çalışmalar diyastolik disfonksiyonun sistolik disfonksiyon kadar sık görülen bir patoloji olduğunu göstermektedir. Çoğu zaman bu iki durum birlikte bulunmaktadır. Sistolik ve diyastolik kalp yetersizliği ayrımı tedavilerindeki farklar nedeniyle önemlidir. Tanıda öykü, fizik muayene, biyokimyasal inceleme, tele, elektrokardiyografi, ekokardiyografik inceleme, koroner anjiyografi ve kalp kateterizasyonu bulguları birlikte değerlendirilmelidir. Ancak buna rağmen ayrım zor olabilir. Özellikle minimal sistolik disfonksiyonla birlikte görülen diyastolik disfonksiyon gibi durumlarda tedavi önde gelen patoloji üzerinde yoğunlaşmalıdır. 10 İskemik/Noniskemik Kalp Yetersizliği: Koroner arter hastalığı toplumda kalp yetersizliğinin en sık sebebidir. İskemi ve infaktüs sonucu sağ-sol, akut-kronik, sistolik veya diyastolik kalp yetersizlikleri meydana gelebilir. En önemli mekanizma miyokard infarktüsü ile oluşan miyokard nekrozudur. Koroner arter hastalarında stunned ve hiberne miyokard varlığının tespiti tedavi ile geri dönüşüm açısından önemlidir çünkü kardiyak miyositler canlı durumdadır ve reperfüzyonla fonksiyonel iyileşme göstermektedir. Stres-ekokardiyografi, Positron Emisyon Tomografi, miyokard sintigrafisi ayrımda yardımcı tetkiklerdir. Diğer bir mekanizma miyokard infarktüsü sonrası patolojik remodeling sonucu gelişen iskemik kardiyomiyopatidir. Ventrikülde anevrizma gelişimi, fibrozis, ventriküler ve atriyal aritmiler, papiller kas iskemisi veya anuler dilatasyon sonucu oluşan mitral yetersizliği ve nörohormonal aktivasyon gibi birçok faktör kardiyak dilatasyon ve kalp yetersizliğine doğru ilerlemeye sebep olur. İskemik kardiyomiyopati büyük epikardiyal koroner damarların aterosklerotik daralması ile ilgilidir. Ancak diffüz küçük damar hastalığı da iskemiye yol açarak miyokard disfonksiyonuna sebep olabilir. Diyabetik hastalarda epikardiyal koroner arterlerde aterosklerotik daralma olabileceği gibi küçük damar hastalığı da olabilir. İskemik ve noniskemik kalp yetersizliği tedavideki farklar açısından birbirlerinden ayrılmalıdır. İskemik kalp yetersizliğinde sıklıkla geçirilmiş miyokard infarktüsü öyküsü, göğüs ağrısı, miyokard iskemisi ve infarktüsünün elektrokardiyografik bulguları, ekokardiyografik olarak tespit edilen duvar hareket bozuklukları ve anjiyografik olarak epikardiyal damarlarda daralma tespit edilir. İleri dönem kalp yetersizliği dinamik dönem olarak nitelendirilir. Bu dinamik dönemde birçok mekanik, moleküler, immünolojik, iskemik, proaritmik, vasküler ve müsküloskeletal kuvvetlerin semptomatoloji ve bozulmayı hızlandırdığı bilinmektedir. Bu proçeslerin tanınması ve uygun tedavisi sonucunda miyokardiyal disfonksiyonun progresyonunun yavaşlaması belki de geri dönüşümü mümkün olabilmektedir(20). Yeniden Yapılanma(Remodeling): Kalp yetersizliği, remodeling olarak tanımlanan sürecin sonucu olarak meydana gelir. Remodeling, bölgesel veya global olabilir. Artmış ventriküler kitle ve volümleri, ventriküler şekil değişikliği ve intersitisyel proliferasyonla karakterizedir. Sistolik disfonksiyon sonucunda yeterli stroke volümü sağlamak amacıyla adaptif bir 11 mekanizmayla ventrikül kavitesi genişlemekte ve sonuçta düşük kontraktil fonksiyonla yeterli stroke volüm sağlanmaya çalışılmaktadır. Remodeling miyokardiyal ve intersitisyel kitle artışına sebep olur. Sol ventrikül duvar kalınlığının artışı duvar stresini artırarak Laplace kanunu gereği kontraktilitede atrışa sebep olur. Remodeling hücresel seviyede miyosit hipertrofisi, miyosit kaybı ve intersitisyel fibrozis ile ortaya çıkmaktadır. Miyosit hipertrofisinin başlangıç stimülasyonu mekanik gerilme iken, fibrozis stimülasyonu hümoral orijinlidir. İn vitro çalışmalarda anjiyotensin II’nin miyositlere toksik etkili olduğu ve kollajen depolanmasını artırdığı gösterilmiştir. Anjiyotensin II ve aldosteronun kültüre edilmiş kardiyak fibroblastlarda kollajen stimülasyonunu artırdığı gösterilmiştir. Miyosit hipertrofisinde etkili diğer mediyatörler ise endotelin-1, anjiyotensin II, a-agonistler (norepinefrin) ve kardiyak büyüme faktörleridir(20). Mekanik Etkenler: Ventrikül çaplarında meydana gelen artış Laplace kanunu gereğince duvar stresini artırır. Artmış duvar stresi, duvar kalınlığının artırılması ile azaltılmaya çalışılır. Ancak bu durum ventrikülün sertliğini artırarak relaksasyon ve doluş kusuruna sebep olur. Frank-Starling yasasına göre çalışan kalpte istirahatte normal kardiyak debi ve normal ventriküler performans gözlenirken, egzersiz sırasında ileriye doğru kardiyak debide belirgin artış olmadan pulmoner basınçta ciddi artış ve pulmoner konjesyon meydana gelir. Kalp yetersizliğinin ileri döneminde ventrikül sferik bir şekil alır. Sferizasyon yüksek sistol sonu duvar stresi ve kas fibrillerinin anormal dağılımı sonucudur. Ventrikül sferisitesi arttıkça kontraktilite daha da bozulur. Fonksiyonel mitral yetersizliği, ileri dönem kalp yetersizliğinin sık karşılaşılan bulgusudur. Mitral anuler dilatasyon, papiller kas ve duvar hareket anomalileri ve artmış kavite sferisitesi nedeniyle meydana gelir. Sferisite artışı papiller kasların laterale deviyasyonuna ve mitral leafletlerin koaptasyonunda bozulmaya sebep olur(20). Koroner Arter Hastalığı: Koroner arter hastalığı, infarktüs ile miyosit kaybı, miyokardiyal fibrozis ve remodeling, miyokardiyal ‘stunning’ ve ‘hibernasyon’ ile kalp yetersizliğine sebep olur. Miyokardiyal stunning, iskemik olay sonrasında koroner kan akımı sağlanmasına ve 12 irreversibl hasar oluşmamasına rağmen miyokardiyal fonksiyonların gecikmiş toparlanması olarak tanımlanır. Hasarlanmanın serbest oksijen radikalleri ve artmış sitosolik kalsiyum sonucu oluştuğu düşünülmektedir. Miyokardiyal toparlanma süresi iskemik periyodun süresi ile ilişkilidir. Hibernasyon, kronik stunning veya uzamış iskemi sonucunda gelişen ve potansiyel olarak dönüşümlü olduğu bilinen ventriküler disfonksiyonu tanımlar. Miyositler canlı kabul edilir ve revaskülarizasyon sonrası fonksiyonları dönüşümlüdür. Koroner kan akımının yetersizliği derecesinde kontraktil disfonksiyon gözlenir. Kalp dokusu iskemiye yanıt olarak enerji gereksinimini azaltır ve fonksiyonel bir adaptasyon sürecine girer. Son zamanlarda hibernasyonun tekrarlayan stunning epizotları sonucunda oluştuğuna dair deliller artmaktadır. Vanoverschelde ve arkadaşları bu mekanizmayı ortaya koymuşlardır. Positron emisyon tomografi, talyum sintigrafisi ve stres ekokardiyografi tanıda yardımcı tetkiklerdir. Revaskülarizasyonla hiberne miyokardın fonksiyonları yerine gelmekte ve yaşam beklentisi artmaktadır(20). Subendokardiyal İskemi: Subendokardiyal bölgenin koroner perfüzyonundaki azalma, bu bölgenin kontraksiyona katkısını azaltmaktadır. İleri dönem kalp yetersizliğinde taşikardi ve duvar stresindeki artış nedeniyle miyokardiyal oksijen ihtiyacı artmaktadır. İntramiyokardiyal basınç artışı etkisini en çok subendokardiyal alanda gösterdiğinden en fazla duvar stresi ve en çok oksijen ihtiyacı bu alanda meydana gelir. Subendokardiyum düşük koroner akım durumunda kan akımı azalan ilk bölgedir. Taşikardi, hem miyokardiyal oksijen ihtiyacını artırır hem de diyastol süresini kısaltarak oksijen sunumunu azaltır. Artmış diyastolik doluş basınçları da subendokardiyal beslenmeyi olumsuz yönde etkiler. Subendokardiyal kan akımı azalmasına bağlı olarak fibrozis oluşur , laktat artar, kreatinin fosfat ve ATP azalır. Ventrikül çaplarının azaltılması, koroner perfüzyon basıncının artırılması, sol ventrikül end-diyastolik basıncının azaltılması ve kalp hızının azaltılması subendokardiyal perfüzyonu artırarak enerji ihtiyaç-sunum dengesini düzeltebilir(20). 13 Miyosit Kaybı: Kalp yetersizliğinde nekrozis ve apoptozis ile miyosit kaybı olur. Norepinefrin salınımı ve anjiyotensin II ve aldosteron model sistemlerde miyosit nekrozuna sebep olmaktadır. Apoptozis (programlanmış hücre ölümü) hücrelerin kendi DNA’larının kendi enzimleriyle hasarlanması sonucu ölümüyle karakterize ve enerji gerektiren bir olaydır. Komşu hücrelerle yüzey bağlantısının kaybı, kromatin yoğunlaşması, kromozomal DNA’nın fragmantasyonu meydana gelir. Sonuç selüler dejenerasyon ve makrofajlar tarafından fagositozdur. Apoptozis fizyolojik olarak organ sistemlerinin matürasyonunda (embriyogenez) görülür. Ancak normal şartlarda olgunlaşmış hücrelerde gözlenmez. Kalp yetersizliğinde apoptozise sebep olan genlerde (p53) artış mevcuttur. TNFa da apoptozisi tetikleyen sitokinlerdendir(20). Aritmogenesis: Ani ölüm, ACE-I ile tedavi edilen ileri dönem kalp yetersizliği hastalarında %2862 sıklıkta oluşur. Geniş infarkt alanları reentry sonucu malign aritmi oluşturmaya daha yatkın bölgelerdir. Tek başına iskemi de aritmiye sebep olabilir. Gerek iskemik gerek se noniskemik kardiyomiyopatide subendokardiyal iskemi zaten mevcuttur. Sol ventriküler hipertrofi, iskemik ve noniskemik kardiyomiyopatili hastalarda artmış ani kardiyak ölüm riskini artırmaktadır. Aritmi mekanizmaları olarak azalmış istirahat membran potansiyeli, artmış eksitabilite, intersitisyel fibrozis sonucu ileti yavaşlaması ve anormal intraselüler kalsiyum tutulumu, sempatik tonusta artış,elektrolit dengesizlikleri(potasyum ve magnezyum gibi) sorumludur(20). Noniskemik kalp yetersizliği, sebebi iskemik olmayan kardiyak disfonksiyon sonucu meydana gelen kalp yetersizliğini olarak tanımlanır. Tanı kriterleri ve sınıflandırma Kalp yetersizliğinin büyük kısmında sistolik disfonksiyon ön planda iken, çoğu durumda sistolik ve diyastolik disfonksiyon bir arada bulunur. Kalp yetersizliği tanısında Framingam kriterleri kullanılır.(tablo 2) Tanı 2 major yada 1 major+2 minör kriterle konur(21). 14 Tablo 2. Framingam kriterleri Major kriterler Minör kriterler Paroksismal nokturnal dispne Ayak bileği ödemi Boyun venlerinde distansiyon Gece öksürüğü Raller Efor dispnesi Kardiyomegali Hepatomegali S3 galo Plevral efüzyon Akut akciğer ödemi Vital Artmış juguler venöz basınç azalma, Dolaşım zamanın uzaması (>25 msn) Taşikardi (hr>120 dk) kapasitede Hepatojuguler reflü Pulmoner ödem, visseral konjesyon Tedaviye cevap alınması(5 günde 4.5 kg daha fazla kilo kaybı) Fonksiyonel Kapasite: Kalp hastalarının sınıflandırılması New York Heart Association(NYHA) tarafından geliştirilen, semptom oluşması için gereken efor miktarını değerlendiren skalayla yapılır. Subjektif şikayetlerden oluşan bir sınıflandırma olmasına rağmen NYHA fonksiyonel sınıflamasının kronik kalp yetersizliğinde yaşam beklentisinin güçlü bir prediktörü olduğu kanıtlanmıştır. Sınıf I Limitasyon yok. Olağan fizik aktivite yorgunluk, nefes darlığı ve çarpıntı gibi şikayetlere sebep olmaz. Sınıf II Fizik aktivitede hafif kısıtlılık var. İstirahatte semptom görülmez. Olağan fizik aktivite sonucunda minimal yorgunluk , çarpıntı , nefes darlığı ve göğüs ağrısı olabilir. Sınıf III Fizik aktivitede belirgin kısıtlılık var. Hasta istirahatte normal olmasına rağmen olağan fizik aktivite dahi belirgin semptomatoloji oluşmasına neden olur. Sınıf IV Limitasyon olmadan hiçbir fizik aktivite gerçekleştirilememesi konjestif kalp yetersizliği semptomları istirahatte dahi gündeme gelir. 15 ACC/AHA Kalp yetersizliği Evreleri Evre A Kalp yetersizliği(KY)’nin gelişimi ile kuvvetli olarak ilişkili komorbid durumların olmasından dolayı kalp yetersizliği riski olan hastalar. Böyle hastaların KY belirti ve bulguları yoktur ve KY’nin belirti ve bulgularını hiç göstermemişlerdir. Kapakların veya ventriküllerin yapısal veya fonksiyonel bozuklukları yoktur. Örnekler:Sistemik hipertansiyon, koroner arter hastalığı, diyabetes mellitus. Evre B Kalp yetersizliği gelişimi ile kuvvetli olarak ilşkili yapısal kalp hastalığı gelişmiş olan, ancak KY belirtisi olmayan ve KY’nin bulgu veya belirtilerini hiç göstermemiş olan hastalar. Örnekler:Sol ventrkül hipertrofisi;asemptomatik valvüler kalp hastalıklarında dilate olmuş ventriküller;geçirilmiş miyokard infarktüsü. Evre C Altta yatan yapısal kalp hastalığı ile ilşkili eskiden veya halen belirtileri olan hastalar. Evre D Maksimum medikal tedaviye rağmen istirahatte belirgin kalp yetersizliği semptomları bulunan ve özel girişimlere ihtiyaç duyan hastalar. Örnekler:Hastaneden güvenle taburcu edilemeyen , tekrar tekrar hastaneye yatırılan, hastanede kalp transplantasyonu bekleyen, hastane benzeri ortamlarda bulunan, evde semptomların azalması için sürekli intravenöz destek alan, mekanik destek cihazı ile tedavi gören hastalar. Bu yeni evreleme şeması büyük ölçüde kliniğe dayalıdır ve hekimlerin tedavilerini spesifik hasta alt gruplarına daha fazla odaklanmış biçimde yönlendirmesine izin vermektedir. Hastalar genellikle bu şemada ileriye doğru gelişme gösteriyor olsalar da bazen D’den C’ye geçebilirler (22,23) Klinik Özellikler Semptomotoloji: Kalp yetersizliğinde belirtiler etkilenen kalp boşluğu ve yetersizliğin ciddiyeti ile doğru orantılı olarak meydana gelir.Dispne Kalp yetersizliğinin en sık semptomudur. Egzersiz dispnesi, ortopne, paroksismal nokturnal dispne hastalığın çeşitli derecelerinde 16 görülen semptomlardır. Dispneye hemen her zaman öksürük ve hırıltılı solunum da eşlik etmektedir. Sol kalp yetersizliğinin ileri dönemlerinde ve sağ kalp yetersizliğinde konjestif semptomlar görülmektedir. Hepatik konjesyon, splenomegali ve asit, künt karın ağrısına; pretibial ödem ve alt ekstremitedeki şişlikler, ağrı, egzersiz intoleransı(Sistolik sol ve sağ kalp yetersizliğinde meydana gelen düşük kardiyak output, iskelet kaslarının fonksiyonu için gerekli metabolitlerin yeterli miktarda taşınamamasına ve dokulardan uzaklaştırılamamasına neden olmaktadır) ve musküler atrofi meydana gelebilir. Solunum kaslarında oluşan kondüsyon eksikliği de egzersiz intoleransını arttırmaktadır. Kardiyak kaşeksi kalp yetersizlikli hastaların % 15’inde ve daha sık olarak yüksek NYHA fonksiyonel kapasitedeki hastalarda görülür ve artmış mortalite ve morbiditeyle ilişkilidir. Gece saatlerinde supin pozisyonda kanın kalbe dönüşü kolaylaşır dolayısıyla preload artar ve bu da kardiyak outputu artırarak glomerüler filtrasyonu hızlanır ve noktüri oluşabilir. İleri dönem kalp yetersizliğinde kardiyak outputun ciddi azalması sonucunda ise oligüri meydana gelebilir. Özellikle ileri dönem kalp yetersizliğinde yaşlı hastalarda konfüzyon, hafıza bozukluğu, anksiyete, uykusuzluk ve nörotik bozukluklar görülebilir. Sağ kalp yetersizliğine bağlı konjesyon sonucu sağ üst kadran ağrısı,bulantı, kusma, konstipasyon, karın ağrısı ve distansiyon gibi gastrointestinal semptomlar da görülebilir. Klinik Bulgular ve Fizik Muayene: İnspeksiyon: Anksiyete, ikter, siyanoz, boyun venlerinde dolgunluk, solukluk, çomak parmak, adrenerjik aktivasyon artışına bağlı soğukluk ve terleme, bacaklarda ve karında şişlik, dekübitüs ülserleri, kaşeksi, solunum dakika sayısında artış, Cheyne-Stokes solunumu. Palpasyon: Kalp tepe atımının yer değiştirmesi, pretibial ödem, hepatujuguler reflü, hepatosplenomegali, asit, A-V fistüle bağlı tril. Perküsyon: Asit, plevral efüzyon, kardiyomegali. 17 Oskültasyon: S3, S4 varlığı, sistolik ve diyastolik üfürümler, perikardiyal sürtünme sesi, akciğerde ince ve kaba raller. Laboratuar Bulgular: Biyokimyasal Tetkikler: Tam Kan Sayımı: Kan hemoglobin, hematokrit değerleri kalp yetersizliği veya semptomların sebebinin anemi olup olmadığını anlamada önemlidir. Kronik kalp yetersizliğinde sıklıkla görülebilen infeksiyon durumunda lökositoz varlığının belirlenmesi ve tedavi sonrası takipte de tam kan sayımı önemlidir. Elektrolitler: Özellikle diüretik kullanımıyla meydana gelen elektrolit anomalileri aritmojenik eğilimde artışa neden olduğu için prognoz üzerine kötü etkilidir. Hiponatremi, hipopotasemi, hipomagnezemi, hipokalsemi ,hipernatremi, hiperpotasemi görülebilecek elektrolit bozukluklarıdır. Renal Fonksiyon Değerlendirilmesi: Renal yetersizlik ve nefrotik sendrom, kalp yetersizliğine benzer semptomlarla neden olabilir. Ayrıca kronik kalp yetersizliği ve akut dekompansasyonda hipoperfüzyona bağlı renal disfonksiyonn gelişebilir. BUN, kreatin, glomerüler filtrasyon hızı gibi parametreler kronik ACE-I kullanan hastaların monitörizasyonunda önemlidir. Karaciğer Fonksiyon Testleri: Konjestif karaciğer sirozu sonrasında kan bilirübin düzeylerinde ve karaciğer enzimlerinde artış görülebilir. Endokrinolojik Değerlendirme: Atriyal fibrilasyonu olan ve yaşlı hastalarda tiroid fonksiyon testleri önemlidir. Özellikle bayan hastalarda diyabet önemli bir kalp yetersizliği sebebidir. Dislipidemi de diyabet gibi koroner arter hastalığı risk faktörü olduğundan değerlendirilmelidir. Akut alevlenme ve dekompansasyon durumlarında eritrosit sedimentasyon hızı, CRP, fibrinojen gibi akut faz reaktanları ve kalp yetersizliğindeki nörohormonal aktivasyonun markerleri olan atriyal natriüretik peptid, brain natriüretik peptid, N-terminal Btip natriüretik peptid, C-tip Natriüretik peptid, endotelin-1, TNF a, IL-1, IL-6, adrenomedüllin, norepinefrin, renin ve anjiyotensin II gibi nörohormonların kan değerleri hastaların tedavi stratejilerinin seçiminde ve tedaviye yanıtı takipte önemli biyokimyasal parametrelerdir. 18 Egzersiz sırasında konjestif kalp yetersizlikli tüm hastalarda plazma norepinefrin seviyeleri yükselmektedir. 24 saatlik idrarda norepinefrin salınımı kalp yetersizliğinin ciddiyetiyle korele olarak yükselmektedir. Deneysel kalp yetersizliği modellerinde kardiyak sempatik sinir stimülasyonuna kalp hızı ve kontraktilite yanıtı azalmıştır. Norepinefrin, anjiyotensin II ve arginin vazopressin damar duvarından endotelin salınımını artırır. Endotelin ise vazokonstüksiyona sebep olur ayrıca konjestif kalp yetersizliğinde kötü prognozla ilişkilidir. Miyokard infarktüsü sonucu oluşturulan kalp yetersizliği deneysel modelinde endotelin reseptör blokeri Bosentan hemodinamiyi iyileştirmiş ve yaşam beklentisini artırmıştır. Plazma Brain Natriüretik Peptid seviyeleri, kalp yetersizliğinde yaşam beklentisinin altın standart prediktörü olarak bilinen ejeksiyon fraksiyonuna göre daha üstün görülmektedir ve kalp yetersizlikli hastaların teşhis, risk değerlendirmesi ve takibinde faydalı bir biyokimyasal parametredir. Natriüretik peptidler kalp yetersizliği tanısında yardımcı olarak kullanılabilirler. Kalp yetersizliği tanısında önerilen değerler Brain natriüretik peptid >100pg/ml , NTproBtip natriüretik peptid>125pg/ml(<75 yaş), 450pg/ml(>75 yaş) dir. Natriüretik peptidlerin negatif prediktif değerleri daha anlamlıdır(%90 dan daha fazla). Bu nedenle dispne yakınmasıyla başvuran hastaların kardiyak sebepli olup olmadığının dışlanmasında çok daha değerlidir(17). Kalp yetersizliğinde birtakım sitokinlerin over-ekspresyonu da önemli rol oynar. Tümör Nekroz Faktör a(TNFa) ve interlökin-1(IL1) seviyeleri artmıştır(20). Akut kalp yetersizliğinde sempatoadrenal aktivasyon adaptif bir mekanizma olsa da kronik kalp yetersizliğinde ek miyokard hasarına neden olur. Bristow ve arkadaşları kalp yetersizliğinde B1 adrenerjik reseptörlerin down- regüle olduğunu göstermiştir. Bu durum yetersizlikli kalbin sempatik sinir uyarısına azalmış duyarlılığını göstermektedir. Sempatik sinir sistemi ve reninanjiyotensin- aldosteron sistemi aktivasyonu periferik vazokonstrüksiyona sebep olur. a blokaj ve ACE inhibisyonu egzersiz sırasındaki normal kan akımını sağlayamaz. Nitrik oksit üzerinden işleyen asetilkolin bağımlı ve akım bağımlı (flow mediated) vazodilatasyonun bozulduğu gösterilmiştir. Bu anomaliler aterosklerotik riski olmayan hastalarda da görülmektedir. 19 Kalp yetersizliğinde plazma seviyeleri yükselen nöroendokrin faktörler şunlardır; Norepinefrin Epinefrin Renin aktivitesi Anjiyotensin II Aldosteron Arginin vazopressin Nöropeptid Y Vazoaktif intestinal peptid Prostoglandinler Atriyal natriüretik faktör Interlökin-1 Endotelin B-Endorfin Kalsitonin geni ile ilgili peptid Growth hormon Kortizol TNF-alfa Nörokinin A Substans P Adrenomedüllin BNP ve NT-proBNP Interlökin-6 Akciğer Grafisi: Kardiyomegali, sol ventrikül diyastol sonu basıncı 15 mmHg’nın üzerinde olan hastaların %46’sında tespit edilen en sık radyolojik bulgudur. Pulmoner venlerin belirginleşmesi, intertisiyel gölgelerde belirginleşme, Kerley A ve B çizgileri, plevral efüzyon konjestif kalp yetersizliği’nin radyolojik bulgularıdır. Ayrıca P-A akciğer grafisi dispnenin kardiyak veya pulmoner sebeplerinin ayrımında da önemlidir. Elektrokardiyografi: Kalp yetersizliğinde altta yatan etiyolojik sebebi belirlemede önemlidir. EKG altta yatan iskemik kalp hastalığı, sol ventrikül hipertrofisi, sağ ventrikül hipertrofisi , perikardiyal efüzyon, infiltratif kalp hastalığı, interventriküler ileti anomalileri ve taşiaritmileri belirlemede faydalıdır. İntraventriküler ileti gecikmeleri, QRS süresi, QT süresi, T dalgasının durumu prognozla ilişkili EKG bulgularıdır. Kaba ve ince dalgalı AF embolizasyonaçısından medikal tedavi seçiminde önemlidir. Elektrolit anomalilerinde meydana gelecek EKG değişiklikleri tanı ve tedavinin takibinde faydalıdır. Akciğer Fonksiyon Testleri: Kalp yetersizliği ve akciğer hastalıkları genelde birlikte seyrettiği için bu hasta grubunda rutin akciğer fonksiyon testleri önerilmemektedir. Ancak sol ventrikül sistolik fonksiyonları normal olan ve semptomların kardiyak kaynaklı olmadığı düşünülen hasta grubunda faydalıdır. Egzersiz Testi: Egzersiz testi, pik egzersizde oksijen ihtiyacının tespiti, fonksiyonal kapasitesinin belirlenmesi ve EKG yanıtının değerlendirilmesi açısından önemlidir. Pik oksijen ihtiyacı 14 ml/kg/dak altında olan ve /veya yaşa göre beklenen egzersiz kapasitesi %50’nin altında olan hasta grubunda prognoz kötüdür ve kalp transplantasyonu için belirleyici olarak düşünülebilir. 20 Ekokardiyografi: Ekokardiyografik inceleme kalp yetersizliğinin teşhisinde ve takibinde yaygınlığı, kullanım kolaylığı, cost efektifliği ve zararsız ultrason dalgası teknolojisinden temel alması nedeniyle şüphesiz en faydalı laboratuar incelemesidir. İki boyutlu, M-mode, spektral ve renkli Doppler, 3-D ve doku Doppler incelemeler sonucunda kalp yetersizliğinin ciddiyeti, altta yatan etiyolojik faktörler ve prognozu hakkında önemli bilgiler sağlanmaktadır. Ventrikül duvar hareket bozuklukları, biventriküler hipertrofi, konjenital kalp hastalıkları, infiltratif kalp hastalıklarının belirlenmesi, kapak hastalıklarının tespiti, sağ ventrikül patolojilerinin belirlenmesi, perikardiyal efüzyon, diyastolik kalp yetersizliğinin teşhisi ve takibinde ekokardiyografik inceleme önemlidir. Dobutamin stres ekokardiyografi bozulmuş sol ventrikül sistolik fonksiyonunun eşlik ettiği aort darlığının tanı ve tedavi planlamasında faydalı bir tetkiktir. Koroner Anjiyografi ve Kateterizasyon: Koroner arter hastalığı kalp yetersizliğinin en sık sebebidir. Etiyolojik faktörler arasında iskeminin tespiti önemlidir. Ventrikülografik incelemeyle ejeksiyon fraksiyonu tespiti ve kalp kateterizasyonu ile elde edilecek basınç ölçümleri ventrikül performansını ortaya koymaya yardımcı olur. Akut miyokard infarktüsü komplikasyonlarının değerlendirilmesinde ve intrakardiyak şantların belirlenmesinde de sol ventrikülografi önemlidir. Kapak hastalarının teşhisinde hemodinamik inceleme ve transplantasyon düşünülen hastaların tespitinde koroner anjiyografi ve sağ/sol kalp kateterizasyonu önemlidir. Konjenital kalp hastalıklarında elde edilen hemodinamik veriler, şant oranları ve ek patoloji varlığının tespiti de bu hasta grubunda önemlidir. Elektrofizyolojik Monitörizasyon: Senkop, presenkop ve resüsitasyondan geçen hasta grubunda aritmi tespiti açısından elektrofizyolojik tetkikler önemlidir. Kalp yetersizliği hastalarında ventriküler aritmiler çok sık olmakta ve bu hastaların %50’sinde ani kardiyak ölüm meydana gelmektedir. Özellikle holter moniterizasyonu ve elektrofizyolojik inceleme ile saptanan ventriküler aritmilerin tedavisinde ICD kullanılmasıyla prognozda sağlanan iyileşme ayrıca antiaritmik medikasyonun seçimi ve medikal tedavi altındaki hastaların takibi bu tür ileri incelemelerin önemini artırmaktadır. Endomiyokardiyal Biyopsi: Sistemik hastalık nedenli kardiyomiyopatiden şüphelenilen hasta grubunda faydalıdır. Miyokarditte düşük diyagnostik kapasitesi 21 nedeniyle rutin olarak önerilmemektedir. Transplantasyon hastalarında rejeksiyon takibinde önemlidir. Aritmi ve perforasyon gibi komplikasyonlara yol açabilir. Prognoz: Tüm kalp yetersizlikli hastalarda 5 yıllık yaşam beklentisi yaklaşık % 50 civarındadır. İleri dönem kalp yetersizliğinde ise yıllık mortalite % 30-40 coranındadır. Kalp yetersizliğinde ölümün %90’dan fazla sebebi kardiyovasküler kaynaklıdır. En önde gelen ölüm sebepleri ise kötüleşen kalp yetersizliği (dekompansasyon) ve ani kardiyak ölümdür(20). MERIT-HF fonksiyonel sınıfı NYHA sınıf II olan hastalar daha çok (%64) ani ölüm ile kaybedilirken fonksiyonel olarak NYHA sınıf IV olan hastaların ölüm nedeni daha çok (%33) pompa yetersizliğidir. Mortalite ile ilgili faktörler: Klinik faktörler; Erkek cinsiyet, Koroner arter hastalığı varlığı, Yüksek NYHA fonksiyonel sınıfı, Düşük egzersiz kapasitesi, Yüksek istirahat kalp hızı, Düşük sistolik arteriyal basınç, Daralmış nabız basıncı, Persistan S3 varlığı, Cheyne- Stokes solunumu, Kardiyak kaşeksi, istirahatte kullanılan oksijen miktarında azalma. Hemodinamik faktörler ; Düşük sol ventrikül ejeksiyon fraksiyonu, düşük sağ ventrikül ejeksiyon fraksiyonu,düşük sol ventrikül stroke work index,yüksek sol ventrikül dolum basıncı,yüksek sağ atriyal basınç,düşük sol ventrikül sistolik basıncı,düşük ortalama arteriyal basınç,düşük kardiyak indeks,azalmış egzersiz kardiyak output ,artmış sistemik vasküler rezistans. Biyokimyasal faktörler ; Artmış plazma norepinefrin, artmış plazma renin, artmış plazma arginin vazopressin,artmış plazma atriyal ve brain natriüretik peptid, artmış plazma endotelin-1,artmış plazma interlökin-1,artmış plazma interlökin- 6,artmış plazma TNFa, azalmış serum sodyum,azalmış serum potasyum ve total potasyum deposu,azalmış serum magnezyum,artmış NTproB-tip natriüretik peptid. Elektrofizyolojik faktörler ; Sık ventriküler ekstrasistol varlığı,Nonsustained ventriküler taşikardi,Ventriküler taşikardi,Atriyal fibrilasyon) olarak belirlenmiştir. Kronik Stabil Kalp Yetersizliğinde Akut Dekompansasyon Sebepleri: Nonkardiyak - Önerilenlere uymamak (tuz, sıvı, ilaç) 22 - Yakın zamanda reçete edilen diğer ilaçlar (amiodaron harici diğer antiaritmikler, beta-blokerler, NSAİ, verapamil, diltiazem) Alkol kullanımı Böbrek disfonksiyonu (aşırı diüretik kullanımı) Enfeksiyon Pulmoner embolizm Tiroid disfonksiyonu (örneğin, amiodaron) Anemi (gizli kanama) Kardiyak - Atriyal fibrilasyon Diğer supraventriküler veya ventriküler aritmiler Bradikardi Mitral veya triküspid regürgitasyonunun ortaya çıkması veya kötüleşmesi Miyokardiyal iskemi (sıklıkla semptomsuz) Miyokardiyal enfarktüsü de kapsar Aşırı ön yük azalması (diüretik+ACE inhibitörleri) Koruma: Koroner arter hastalığının kalp yetersizliğinin en sık sebebi olduğu düşünüldüğünde koroner arter hastalığı yönünde için yapılacak primer ve sekonder koruma kalp yetersizliğinin gelişme sıklığını azaltacaktır. Bu amaçla kullanılan aspirin, statinler, ACE-I, beta blokerler gibi ilaçlar, diyet ve yaşam stili modifikasyonu kalp yetersizliği görülme sıklığını azaltacaktır. Akut romatizmal ateş profilaksisi ve infektif endokardit profilaksisi gelişebilecek kapak disfonksiyonuna bağlı kalp yetersizliği ve akut mekanik komplikasyonları önlemede önemlidir. Progresyonun Engellenmesi: Son 20 yılda konjestif kalp yetersizliği tedavisindeki en önemli ilerleme sol ventrikül disfonksiyonu ve dilatasyonunun, remodeling süreciyle ilerlemesini engelleyen ilaçların bulunmasıyla gerçekleşmiştir. Anjiyotensin II, aldosteron, katekolaminler, endotelin ve proinflamatuar sitokinlerin kanda anormal seviyelerde dolaşmasının miyokard kaybını ve disfonksiyonunu ve intertisiyel fibrozisi artırdığı bilinmektedir. Bunun sonucunda ise progresif sol ventriküler dilatasyon, patolojik hipertrofi ve ileri sistolik ve diyastolik disfonksiyon meydana gelmektedir. Reninanjiyotensin-aldosteron sistemi inhibitörleri, beta blokerler ve fibrozisi engelleyen ilaçlar bu kötü yönlü remodelingi engelleyerek daha ileri bozulma ve ventriküler disfonksiyonun önüne geçmektedir. Yaşam Beklentisinin Uzatılması: ACE inhibitörleri, Beta blokerler (metaprolol,carvedilol,bisoprolol) ve sipronalakton ve hidralazin isosorbiddinitrat ile yaşam süresinde artış kanıtlanmıştır. 23 Ancak konjestif kalp yetersizliğinde mortalitenin %40-50 oranında sebebi ani kardiyak ölümdür. Ani ölümün ventriküler fibrilasyon nedeniyle oluştuğu düşünülse de miyokard infarktüsü, sinüs nod ve ileti anomalilerine veya hemodinamik anomalilere yanıta bağlı bradiaritmiler de ani ölüm sebebi olabilir. Beta blokerler bu mekanizmaları etkileyerek ani ölüm insidansını %40-50 oranında azaltmaktadır. Antiaritmik ilaçlar proaritmojenik etkileri nedeniyle etkili bir tedavi seçeneği olamamaktadır. Seçilmiş hasta gruplarında koroner revaskülarizasyon, intrakardiyak defibrilatörler, biventriküler pacing, kalp transplantasyonu ile sürvi artırılabilmektedir. TEDAVİ Farmokojik olmayan tedavi Genel tavsiye ve ölçümler Hastanın ve ailesinin eğitimi(24). Kilo kontrolü (Hastalara düzenli aralıklarla kendilerini tartmaları, 3 günde 2 kilodan fazla kilo artması gibi beklenmedik kilo alımında konsülte edilmeli, diüretik dozu ayarlanmalıdır. Besinsel ölçümler-Sodyum Na+ tuzu yerine başka şeyler kullanılmalı fakat bunların potasyum içerebileceği hakkında uyarılmalıdır (24). Sıvılar İleri kalp yetersizliği olanlarda hiponatremi olsun ya da olmasın sıvı alımı kısıtlanmalıdır. Sıvı kısıtlanmasının tam miktarı halen net değildir. İleri evre kalp yetersizliğinde 1.5-2 lt sıvı kısıtlaması önerilir (25). Alkol Orta düzeyde alkol alımına izin verilir. Alkolik kardiyomiyopatiden şüphelenilen olgularda alkol tüketimi engellenmelidir(25). Obesite Kronik kalp yetersizliğinin tedavisi aşırı kilolu ve obeslerde kilo vermeyi de kapsar (26, 27). Anormal kilo kaybı İleri evre kalp yetersizliği olan hastaların yaklaşık %50’sinde klinik ya da subklinik malnutrisyon mevcuttur. Total vücut yağının kaybı ve zayıf beden kütlesi kardiyak kaşeksi olarak adlandırılan kilo kaybına eşlik eder.Kardiyak kaşeksi, azalmış 24 yaşam süresi için önemli göstergedir. Anormal kilo kaybı olasılığı şu durumlarda düşünülmelidir. (a) tartı ideal kilonun %90’ından az ise ya da, (b) istem dışı olarak en az 5 kg veya daha önceki 6 ayda non-ödematöz normal kilonun %7.5.’undan fazla kilo kaybı ve /veya beden kütle indeksinin (kilo/boy 2) 22kg.m²’den az olması Tedavinin amacı non-ödematöz kiloya ulaşmaktır, tercihen yeterli fiziksel egzersiz ile kas kütlesinin artırılmasıdır. Bulantı, dispne veya şişkinlik hissi nedeniyle azalmış gıda alımı olduğunda küçük, sık yemekler endikedir. Sigara İçme Sigaradan her zaman korkutulmalıdır. Sigarayı bırakma konusunda yardım kullanma için desteklenmelidir, bu destekler arasında nikotin replasman terapisi de olabilir (28). Seyahat Etme Fazla yükseklik veya çok sıcak ya da nemli yerlerden uzak durulmalıdır. Uzun uçak uçuşları problemlere (örn.dehidratasyon, ekstremitelerde aşırı ödem, derin ven trombozu) neden olabilir, hastalar uyarılmalıdır. Diüretiklerin ve vazodilatatörlerin kullanımı sıcak nemli iklimlerde aşırı sodyum ve sıvı kaybı olgularına neden olabilir (28). Cinsel Aktivite Eğer uygunsa cinsel aktiviteden önce dilaltı nitratların kullanımı ve major duygusallıktan kaçınılması tavsiye edilmelidir. NYHA sınıf 2 olan hastalar orta risk altındadır. Sınıf 3-4 cinsel aktivite ile tetiklenen kardiyak dekompansasyon için yüksek risklidir(28). Aşı Hakkında Tavsiye Kalp yetersizliği olan hastalarda aşının etkilerinin dökümante kanıtı yoktur. Pnömokok ve influenza aşıları kalp yetersizliğini kötüleştirebilen solunum yolu enfeksiyonlarının insidansını azaltabilir(29). İlaç Tavsiyesi Bütün ilaçların istenilen etkileri ve yan etkileri açıklanmalıdır. Kullanılmaması gereken ya da dikkat edilmesi gereken ilaçlar: 1. NSAİİ 2. Sınıf 1 antiaritmikler 25 3. Kalsiyum antogonistleri 4. Trisiklik antidepresanlar 5. Kortikosteroidler 6. Lityum İstirahat Stabil kronik kalp yetersizliğinde istirahat mutlak değildir. Hastanın klinik durumu düzeldikçe aktif mobilizasyon yapılabilir. Egzersiz Zorlu izometrik egzersizler, yarışmacı, zor sporlarda uzak durulmalıdır. Eğer hasta çalışıyorsa değerlendirilmeli ve devamı hakkında tavsiye verilmelidir (30). Egzersiz Eğitimi Pekçok klinik ve mekanik çalışmalar bazı randomize araştırmalar düzenli egzersizin fiziksel aktiviteyi %15-25 artırabildiğini semptomları ve stabil sınıf 2 ve 3 kalp yetersizliği hastalarının yaşam kalitesi algılarını artırdığını göstermiştir (30). Farmokolojik Tedavi Kronik Kalp Yetersizlikli Hastaların Tedavisinde Kullanılan İlaçlar: - Diüretikler Tiyazidler Loop diüretikleri Potasyum tutucu ajanlar Renin-anjiyotensın-aldosteron Sistem inhibitörleri ACE inhibitörleri AT reseptör blokerleri Aldosteron antagonistleri Beta adrenerjik reseptör blokerleri Kardiyoselektif beta blokerler Nonselektif beta blokerler Dijital glikozidleri Direkt vazodilatatörler İnorganik nitratlar Hidralazin Kalsiyum kanal blokerleri Vazodilatatör prostaglandinler Natriüretik peptidler Nörohormonal inhitörler İntravenöz pozitif inotropik ajanlar Dobutamin Fosfodiesteraz inhibitörleri Dopamin Sitokin inhibtörleri Endotelin antagonistleri Nötral endopeptidaz inhibitörleri TNF-alfa inhibitörleri Destek tedavi Antitrombotik ajanlar Antiaritmik ilaçlar 26 - Diğer Nesiritid Levosimendan ACE İnhibitörleri ACE inhibitörleri anjiyotensin I'in anjiyotensin II'ye dönüsümünden sorumlu olan enzimi inhibe ederek etki gösterir. Daha önce de belirtildigi gibi KY hastalarında kardiyak debinin azalması ile sempatik sinir sistemi ve renin-anjiyotensin sistemi (RAS) aktive olur. Bu aktivasyon sonucunda sistemik vasküler direnç ve afterload uygunsuz olarak artar, kardiyak performans daha da bozulur ve kısır bir döngü baslar. Sempatik sistemin ve RAS’nin uyarılması ile proksimal ve distal tübüllerden su ve sodyum emilimi artar, vazokonstrüktör etki ile arteryel ve venöz tonda artıs görülür, sonuçta preload ve afterload artar. ACE inhibitörleri kullanımı ile su ve sodyum reabsorbsiyonu azalır; potent vazokonstrüktör ajan olan anjiyotensin II'nin inhibisyonu ile arteryel ve venöz vazodilatasyon olusur, sistemik vasküler direnç azalır. ACE inhibisyonu ile bradikinin yıkılımı da azalır ve bradikinin düzeyi ve bradikininin stimüle ettigi prostaglandin ve nitrik oksit sentezi artar. Bu maddeler de vazodilatasyona ve natriüreze katkıda bulunurlar. Sonuçta preload ve afterload azalması ile dolus basınçları azalır, kardiyak debi artar. Pek çok deneysel ve klinik çalışmada ACE inhibitörlerinin sol ventrikül disfonksiyonunun progresyonu üzerine yararlı etkileri olduğu gösterilmiştir. ACE inhibitörlerinin ağır KY hastalarının prognozu üzerine etkilerini araştıran "Cooperative North Scandi-navian Enalapril Study (CONSENSUS)" çalışmasında semptomatik durumu NYHA sınıf IV olan toplam 253 hasta, kullandıkları konvansiyonel tedaviye ek olarak enalapril maleat veya plasebo gruplarına randomize edilmis ve altı ay sonunda enalapril kullanan grupta plasebo grubuna göre tüm nedenlere bağlı mortalitede %27 azalma izlenmiştir (31). Ayrıca, enalapril kullanan hastaların NYHA sınıflarında düzelme görülmüş, kalp boyutlarında ise anlamlı oranda küçülme saptanmıştır. Enalapril tedavisinin KY hastalarındaki mortalite ve morbidite üzerine etkilerini arastıran "Studies of Left Ventricular Dysfunction (SOLVD)" çalışmasında hafif-orta şiddette KY olan hastalar (NYHA sınıf II-III) izlenmiştir (32). Hastalar kullandıkları konvansiyonel tedaviye ek olarak plaseboya veya enalapril maleata randomize edilmişlerdir. Çalışma sonunda toplam ölümlerde %16, kardiyovasküler ölümlerde %18, progresif KY’ne bağlı ölümlerde ise %22 risk azalması saptanmiştir. KY’ne bağlı ölüm ve 27 hospitalizasyonlarda ise %26 risk azalması bulunmustur. SOLVD araştırmacıları tarafından enalaprilin asemptomatik sol ventrikül disfonksiyonu olan hastalarda mortalite ve morbidite üzerine olan etkilerini araştırmak için yapılan çalışmada ise hastalar ortalama 37.4 ay izlenmis, sonuçta toplam mortalitede %8, kardiyovasküler nedenlere bağlı mortalitede %12, semptomatik KY gelişme oranlarında ise %37 azalma saptanmiştir. Kalp yetersizliğine bağlı hospitalizasyon plasebo grubunda %12.9 olarak bulunurken, enalapril grubunda bu oran %8.7 olarak bulunmuştur (33). Bu çalışmaların ışığında ACE inhibitörleri KY tedavisinin en önemli ilaç grubundan birisi olmuştur. Kalp yetersizliği tedavisinde enalapril etkisini, ACE inhibitörleri kullanılmadan önce KY tedavisinde vazodilatör tedavi olarak kullanılan hidralazin-izosorbid dinitrat kombinasyonu ile karşılaştıran "Vasodilator Heart Failure Trial II (V-HeFT II)" çalışmasında NYHA sınıf II ve III grubundaki hastalar enalapril maleata veya hidralazin26 izosorbid dinitrat gruplarına randomize edilmişler ve ortalama 2.5 yıl boyunca izlenmişlerdir (34). Sonuçta iki yıl sonunda mortalite riskinde azalma enalapril grubunda kombinasyon grubuna göre %28 daha fazla bulunmuştur. ACE inhibitörlerinin "remodelling" üzerine etkilerini araştırmak için post-MI döneminde bu ilaçlar kullanılarak (MI sonrası ilk bir hafta içerisinde başlanarak) klinik çalışmalar yapılmıs ve tedavinin mortalite ve morbidite üzerine olan etkileri izlenmiştir. Bu çalışmalardan kaptopril ile yapılan "Survival and Ventricular Enlargement (SAVE)" çalışmasında birinci yıl sonunda %18, ramipril ile yapılan "The Acute Infarction Ramipril Efficacy (AIRE)" çalışmasında birinci yıl sonunda %22, trandolapril ile yapılan "Trandolapril Cardiac Evaluation (TRACE)" çalışmasında birinci yıl sonunda %16 mortalite azalması izlenmiştir (35-37). Bu çalışmalar sonucunda ACE inhibitörlerinin, anjiyotensin II'nin kardiyovasküler sistem üzerine hücresel düzeyde olan zararlı etkilerini (kardiyomiyosit hipertrofisi, kardiyomiyosit apopitozu, fibroblastlara olan mitogenik etki, presinaptik norepinefrin salgılanmasının kolaylastırılması) engelleyerek, kardiyak "remodelling" sürecine olumlu etkide bulundukları ve KY hastalarında kombine ölüm veya hospitalizasyon oranlarını azalttıkları anlaşılmıstır. ACE inhibisyonunun yararlı etkileri etyolojisi ne olursa olsun hafif, orta veya ağır derecede semptomlar gösteren tüm KY hastalarında izlenmiştir. ACE inhibitörleri sol ventrikül sistolik disfonksiyonuna bağlı KY bulguları gözlenen tüm hastalara, kontrendikasyonları yoksa başlanmalıdır (38,39). Daha önce 28 gözlenen ACE inhibitörlerine bağlı yasamı tehdit eden yan etkiler (anjiyoödem, anürik renal yetersizlik) varlığında ve fetal renal gelişim üzerine etkilerinden dolayı gebelikte, ACE inhibitörleri kullanımı kesin olarak kontrendikedir. Düşük kan basıncı durumlarında (sistolik kan basıncı 80 mmHg'nın altında), 3 mg/dL'nin üzerinde kreatinin veya 5.5 mmol/L'nin üzerinde serum potasyum değerlerinde ve bilateral renal arter stenozu varlığında dikkatle kullanılmalıdır. Düşük kan basıncı değerleri olup kardiyojenik şok riski altında olan hastalarda, ilk önce diğer KY tedavileri ile stabilizasyon sağlanıp daha sonra ACE inhibitörü tedavisi başlanmalıdır(38). ACE inhibitörü preparatlarının birbirlerine karşı üstünlüğü olup olmadığı ispatlanmamış olsa da klinik çalışmalarda mortalite ve morbidite üzerine etkinliği kanıtlanmış ACE inhibitörlerinin kullanılması tavsiye edilmektedir, çünkü bu ajanların hastalıgın doğal seyrini değistiren dozları bellidir. Geniş, kontrollü çalışmalarda kullanılan dozlara göre ACC/AHA kılavuzunda KY’de kullanılması önerilen ACE inhibitörleri ve dozları aşağıda görülmektedir (38). 3 Tablo 3. ACC/AHA klavuzunda KY’de kullanılması önerilen ACE inhibitörleri ve dozları İlaç Kaptopril Enalapril Lisinopril Kinapril Perindopril Ramipril Fosinopril Trandolapril Başlangıç dozu 6.25 mg 2.5 mg/gün 2.5-5 mg/gün 5 mg/gün 2 mg/gün 1.25-2.5 mg/gün 5-10 mg/gün 1 mg/gün Maximum doz 50 mg 10-20 mg 20-40 mg/gün 20 mg bid 8-16 mg/gün 10 mg/gün 40 mg/gün 4 mg/gün ACE inhibitörleri ile tedaviye düşük dozlar ile başlanmalı, hasta tolere ettiği sürece dozlar kademeli şekilde arttırılmalıdır. Tedavi başlangıcından itibaren ilk bir-iki hafta içerisinde renal fonksiyonlar ve serum potasyum değerleri degerlendirilmeli, özellikle daha önce hipotansif olanlarda, diyabetiklerde, böbrek fonksiyon testlerinde bozukluk saptananlarda, hiponatremiklerde ve potasyum desteği alan hastalarda periyodik olarak degerlendirilmelidir. Sıvı retansiyonunun ACE inhibitörlerinin yararlı etkilerini azaltması ve sıvı deplesyonunun ACE inhibitörlerinin yan etkilerini arttırıcı etkileri olması nedeniyle diüretikler ile hastanın sıvı durumu dikkatli şekilde ayarlanmalıdır. Kademeli şekilde klinik çalışmalarda etkinligi kanıtlanmıs dozlara 29 çıkılmalıdır. Lisinopril ile yapılan "Assessment of Treatment with Lisinopril and Survival (ATLAS)" çalışmasında yüksek dozlar ile hospitalizasyon riski azalmıs fakat yüksek dozlar ile düşük dozlar arasında semptomatik durum ve mortalite açısından fark saptanmamiştir (40). ACE inhibitörü tedavisi altında semptomatik düzelme olmasa bile, ölüm ve hospitalizasyon riskini azalttığı kanıtlanan bu ilaçlara devam edilmelidir. Hemodinamik olarak kararsız olan hastalarda, bu ilaçların hemodinami üzerine olan etkileri ile diüretiklerin ve iv vazokonstrüktör ajanların etkilerini değiştirebilmeleri nedeniyle özellikle diüretiklere dirençli vakalarda, stabilizasyon sağlanıncaya kadar bu ilaçların kesilmesi yerinde olacaktır. Geniş ölçekli çalışmalarda aspirinin kinine bağlı prostaglandin sentezini azaltalarak ACE inhibitörlerinin hemodinamiye olan yararlı etkilerini azaltabilecegi iddia edilmiştir. Ancak henüz eldeki kanıtlar günlük uygulamada iki ajanın birlikte kullanılmamasını sağlayacak düzeyde degildir (38, 39, 41). Şüphe varsa aspirin dışı bir antiplatelet ajan kullanılabilir (örnegin; klopidogrel). ACE inhibitörü tedavisinin en sık gözlenen yan etkisi hipotansiyondur. Özellikle dozların kademeli olarak arttırıldığı dönemde, hipovolemiklerde ve şiddetlii hiponatremisi olanlarda hipotansiyon gelişme riski daha yüksektir. Tedavi sırasında hipotansiyon gelişirse, birlikte kullanılan diüretik dozu azaltılmalı ve/veya tuz alımı arttırılmalıdır. Tedavinin diğer sık görülen yan etkisi böbrek fonksiyonlarında bozulmadır ve bu yan etki özellikle renal perfüzyonunun RAS’ne bağlı olduğu hastalarda (NYHA sınıf IV veya hiponatremik hastalar) belirgindir. Risk, bilateral arter stenozu olan veya nonsteroid antiinflamatuvar (NSA") ilaç kullanan hastalarda belirgin derecede artmıstır. Renal fonksiyonlar genellikle birlikte kullanılan diüretik dozu azaltılarak düzeltilebilir. Sıvı retansiyonu nedeniyle diüretik dozunun azaltılamadığı durumlarda, kreatinin düzeylerinde hafif derecedeki yükselmeler kabul edilebilir. ACE inhibitörü tedavisi alan hastalarda, özellikle tedavi ile böbrek fonksiyon testi bozulanlarda, potasyum tutucu diüretik alanlarda ve oral potasyum desteği alan hastalarda hiperkalemi açısından dikkatli olunmalıdır. Tedavi altında kinin artısına bağlı olarak öksürük gözlenebilir, bu durumda öksürüğün pulmoner konjesyondan kaynaklanmadığından emin olunduktan sonra hasta tolere edebildiği sürece tedaviye devam edilmeli, tolere edemezse anjiyotensin reseptör blokeri (ARB) ilaçlara geçilmelidir. 30 Tedavi altında %1'den az sayıda hastada anjiyoödem gelişebilir, bazen bu komplikasyon yaşamı tehdit edebilir. Böyle bir yan etkinin gözlendiği hastalarda ömür boyu tedavi kesilmeli ve böyle hikayesi olan hastalara ACE inhibitörleri başlanmamalıdır. Diüretikler Diüretiklerin sağkalım üzerine etkileri kontrollü, randomize çalışmalarda araştırılmamış olmasına rağmen sıvı retansiyonu olduğunda ya da pulmoner konjesyon, periferik ödem geliştiğinde bu ajanların kullanımı gereklidir. Diüretiklerin kullanımı dispnede hızlı düzelme ve egzersiz toleransında hızlı düzelme ile sonuçlanır (42).Diüretikler mümkün olduğunca ACE inhibitörleri ile kombinasyonda kullanılmalıdır (43). Hafif kalp yetersizliği tiazid diüretiklerle tedavi edilebilir ama kalp yetersizliği arttıkça loop diüretikler genellikle gerekli olur. Eş dozlarda bütün loop diüretikleri idrar çıkışında benzer artış sağlar. Şiddetli kalp yetersizliği olan hastalar genellikle loop diüretiklerinin dozunda artış gerektirir. Bu, böbrek fonksiyonlarının kötüleşmesi ya da furosemidin gastrointestinal emiliminin azalması nedeniyle olabilir. İntravenöz ilaç uygulaması ve özellikle sürekli intravenöz infüzyon diüretik direncinin gelişmesine neden olabilir. Glomerüler filtrasyon hızı 30 ml.dak ’in altına düştüğünde tiazid diüretikler daha az etkilidir, bu duruma kalp yetersizliği olan yaşlı hastalarda sık rastlanır. İleri evre kalp yetersizliğinde tiazidler loop diüretikler ile sinerjik etki gösterebilir ve kombinasyonda kullanılabilir. Bu kombinasyonun etkisi loop diüretiklerin dozunun artmasıyla oluşan etkinlik ve yan etkiler açısından değerlendirildiğinde daha üstündür (44). Potayum tutucu diüretikler Kalp yetersizliği için diüretik kullanan hastaların çoğu bir ACE inhibitörü ile de tedavi edilecektir. Yakın zamana kadar potasyum tutucu diüretikler ile ACE inhibitörleri potansiyel olarak tehlikeli görülmekteydi. Kontrollü çalışmalarda loop diüretikler ve ACE inhibisyonuna yanıt vermeyen hastalarda 50-200 mg gibi diürez ve natriüreze neden olan dozlarda spiranolakton uygulamasının hiperkalemiye neden olmadan hızlı kilo kaybına yol açtığı gösterilmiştir. Ancak triamteren, amilorid gibi güncel potasyum koruyucu diüretikler ve görece olarak yüksek dozlarda spiranolakton sadece uygun ACE inhibitör tedavisine rağmen sürekli diüretik ile tetiklenen hipokalemi 31 varsa ya da ACE inhibisyonu ve düşük doz spiranolaktona rağmen şiddetli kalp yetersizliğinde düşünülmelidir. ACE inhibisyon tedavisine ve anjiotensin reseptör blokerleri ile replasmanına intolerans olması da benzer kısıtlamalar ile ilgilidir. Oral potasyum takviyeleri diüretik tedavisi sırasında vücut potasyum depolarını sürdürmede daha az etkildir. Genel olarak bütün potasyum koruyucu diüretiklerin kullanımı serum kreatinin ve potasyumunun tekrarlayan ölçümleri ile izlenmelidir. Bu konudaki pratik yaklaşım, tedavi başlandıktan sonra her 5-7 günde bir serum kreatinin ve potasyum seviyelerinin değerler stabil oluncaya kadar ölçülmesidir. Bundan sonra her 3-6 ayda bir yapılabilir (45). Aldosteron reseptör antagonistleri-spiranolakton Önceden aldosteronun KY patofizyolojisindeki öneminin yalnızca sodyum retansiyonunu ve potasyum kaybını arttırması olduğu, KY tedavisinde verilen optimal dozdaki ACE inhibitörü tedavisinin aldosteron üretimini yeterince baskılayacağı düşünülmekte idi. Günümüzde, uzun süreli ACE inhibitörü tedavisi altında hem anjiyotensin II hem de aldosteron moleküllerinin kaçış fenomeni gösterdikleri bildirilmiştir (46). Aldosteron düzeyleri KY hastalarında, artan üretimden ve bozulan hepatik klerenste dolayı normal düzeyin 20 katına ulasabilir (46,49). Anjiyotensin II ve aldosteron konsantrasyonlarının sürekli yüksek seyretmesi endotel disfonksiyonu ve oksidatif stres artımı yolu ile anormal vazomotor reaktiviteyi ve baroreseptör disfonksiyonunu arttırır. Ayrıca, aldosteronun organ fibrozisini arttırıcı etkisi de bildirilmiştir (46). Tüm bu bilgiler ışığında aldosteron antagonizminin KY hastalarındaki etkisini araştırmak için 1999 yılında EF’nun %35 ve altında olduğu, ACE inhibitörü, loop diüretiği, çogu vakada digoksin ve az bir kısımda beta-bloker tedavisi altında olan 1,663 hastanın çalısıldığı plasebo kontrollü "The Randomized Aldactone Evaluation Study (RALES)" çalışması düzenlenmiş, toplam mortalitede %30 azalma tespit edilmiştir (47). 25 mg spironolakton kullanılarak yapılan bu çalışmada, bu düşük doz ile ventriküler fonksiyonlarda iyileşme saptanmıs, efor kapasitesinin arttığı izlenmiştir. Hem progresif KY’ne bağlı ölümlerde hem de ani kalp ölümüne bağlı ölümlerde azalma saptanmiştir. Bu sonuçlardan sonra spironolakton tedavisi KY tedavisinin bir parçası olarak kabul edilmis, 2005 yılı ACC kılavuzunda diüretik, digoksin, ACE inhibitörü ve beta-bloker tedavisi altında halen semptomatik ağır KY olan hastalara spironolakton başlanması 32 önerilmiştir (38). Bu kılavuza göre, tedavi başlangıcında hastanın potasyum düzeyi 5.0 mmol'ün, serum kreatinin degeri ise 2.5 mg/dL'nin altında olmalıdır. Hayatı tehdit eden bradiaritmilere neden olabilen hiperkalemi gelişme riski nedeniyle tedavi sırasında potasyum düzeyleri yakından takip edilmeli, serum potasyum degerleri 5.0 mmol/L'nin üzerine çıkarsa dozlar azaltılmalı veya kesilmelidir. RALES çalışmasında tedaviye bağlı yan etkiler olarak hiperkaleminin yanında ağrılı jinekomasti de bildirilmiştir. Spironolakton tedavisinin hafif-orta şiddetlii kalp yetersizliği hastalarındaki rolü hakkında yeterli veri olmadığı için ACC kılavuzunda, bu hastalara rutin spironolakton tedavisi önerilemediği belirtilmiştir. Aldosteron antagonistlerinin "remodelling" üzerine etkisini arastırmak için düzenlenen ve 2003 yılında yayınlanan "Eplerenone Post-Acute Myocardial Infarction Heart Failure Efficacy and Survival Study (EPHESUS)" çalışmasında selektif bir aldosteron antagonisti olan eplerenon tedavisinin sol ventrikül disfonksiyonu ile komplike olmuş (EF %40) MI sonrası mortalite ve morbidite üzerine olan etkileri araştırılmiştir.(48) Eplerenon tedavisi alan grupta 16 aylık takip sonunda %15 mortalite azalması bildirilmiştir. KY’ne bağlı hospitalizasyonda ise %15 azalma saptanmıştır. Spiranolaktonun uygulanması ve dozajı 1. ACE inhibitörü/diüretik kullanımına rağmen şiddetli kalp yetersizliği olan hastalarda düşünülür. 2. Serum potasyumu (< 5.0 mg) ve kreatinini kontrol edin. (<250 μmol.1¯¹) 3. Günlük 25 mg spiranolakton ekleyin. 4. 4-6 gün sonra serom potasyum ve kreatinini kontrol edin. 5. Eğer herhangi bir zamanda serum potasyumu > 5-5.5 mg ise dozu %50 azaltın. Eğer serum potasyumu >5.5 mg ise sonlandırın. 6. Eğer bir ay sonra semptomlar devam ediyorsa ve normokalemi varsa dozu günlük 50 mg arttırın. Bir hafta sonra serum potasyum ve kreatinini kontrol edin. Anjiotensin 2 reseptör antagonistleri Anjiyotensin reseptör antagonistleri, anjiyotensin II etkilerini anjiyotensin I reseptör seviyesinde bloke eder. Anjiyotensin II üretiminde ACE dışında başka yolların da bulunması ve kronik ACE inhibitörü tedavisi altında gözlenen kaçıs fenomeninden dolayı, bu ajanların RAS üzerine daha spesifik etkileri olduğu düşünülebilir. Ancak bu ajanlar ile ACE inhibitörleri tedavisi sırasında gözlenen ve tedaviye katkısı olduğu 33 düsünülen kinin düzeyinde yükselme beklenmez. ARB grubu ilaçlarla yapılmış klinik çalışmalardan elde edilen deneyim ACE inhibitörlerine kıyasla sınırlıdır, ancak bugüne kadar KY hastaları üzerinde yapılan çalışmalarda ARB'nin etkinliğinin ACE inhibitörleri ile benzer olduğu, fakat üstün olmadığı saptanmıstır. Kronik KY'de ACE inhibitörleri ve ARB kombinasyonu ise ek bir fayda saglamamiştir (38,49). Semptomatik sol ventrikül disfonksiyonu olan hastalar üzerine yapılan bir çalışmada [Valsartan in Heart Failure (Val-HeFT)], ACE inhibitörü tedavisine valsartan eklenmesi, kombine ölüm ve kardiyovasküler olay oranlarında azalmaya, KY klinik bulgu ve semptomlarında düzelmeye neden olmustur (50). Ancak ACE inhibitörü, betabloker ve valsartan alan grupta yan etki oranı ve mortalite artmıstır. “Candesartan in Heart Failure-Assessment of Reduction in Mortality and Morbidity (CHARM)” çalışmasında kronik KY olan hastalarda kandesartan, beta blokerler ile olumsuz etkileşime girmediği öne sürülmüstür (51). Bu bilgiler ışığında ACC kılavuzu, KY tedavisinde ARB'lerin ACE inhibitörlerine tercih edilmemesini, ancak ACE inhibitörü tedavisi altında kinin metabolizmasındaki değişikliklerden kaynaklanan, hastanın tolere edemeyeceği şiddette öksürük veya anjiyoödem gelişmesi halinde ACE inhibitörü yerine kullanılmasını önermektedir. Aynı kılavuzda, ARB'nin ACE inhibisyonu ile kombinasyonu hakkında yorum yapmak için ek çalışmalara ihtiyaç duyulduğu, mevcut bilgiler ışığında ACE inhibitörleri ile ARB yerine beta-bloker kombinasyonunun daha yararlı olduğu ifade edilmiştir. Geniş, kontrollü çalışmalarda kullanılan dozlara göre ACC/AHA kılavuzunda KY’de kullanılması önerilen ARB ve önerilen dozlar aşağıda görülmektedir (38). Tablo 4. ACC/AHA klavuzunda KY’de kullanılması önerilen ARB ve dozları; İlaç Kandesartan Losartan Valsartan Başlangıç dozu 4 - 8 mg/gün 25 - 50 mg/gün 20 - 40 mg Maximum doz 32 mg/gün 50 - 100 mg/gün 160 mg Kardiyak Glikozidler Kardiyak glikozidler atrial fibrilasyon ve sol ventriküler disfonksiyona bağlı olan ya da olmayan herhangi bir derecedeki semptomatik kalp yetersizliğinde ventriküler hızı yavaşlatmak amacıyla ve böylece fonksiyon ve semptomları düzeltmek için endikedir(52). Sinüs ritminde, ACE inhibitör ve diüretik tedavisine rağmen sol 34 ventriküler sistolik disfonksiyona bağlı persistan kalp yetersizliği semptomları olan hastaların klinik durumlarını iyileştirmek için digoksin önerilir(53). Digoksin ve dijitoksin en yaygın kullanılan kardiyak glikozidlerdir. Farmokodinamik etkileri aynıdır ancak farmokokinetik profilleri farklıdır. Digoksinin eliminasyonu renaldir. Buna karşılık dijitoksin karaciğerde metabolize edilir ve böbrek fonksiyonlarına daha az bağımlıdır, renal disfonksiyonlu yaşlı hastalarda potansiyel olarak faydalıdır (53). Kalp yetersizliğinde digoksin için endikasyon ve birincil fayda semptomları azaltmak ve klinik durumu iyileştirmek ve böylece sağkalıma etki etmeden kalp yetersizliği için hastaneye yatış riskini azaltmaktır (53). Kardiyak glikozidlerin kullanımının kontrendikasyonu bradikardi, ikinci ya da üçüncü derece AV blok, hasta sinüs sendromu, Wolff-Parkinson-White sendromu, hipertrofik obstruktif kardiyomiyopati, hipokalemi ve hiperkalsemidir (54). Digoksin Kronik KY’nin uzun dönem tedavisinde digoksin; ACE inhibitörleri, beta-bloker ajanlar ve loop diüretikleri ile birlikte kullanılır. Yarar en fazla NYHA sınıf III ve IV olan hastalarda görülür. Bu durumlarda digital tedavisine dolaşımın yanıtı, venöz basınçlarda ve ventrikül doluş basınçlarında azalma ve kardiyak debide artma ile karakterizedir. Kalp hızı yavaşlar, EF’nu artma eğilimindedir. Bu etkilerin vagal afferent sinir liflerindeki Na-K ATP ase inhibisyonuna bağlı kardiyak baroreseptör sensitizasyonuna, dolayısıyla santral sinir sisteminden çıkan sempatik outflow'daki azalmaya bağlı olduğu düşünülmektedir. Ayrıca, böbrek tübüllerindeki Na-K ATP ase inhibisyonu ile distal tübüllere sodyum sunumu artar,bunun sonucu olarak böbrekten renin salınımı azalır. Tüm bu gözlemler digitalin KY hastalarının tedavisinde pozitif inotropik etkisinin yanında nörohumoral yanıtı da baskılayarak etkili olduğunu düşündürmektedir. Normal kalpte kontraktilite arttığı için miyokard oksijen tüketimi artarken, KY’nde digoksin tedavisi ile kalp boyutlarının küçülmesi, ventrikül duvar geriliminin azalması ve kalp hızının düsmesi neticesinde oksijen tüketimi azalır (49). Digoksin sempatik sinir sistemi aktivitesini azaltarak ve parasempatik sinir aktivitesini arttırarak supraventriküler taşikardide ventriküler yanıtı yavaslatır. Supraventriküler taşikardisi olan hastalar içinde digoksinden en fazla yarar görecek grup, akut veya kronik AF olan semptomatik ventriküler sistolik disfonksiyonu olan hastalardır (49,55). Bu hastalarda yüksek ventriküler hız varlığında kalbin diyastol süresi kısalır. Sistolik disfonksiyon nedeniyle diyastol sonu basıncı artmıs sol ventrikülü 35 olan KY hastalarında diyastol süresinin kısalması, pulmoner kenar (wedge) basıncını daha da yükselterek pulmoner konjesyon semptom ve bulgularında artışa neden olur. Bu hastalarda digoksin ile hız kontrolü pulmoner konjesyon semptomlarının azalmasını sağlar. Uzun yıllar boyunca normal sinüs ritminde olan kalp yetersizlikli hastalarda digoksinin terapötik etkisi tartışma konusu olmustur. Digoksinin KY olan hastalarda yararlılıgını arastıran birçok klinik çalışma yapılmıstır. 1993 yılında yayınlanan "Prospective Randomized Study of Ventricular Failure and Efficacy of Digoxin (PROVED)" ve "Randomized Assessment of Digoxin on Inhibitors of Angiotensin Converting Enzyme (RADIANCE)" çalışmalarında; NYHA sınıf II-III semptomları bulunan ve ejeksiyon fraksiyonu %35 ve altında olan hastalarda digoksinin tedaviden kaldırılmasının etkileri arastırılmiştir (56,57). Bu çalışmalar sonucunda digoksin tedavisi kesilen grupta ACE inhibitörü ve diüretik tedavisinin devamına rağmen, digoksinin kesilmediği hasta grubuna göre semptomlarda belirgin kötüleşme saptanmış, efor kapasitesi ve EF’nda belirgin düşme izlenmiştir. 1997 yılında yayınlanan "The Digitalis Investigation Group Study (DIG)" çalışmasında tümü sinüs ritminde olmak üzere EF %45 ve altında olan 6,800 hasta ile EF %45'in üzerinde olan 988 hasta, aldıkları tedaviye ek olarak digoksin veya plasebo gruplarına randomize edilmiş ve ortalama 37 ay izlenmiştir (58). Çalışma sonunda EF % 45 ve altında olan hastalarda digoksin tedavisi ile KY’nin kötüleşmesine bağlı hospitalizasyonda anlamlı derecede azalma görülmüş, mortalitede ve miyokardiyal iskemi veya aritmi görülme sıklıgında plasebo ile anlamlı farklılık saptanamamiştir (58). Tüm bu gözlemler ışığında günümüzde ACE inhibitörü, beta-bloker ve diüretik kullanımına rağmen halen semptomatik (NYHA sınıf II-IV) olan hastalarda ve ağır KY (NYHA sınıf IV) olan tüm hastalarda tedaviye digoksin eklenmesi önerilmektedir (38,59). Bu durumlarda digoksin tedavisi ile KY semptomları azalmakta, efor kapasitesi ve kardiyak performans artmakta, KY’ne bağlı hastaneye yatışlarda azalma görülmektedir. Tüm bu etkilerine rağmen, sağkalım üzerine digoksinin yararlı etkisi olduğu gösterilememiştir(38, 39, 60, 61). ACC kılavuzu tedaviye günlük 0.125 ile 0.25 mg arası dozlarla başlanmasını önermektedir. Yetmiş yaş üzerindeki hastalarda, renal fonksiyonları bozulmuş hastalarda veya düşük beden kitle indeksine sahip hastalarda düşük dozlar 36 kullanılmalıdır (günlük veya gün asırı 0.125 mg). Kalp yetersizliği tedavisinde yüksek dozlara (0.375-0.50 mg) nadiren ihtiyaç duyulur. Kalp yetersizliği tedavisi için hastalara yükleme dozu verilmesine gerek yoktur (38). Serum digoksin seviyelerine göre doz belirlenmesinin yararı ispatlanmamıştır. Serum digoksin düzeyi takibi ilaç toksisitesi degerlendirilmesinde degerlidir. Son veriler, düşük serum digoksin seviyesinin (< 0.09 ng/mL) kardiyovasküler olay sıklığını azaltmada yüksek düzeyler kadar etkili olduğunu ve düşük dozlarda toksik etkilerin daha az gözlendiğini göstermektedir (60). Beta-Blokerler Kalp yetersizliğinin tanınmaya başlandıgı 100 yıl öncesinden başlayarak şiddetli KY’nde taşikardi, kütanöz vazokonstrüksiyon, diaforez ve azalmış idrar miktarı izlenmiş, tüm bu bulguların KY’nde artmıs olan adrenerjik aktiviteden kaynaklandığı düşünülmüstür. Bu görüş 40 yıl önce florometrik assay KY hastalarında serum norepinefrin düzeylerinde artışın ve kardiyak nörotransmiter depolarında azalmanın gösterilmesi ile desteklenmiştir. Adrenerjik sistem aktivasyonunun, disfonksiyone ventrikül üzerine pozitif inotropik etki yaptığı ve olusturduğu vazokonstrüksiyon ile düşük kardiyak output varlığında vital organların perfüzyonuna yardımcı olduğu düşünülmüstür. Bu hipotez kısa dönemli betabloker uygulaması ile şiddetlii KY hastalarında hayatı tehdit edecek derecede yetersizlik bulgularının artmasının izlenmesi ile desteklenmiştir (49). Günümüzde adrenerjik sinir sistemi ile yetersizlikli kalp arasındaki iliskinin ilk zamanlarda düsünüldügünden çok daha kompleks olduğu anlaşılmiştir. Kalbin kronik olarak artmış adrenerjik sistem ile uyarılması hipertrofiye, iskemiye ve kardiyomiyositler üzerinde büyüme ve oksidatif stres artışına yol açarak programlı hücre ölümüne (apopitoz) neden olmaktadır (49,55,62). Ayrıca, artmıs sempatik tonus, yol açtığı hipokalemiye egilimin de yardımı ile kardiyomiyositlerin otomatisite özelliklerini arttırmakta, aritmi gelişmesini kolaylastırmaktadır. Tüm bu zararlı etkiler alfa-1, beta-1 ve beta-2 reseptörleri aracılıgıyla olusturulmaktadır. Adrenerjik sinir sisteminin disfonksiyone ventrikül üzerine olumsuz etkileri olduğu, KY hastalarında beta-blokajın klinik seyir üzerine olan etkilerinin araştırıldığı klinik çalışmalarla da desteklenmiştir. Orta siddette semptomatik hastaların (NYHA sınıf II-III) çalısıldıgı geniş, randomize, plasebo kontrollü çalışmalar olan "U.S Carvedilol Heart Failure Trials Program", "Metoprolol CR/XL Randomized Intervention Trial in Congestive Heart 37 Failure Study (MERIT-HF)" ve "Cardiac Insufficiency Bisoprolol Study II (CIBIS II)" çalışmaları aktif tedavi grubunda gözlenen anlamlı mortalite ve morbidite azalmasından dolayı erken sonlandırılmiştir (63-65). "The Carvedilol Prospective Randomized Cumulative Survival (COPERNICUS)" çalışmasında şiddetlii KY olan hastalarda da (NYHA sınıf IV) karvedilol verilen grupta anlamlı mortalite ve morbidite azalması saptanmıstır (66). "Carvedilol Post Infarct Survival Control in Left Ventricular Dysfunction (CAPRICORN)" çalışmasında postinfarktüs sol ventrikül disfonksiyonu olup, ACE inhibitörü kullanan hastalarda tedaviye karvedilol eklenmesinin etkileri araştırılmış ve hem ACE inhibitörü hem de beta-bloker kullanan grubun en iyi prognoza sahip oldukları gösterilmiştir (67). Beta-bloker ajanların sol ventrikül fonksiyonları ve boyutları üzerine olan etkisi çok olumludur. Sol ventrikül sistolik fonksiyon bozukluğu olan KY hastalarında sol ventrikül "remodelling"ini ve EF’nu bu derecede iyileştirdigi gözlenen başka bir farmakolojik ajan yoktur (49). Bu nedenle beta-bloker tedaviye herhangi bir kontrendikasyon yoksa sol ventrikül disfonksiyonuna bağlı stabil KY bulguları gösteren tüm hastalara, hastalık progresyonunun engellenmesi için beta-bloker başlanmalıdır (68). Tedavinin uzun dönemde izlenen bu yararlı etkilerine rağmen tedavi başlangıcından sonra kısa dönemde klinikte ağırlasma izlenebilir. Beta-adrenerjik blokajın erken döneminde ilk haftalarda azalan sol ventrikül EF, dört hafta içinde düzelir ve sonra giderek artar. Bu nedenle beta-bloker tedavisine küçük dozlarla başlanmalı, hastanın tolerabilitesine göre doz arttırılmalıdır. Örnegin; çalışmalarda karvedilole günde iki kez 3.125 mg, bisoprolole günde 1.25 mg, metoprolole günde 5 mg dozunda başlanıp doz giderek arttırılmıstır. Ulasılması gereken hedef dozlar olarak çalışmalarda etkinliği kanıtlanmıs dozlar hedef alınmalıdır. Bu dozlar karvedilol için 50-100 mg/gün, bisoprolol için 5-10 mg/gün, metoprolol için 150-200 mg/gündür (69). 2005’de güncellenen ESC kronik kalp yetersizliği tanı ve tedavisi klavuzunda nebivolol, etkinliği kanıtlanmıs beta blokerler sınıfında sınıf I, kanıt düzeyi A olarak önerilmektedir. Başlangıçta sıvı retansiyonu olan hastalar, kısa dönemde sıvı retansiyonu artısı ve semptomlarda ağırlaşma açısından en fazla risk altında olan hastalardır. Bu nedenle tedaviye başlanmadan önce hastanın sıvı retansiyonu bulguları göstermediginden emin olunmalıdır. 38 Tedavi başlangıcından sonra hastalar günlük kilo takibi ve kötülesen KY bulguları açısından dikkatle takip edilmeli, semptomlar eslik etsin veya etmesin vücut agırlıgında artıs gözlendiginde birlikte verilen diüretik dozu arttırılmalıdır. Beta-bloker tedavinin başlangıcından sonra, özellikle alfa-bloker özelligi de olan ajanların (karvedilol) kullanılmasından sonra semptomatik hipotansiyon izlenebilir. Karvedilolün vazodilatör etkileri özellikle tedavi başlangıcından veya doz artımından 24-48 saat sonra görülür ve genellikle tekrarlayan dozlardan sonra doz değişikligi yapılmasa bile kaybolur. Semptomatik hipotansiyon gelişme riski ACE inhibitörünün ve beta-blokerin günün değişik zamanlarında verilmesi ile azaltılabilir. Bu yaklaşım etkisiz olursa ACE inhibitörünün dozu geçici olarak azaltılabilir. Bu durumda diüretik dozu da azaltılabilir, fakat diüretik dozunun azaltılması beta-bloker tedavinin kısa dönemdeki olumsuz etkilerinin görülme riskini arttırır. Bu şekilde dikkatli izlem ile dozlar titre edilerek arttırılırsa hastaların yaklasık %85'inde tedavinin kısa dönem ve uzun dönemde iyi tolere edildigi ve hedeflenen dozlara çıkılabildigi bildirilmiştir (38). Hedef dozlara çıkıldıktan sonra tedavinin idamesinde genellikle her hangi bir sorunla karşılaşılmaz. Hastalara tedaviye klinik cevabın hemen gözlenmediği anlatılmalı, semptomlarda azalma olmasa bile uzun dönem tedavinin majör klinik olayları engellemek açısından önemi belirtilmelidir. Tedavinin ani kesilmesinden, klinik dekompanzasyona yol açabileceği için kaçınılmalıdır. Uzun dönem beta-bloker tedavisi altında olan hastalarda klinik bozulma izlenirse, beta-bloker tedavinin kesilmesi kliniği daha da bozacaktır. Sıvı retansiyonu bulguları gelişen hastalarda diüretik dozu arttırılmalı, beta-bloker tedaviye devam edilmelidir. Eğer klinik dekompanzasyon, hipoperfüzyon bulguları ile karakterize ise veya pozitif inotropik destek gerekiyorsa beta-bloker tedavi aşamalı olarak kesilmeli, klinik düzeldikten sonra aşamalı olarak tedaviye tekrar başlanmalıdır. Beta-bloker tedavi altında gelişebilecek diğer bir yan etki bradikardi veya kalp bloklarıdır. Bu etkiler genellikle asemptomatik olmakla birlikte hemodinamiyi bozacak oranda bradikardik olan veya ikinci veya üçüncü dereceden kalp bloğu gelişen hastalarda dozun azaltılması, hatta tedavinin kesilmesi gerekebilir (38,68). Yapılan çalışmalarda kullanılan dozlara göre ACC/AHA kılavuzunda KY’de kullanılması önerilen Beta-blokerler ve dozları aşağıda görülmektedir (38). 39 Tablo 5. ACC/AHA klavuzunda KY’de kullanılması önerilen Beta-bloker ve dozları İlaç Başlangıç dozu Bisoprolol 1.25 mg/gün Karvedilol 3.125 mg Maximum doz 10 mg /gün 25 mg, 50 mg (> 85 kg hastalar) Metoprolol succinate 12.5 - 25 mg/gün 200 mg/gün Kalsiyum Antagonistleri Genel olarak sistolik disfonksiyona bağlı kalp yetersizliğinde kalsiyum antogonistleri önerilmez. Diltiazem ve Verapamil tipi kalsiyum antagonistleri sistolik disfonksiyona bağlı kalp yetersizliğinde önerilmez ve beta blokerler ile kombinasyonu kontrendikedir. ACE inhibitörleri ve diüretikleri içeren başlangıç tedavisine ek olarak yeni kalsiyum antagonistlerinin (felodipin, amlodipin) kullanılması sağkalım üzerinde plasebodan daha iyi etki göstermez. Felodipin ve amlodipin ile uzun süreli güvenlik verileri sağkalıma nötral etki gösterir, eşzamanlı arteriyel hipertansiyon veya anginada ek tedavi olarak düşünülebilir (70, 71). Pozitif inotropik tedavi İnotropik ajanlar yaygın olarak kalp yetersizliği epizodlarının şiddetini sınırlamada ya da terminal evre kalp yetersizliğinde kalp transplantasyonu için köprü olarak kullanılmaktadır. Ancak tedavi ile ilişkili komplikasyonlar olabilir ve bunların prognoza etkisi henüz tam olarak bilinmemektedir. Oral inotropik ajanlar ile tekrarlayan ya da uzun süreli tedavi mortaliteyi artırır. Güncel olarak kalp yetersizliği tedavisinde dopaminerjik ajanları önermek için mevcut veriler yetersizdir. Pozitif İnotropik Ajanlar İntravenöz inotropik ajanlar kötüleşen kalp yetersizliğinin şiddetli epizodlarının hemodinamik bozukluklarını düzeltmede kullanılmaktadır. Bu nedenle en sık kullanılan ajan dobutamindir. Dobutaminin kullanımı ile ilişkili problemler taşiflaksi, kalp hızında artış ve genellikle yetersiz vazodilatatör etkidir. Benzer problemler diğer cAMP bağımlı inotroplarda da mevcuttur, örneğin amrinon, milniron veya enoksimon gibi fosfodiesteraz inhibitörleri (71). 40 Dopaminerjik Ajanlar Güncel olarak oral dopamin analoglarının kalp yetersizliği tedavisinde önerilmesi için mevcut veriler yetersizdir. Kötüleşen kalp yetersizliğinin şiddetli ataklarının hemodinamik bozukluklarının kısa süreli düzeltilmesi için intravenöz dopamin kullanılmaktadır. Düşük dozlarda (3-5 μg/kg/dk) böbrek kan akımını artırabilir. Kullanımı prospektif kontrollü çalışmalarda araştırılmamıştır ve progresyona etkisi iyi ortaya konmamıştır (72). Antitrombotik Ajanlar Antitrombotik tedavinin kalp yetersizliği olan hastalarda atriyal fibrilasyondan başka antikoagülasyonun kesin olarak endike olduğu vasküler olayları veya ölüm riskini modifiye ettiğini gösteren az kanıt vardır. Atriyal fibrilasyonu olan kalp yetersizliği hastalarında oral antikoagülanlar inme riskini azaltır. Ancak sinüs ritmi olan hastalarda daha önce vasküler olay geçirmiş ya da intra-kardiyak trombüs kanıtları olsa bile antitrombotik tedavinin kullanımını destekleyen kanıtlar eksiktir. Sol ventriküler trombüslü hastalarda tromboembolik olaylar riskinin arttığını destekleyen kanıtlar azdır. Kalp yetersizliği akut dekompansasyonu olan pek çok hastada hastaneye yatış ve yatak istirahati gereklidir. Böyle hastalar ile yapılan randomize kontrollü çalışmalar düşük moleküllü heparinlerin yüksek dozlarda kullanıldığında derin venöz tromboz riskini azaltabileceğini düşündürmektedir. Başka ülkelerde yürütülen çalşmalarda mortalitede azalma eğilimi görülmesine rağmen (pulmoner embolizmin olası prezentasyonu) pulmoner embolizm riskinde azalma gösterememiştir. Fraksiyone olmayan heparinlerin kullanımını destekleyen kanıtlar ve heparinler arasında karşılaştırmalı çalışmalar yoktur. Kalp yetersizliği olan ve yatak istirahatindeki hastalar düşük moleküler ağırlıklı heparinleri kullanmalıdır (73). Antiaritmikler Genel olarak kalp yetersizliğinde antiaritmiklerin kullanımı için endikasyon yoktur. Sınıf 1 antiaritmikler Sınıf 1 antiaritmikler, ventriküler seviyeye proaritmik etkileri ve hemodinamiklere ve kalp yetersizliğinin prognoza advers etkileri olabileceği için kaçınılmalıdır. 41 Sınıf 2 antiaritmikler Beta blokerler kalp yetersizliğinde ani ölümü azaltır. Ayrıca sürekli olan veya olmayan ventriküler taşiaritmilerin tedavisinde tek başına ya da amiodoron veya nonfarmokolojik tedavi kombine olarak endike olabilir (74). Sınıf 3 antiaritmikler Amiodaron, supraventriküler ve ventriküler aritmilerin çoğuna karşı etkilidir. Kalp yetersizliği ve atriyal fibrilasyonu olan hastalarda (genişlemiş sol atriyum olsa bile) sinüs ritmini düzeltebilir veya sürdürebilir ya da elektroversiyonun başarısını artırır ve bu durumda tercih edilen tedavidir. Amiodaron klinik ile ilişkili negatif inotropik özelliği olmayan tek antiaritmiktir. Hiper ve hipotiroidizm, hepatit, pulmoner fibrozis ve nöropati gibi advers etkiler son dönemdeki geniş, plasebo kontrollü çalışmalarda görece olarak düşük görülmesine rağmen amiodaronun potansiyel faydalarını dengelemelidir. Düşük dozlarda (100-200 mg.gün) riski azaltabilir (74). Levosimendan Kalp yetersizliğinin ilerlemesi, yaşam kalitesinin azalmasına, tekrar hastaneye yatışların artmasına, morbidite ve mortalitenin yükselmesine yol açmaktadır. Hastaların %40’ı bir yıl içinde akut dekompansasyona bağlı olarak hastaneye yatmaktadır. Tedavideki gelişmelere rağmen beş yıllık mortalite %60’a yakındır ve bu oran çoğu malignitenin mortalitesinden daha yüksektir(2). Kalp yetersizliğinin akut dekompansasyonunda diüretik, nitrat ve pozitif inotropları içeren yoğun intravenöz tedavi uygulanır. Bugüne kadar sıklıkla kullanılan ve semptomları ve morbiditeyi azaltan inotropik ajanların (beta-agonistler ve fosfodiesteraz III inhibitörleri -PDE III) başta mortaliteyi artırmak olmak üzere önemli dezavantajları vardır(5,6,75). Akut dekompanse kalp yetersizliğinde beta-adrenerjik agonistler ve fosfodiesteraz III inhibitörleri gibi pozitif inotropik ajanlar kısa dönemde önemli hemodinamik yararlar sağlamasına rağmen, uzun dönemde sağkalımı olumsuz etkilemektedir. Son zamanlarda, kalsiyum duyarlılaştırıcı ajanlar olarak bilinen ve tolere edilebilirliği ve etkinliği klasik inotroplara eşit ya da daha üstün olduğu ileri sürülen yeni bir grup inotrop kullanıma girmiştir. Akut dekompanse KY tedavisinde yeni bir grup olan kalsiyum duyarlılaştırıcı ajanlar, levosimendan, pimobendan, MCI-154, EMD-53998 ve EMD-57033’ten oluşur. 42 Bunlardan son üçü halen deneysel aşamada olan ilaçlardır(76,77). Pimobendanın klinik kullanımına yalnızca Japonya’da izin verilmiştir. Günümüzde klinik kullanımı en yaygın olan ilaç levosimendandır. Kalsiyum duyarlılaştırıcı ajanlar, cAMP ve hücre içi kalsiyum konsantrasyonunu artırmaksızın kalbin kontraksiyonunu artıran, yeni ve farklı bir inotrop grubu olarak sunulmuştur. Bunlar arasında levosimendan inotropik ve vazodilatör etkileri olan en güçlü ilaçtır. İlk çalışmalar levosimendanın hem kronik kalp yetersizliğinin akut dekompansasyonunda hem de miyokard infarktüsü sonrası gelişen akut kalp yetersizliğinde semptomları iyileştirdiğini, mortaliteyi azalttığını ve iyi tolere edildiğini göstermiştir. Yakın zamanda sonuçları açıklanan daha geniş çaplı çalışmalarda, levosimendan ile semptomları iyileştirmede plasebodan daha iyi, mortalite açısından ise hem plasebo hem de dobutamine benzer sonuçlara ulaşılmış; ancak, levosimendana bağlı aritmi sıklığında artış bildirilmiştir Etki mekanizması: Levosimendanın miyokardiyal kontraktiliteyi artırmadaki asıl etki mekanizması sitoplazmik kalsiyuma kardiyak troponin-C’nin duyarlılığını artırmasına dayanır(7881). Bu etkileşim tropomiyozinde kalsiyumun tetiklediği yapısal değişiklikleri stabilize ederek aktin-miyozin çapraz köprülerini güçlendirir. Bu inotropik etki sırasında hücre içi kalsiyum düzeyinin artmaması en önemli özelliktir; bu sayede adrenerjik inotropların neden olduğu hücre içi kalsiyum artışına bağlı kardiyak miyosit disfonksiyonu ve aritmi gibi önemli yan etkiler önlenmiş olur. Levosimendan ile olan duyarlılaşma kalsiyum konsantrasyonuna bağımlıdır ve bu nedenle kontraktil elemanlar sistolde inotropik etki sağlarken, diyastolde kalsiyum konsantrasyonu az olacağı için diyastolik gevşeme bozulmaz(79,80). Oysa, pimobendan ve diğer ilaçlarla sağlanan troponin-C’nin kalsiyuma duyarlılaşması hem sistolde hem de diyastolde olmaktadır; bu nedenle, bir yandan kontraktilite artarken diğer yandan diyastolik gevşeme bozulabilmektedir(78). Levosimendan vasküler düz kas hücrelerindeki ATP duyarlı potasyum kanallarının açılmasını sağlayarak arteriolar ve venöz dilatasyona neden olur(82,83). Bu etki mekanizması koroner, pulmoner ve sistemik vazodilatasyondan sorumludur. Ayrıca, levosimendan PDE III’ü selektif olarak inhibe eder. Diğer kalsiyum duyarlılaştırıcıların PDE inhibisyonu terapötik dozlarda izlenirken, levosimendanın bu etkisi yalnızca terapötik düzeyin üzerindeki dozlarda izlenmiştir(84). Levosimendan ile oluşan kontraktil performanstaki iyileşme ve vasodilatasyon, kalbin hem önyükünü hem 43 de ardyükünü azaltır. Bu süreç miyokardın oksijen tüketimini artırmadan meydana gelir. Ayrıca, koroner arterlerde dilatasyon yapıcı etkisi nedeniyle levosimendanın antiiskemik etkisi söz konusudur(85). Levosimendan ve pimobendanın, dekompanse kronik KY’li hastalarda proaritmik etki veya oksijen ihtiyacında artışa yol açmaksızın, egzersiz kapasitesini düzelttiği gösterilmiş olmasına rağmen, bu iki ajanın klinik profili önemli farklılıklar gösterir. PICO çalışmasının (Pimobendan in Congestive Heart Failure) bulguları pimobendanın hemodinamik açıdan yararlı etkilerine rağmen güvenilirliğini şüpheye düşürmüştür(86). Bu çalışmada, plasebo ile karşılaştırıldığında aritmik olmayan ölümlerin sıklığında anlamlı artış izlenmiştir. Bu sonuç, pimobendanın terapötik dozlarda PDE III’ü inhibe etmesi ile ilişkilendirilmiştir. Farmakokinetik özellikler ve eliminasyon: Levosimendan hızlı ve doğrusal bir dağılım gösterir. Sürekli sabit dozda infüzyon yapıldığında kararlı duruma 4. saatte ulaşır; ancak, daha hızlı etki istendiğinde yükleme dozu infüzyonu ile plazma doruk konsantrasyonuna 12 dakika sonra ulaşılır. Levosimendan %95-98 oranında plazma proteinlerine bağlanır. Eliminasyonu konjugasyon ve ekskresyon yoluyla karaciğer ve böbreklerde gerçekleşir. Eliminasyon yarı ömrü bir saattir. Levosimendan dozunun yaklaşık %5’i önce aktif bir metabolit olan OR-1855’e, daha sonra da daha aktif olan OR-1896’ya asetile edilir. OR-1896’nın oluşumu yavaştır ve doruk konsantrasyona infüzyonun kesilmesinden 1-2 gün sonra ulaşılır; %40’ı plazma proteinlerine bağlanır ve yarılanma ömrü yaklaşık 80 saattir. Buna paralel olarak, levosimendanın farmakolojik etkileri ilacın kesiminden sonra bir haftaya kadar devam eder(87). Levosimendanın metabolizmasından sorumlu enzim henüz tanımlanmamıştır; ancak, sitokrom P450’nin rol oynamadığı düşünülmektedir. Bu nedenle, itrakonazol, warfarin ve etanol gibi ajanlarla önemli bir farmakokinetik etkileşim izlenmemiştir. Yine levosimendanın pozitif inotropik etkisi karvedilol ve felodipin gibi beta-bloker veya kalsiyum kanal blokerlerinden etkilenmemiştir(8890). Klinik çalışmalar 1. Doz saptama çalışması. İskemik kaynaklı KY olan 151 hastada (NYHA sınıf II-IV) levosimendanın terapötik dozunu tanımlamak amacıyla tasarlanan randomize, çokmerkezli bir çalışmada dobutamin, plasebo ve etanol (levosimendan çözücüsü) infüzyonuna kıyasla 24 saatlik levosimendan infüzyonunun etkinlik ve güvenilirliği 44 değerlendirilmiştir. Levosimendan verilen 95 hasta beş doz grubuna ayrılmıştır: 3, 6, 12, 24, 36 µg/kg yükleme dozu ardından 24 saat süreyle sırasıyla 0.05, 0.1, 0.2, 0.4, 0.6 µg/kg/dk idame infüzyonu. Tedaviye olumlu yanıt, kalp debisinde %40 veya daha fazla artış ve pulmoner kapiller kama basıncında %25 veya daha fazla düşüş olarak kabul edilmiştir. Plaseboya %14, dobutamine %70 oranında olumlu yanıt alınırken, levosimendana yanıt doza bağımlı şekilde en düşük dozda %50, en yüksek dozda %86 bulunmuştur. En sık yan etkiler baş ağrısı (%9), hipotansiyon (%5) ve bulantı (%4) olarak saptanmıştır. Sonuçta, uygulanan bütün doz kombinasyonlarında levosimendan olumlu hemodinamik etki göstermiş ve iyi tolere edilmiştir(91). 2. Doz titrasyon çalışması. Kalp yetersizliği olan 146 hastada (NYHA sınıf IIIIV) yürütülen randomize, plasebo kontrollü bir çalışmada birincil amaç, 6 saatlik levosimendan infüzyonunun hemodinamik ve semptomatik etkilerini plasebo ile karşılaştırmak, ikincil amaç ise 24 saatlik levosimendan infüzyonunun süregelen etkilerini değerlendirmek olarak belirlenmiştir(92). Levosimendan uygulaması üç bölümde incelenmiştir. Birinci bölüm altı saatlik zaman dilimini içerir: 10 dakikada 6 µg/kg yüklemeyi takiben bir saatte 0.1 µg/kg/dk infüzyon sonrasında, eğer iyi tolere edilmişse, her saatin sonunda aynı dozda yüklemeyi takiben 0.2, 0.3 ve 0.4 µg/kg/dk infüzyonlar birer saatlik süreyle uygulanmıştır. İkinci bölümde plasebo verilmemiş ve birinci bölümün sonunda tolere edilen en yüksek dozun yarısı dozda infüzyon 24 saate tamamlanmıştır. Üçüncü bölümde ise, çift kör yöntemle, levosimendan hastalarının yarısı 24 saat daha infüzyon almaya devam etmiştir. Sonuçta, levosimendanın en düşük dozunda bile atım volümünde yaklaşık 12 ml, kardiyak indekste 0.7 l/dk/m2’lik bir artış sağlanmıştır. Plasebo ile karşılaştırıldığında, 6. saatte levosimendan anlamlı derecede daha yüksek oranda olumlu hemodinamik yanıta neden olmuştur (plasebo ile %17, levosimendan ile %80). Hastalardaki semptomatik iyileşme hemodinamik iyileşmeye paralel bulunmuştur. İnfüzyon kesildikten sonra olumlu hemodinamik yanıtların 24 saat sonra da devam ettiği gösterilmiştir(92). 3. LIDO çalışması (Levosimendan Infusion versus Dobutamine in severe low Output heart failure). Ejeksiyon fraksiyonu <%35, kardiyak indeksi <2.5 l/dk/m2, pulmoner kapiller kama basıncı >15 mmHg olan, dekompanse KY’li 203 hastanın (NYHA sınıf III-IV) alındığı uluslararası, çokmerkezli randomize bir çalışmadır.Levosimendan (103 hasta) 10 dakikada 24 µg/kg yüklemeyi takiben 0.1 µg/kg/dk infüzyon dozunda uygulanmış ve ikinci saatte hedeflenen hemodinamik yanıt 45 alınamayan hastalarda (69 hasta) infüzyon dozu iki katına çıkarılmıştır. Karşılaştırma grubu olarak 100 hastaya dobutamin (5-10 µg/kg/dk, 24 saat) uygulanmıştır. Birincil sonlanma noktası 24. saatteki hemodinamik yanıt (kalp debisinde >%30 artış ve pulmoner kapiller kama basıncında >%25 azalma), ikincil sonlanma noktaları ise KY belirti ve semptomlarındaki değişiklikler, tedavinin kesiminden altı saat sonraki hemodinamik etkilerin takibi ve 30 günlük mortalite olarak belirlenmiştir. Sonuçta, 24 saatlik tedavi sonrasında olumlu hemodinamik yanıt alınan hasta sayısı levosimendan grubunda anlamlı derecede daha fazla bulunmuştur (%28 ve %15, p= 0.022). Tedavinin kesilmesinden altı saat sonra da kalp debisi ve pulmoner kapiller kama basıncındaki değişiklikler levosimendan lehine anlamlı derecede farklılık göstermiştir. Semptomatik açıdan levosimendan grubunda daha fazla iyileşme görülmesine karşın, aradaki fark anlamlı bulunmamıştır. Dikkat çekici sonuçlardan biri de, dobutaminin olumlu hemodinamik etkilerinin beta-blokerler ile belirgin derecede azalmasına karşın, levosimendan grubunda bu olumsuz etkinin görülmemesidir(7). LIDO çalışmasının en önemli sonucu, levosimendanın mortaliteyi azalttığının gösterilmesidir. Otuz gün sonundaki ölüm oranı, levosimendan grubunda dobutamin grubuna göre anlamlı derecede daha düşüktür (%7.8 ve %17, p=0.045). Geriye dönük analizlerde, levosimendan lehine olan mortalite azalmasının 180 gün sonunda da devam ettiği bildirilmiştir (%26 ve %38, p=0.029). Bu sonuçlar, özellikle KY için dobutaminin kullanıldığı en büyük randomize çalışmada alınmış olması nedeniyle çok sayıda eleştiriye neden olmuştur(93). Dobutamin ile güçlü adrenerjik uyarılara maruz kalmak, hücre içi kalsiyumda, aritmi sıklığında ve kardiyak miyositlerde programlı hücre ölümünde artışa neden olarak hem kısa hem de uzun dönemde olumsuz etkilere yol açabilmektedir. Ayrıca, daha önceki çalışmalarda bildirilen dobutaminin sağkalım üzerine olumsuz etkileri de göz önüne alınarak, levosimendanın sağkalım üzerine olumlu etkisinin dobutamin ile karşılaştırılmasına veya tesadüfe bağlı olabileceği ileri sürülmüştür(93). 4. RUSSLAN çalışması (Randomized Study on Safety and Effectiveness of Levosimendan in Patients with Left Ventricular Failure due to an Acute Myocardial Infarct). Akut miyokard infarktüsü sonrasındaki beş gün içinde dekompanse KY gelişen 504 hastanın alındığı çokmerkezli, randomize, plasebo kontrollü bir çalışmadır. Levosimendan dört farklı rejimde, altı saatlik infüzyonla uygulanmıştır: 10 dakikada 6, 12 veya 24 µg/kg yüklemeyi takiben 0.2 µg/kg/dk 46 infüzyon veya 24 µg/kg yüklemeyi takiben 0.4 µg/kg/dk infüzyon. Birincil sonlanma noktası önemli hipotansiyon ve iskemi oranları, ikincil sonlanma noktaları ise 14 gün içinde dispne ve bitkinlik semptomlarındaki değişiklikler ve plasebo ile karşılaştırılan ölüm oranı idi. Sonuçta, hipotansiyon ve iskemi, en yüksek dozda levosimendan alan grupta daha fazla olmasına rağmen, plaseboya göre anlamlı farklılık göstermemiştir. Levosimendan grubunda dispne anlamlı derecede daha az kötüleşmiş; ancak, bitkinlik durumunda anlamlı fark saptanmamıştır. Yirmi dört saat sonunda, ölüm ve KY’de kötüleşme levosimendan grubunda belirgin olarak daha az (%4 ve %8.8, p=0.04); 14. günde bütün nedenlere bağlı ölüm sıklığı daha düşük bulunmuştur (%11.7 ve %19.9, p=0.03). Geriye dönük analizlerde, altı ay sonunda ölüm sıklığı levosimendan grubunda plaseboya göre, anlamlı derecede olmasa da, daha düşük izlenmiştir (%22.6 ve %31.4, p=0.05).(94) RUSSLAN çalışması, pozitif inotrop tedavisi sonucu akut miyokard infarktüsü sonrası mortalitenin artmadığı ilk çalışmadır(94) 5. CASINO Çalışması (Calcium Sensitizer or Inotrope or None in LowOutput Heart Failure). Sol ventrikül ejeksiyon fraksiyonu <%35 olan, dekompanse KY’li 299 hastanın alındığı bu çalışmada levosimendan dobutamin ve plasebo ile karşılaştırılmıştır.Birincil sonlanma noktaları KY’nin kötüleşmesine bağlı ölüm ve tekrar hastaneye yatış olan çalışmaya 600 hastanın alınması planlanmış; ancak, levosimendan kolunda sağkalımda belirgin üstünlük görülmesi üzerine çalışma 299 hasta ile erken sonlandırılmıştır. Altı aylık ölüm oranı, levosimendan grubunda hem dobutamin (%18 ve %42, p=0.0001) hem de plaseboya göre (%18 ve %28.3, p=0.03) belirgin derecede düşük bulunmuştur(95). Yukarıda bildirilen çalışmalar dışında, 2005 yılının Kasım ayında yapılan ACC/AHA toplantısında, levosimendan ile ilgili ileriye dönük iki büyük randomize çalışmanın ilk sonuçları sunulmuştur. Bu çalışmalar ve sonuçları aşağıda özetlenmiştir: REVIVE Çalışması (Randomized Multicenter Evaluation of Intravenous Levosimendan Efficacy). REVIVE çalışması, standart tedaviye eklenen levosimendanın akut dekompanse KY’nin klinik seyri üzerine etkisini standart tedaviyle karşılaştırmalı olarak değerlendiren ilk büyük, randomize, çift kör, plasebo kontrollü çalışmadır. Pilot çalışma olarak önce 100 hastanın alındığı REVIVE-1 çalışmasından sonra, REVIVE-2 çalışması 600 hasta ile Amerika Birleşik Devletleri, Avustralya ve İsrail’de yürütülmüştür. Çalışmanın birincil sonlanım noktası olarak, beş günlük sürede levosimendan tedavisinin KY’nin semptomları ve klinik bulguları üzerindeki etkileri 47 incelenmiştir. Levosimendan infüzyonu 6-12 µg/kg yükleme sonrası, 0.1 µg/kg/dk dozunda uygulanmış ve bir saat sonunda iyi tolere edilmiş ise 0.2 µg/kg/dk doza çıkılarak tedavi 24 saate tamamlanmıştır. Hastalar 6. saat, 24. saat ve 5. günde genel klinik değerlendirme sonucunda iyileşme olanlar, değişiklik olmayanlar ve kötüleşenler olarak üç gruba ayrılmıştır. Beş gün sonunda, levosimendan grubunda daha fazla iyileşme (%19.4 ve %14.6, p=0.015) ve daha az kötüleşme (%19.4 ve %27.2) izlenmiştir. İkincil sonlamın noktalarından biri olan serum BNP düzeyleri açısından, levosimendan grubunda plaseboya göre 24. saat ve 5. günde anlamlı düşüşler izlenmiştir. Başka bir ikincil sonlanım noktası olan 90 günlük mortalite açısından ise, levosimendan kolunda sayısal olarak daha fazla, ancak anlamlı farklılığa ulaşmayan ölüm görülmüştür (45 ve 35 hasta). Tedaviye bağlı yan etkiler(hipotansiyon, %50 ve %35; ventriküler taşikardi, %25 ve %17; atriyal fibrilasyon, %8 ve %2) levosimendan kolunda plaseboya göre daha sık izlenmiştir(8). SURVIVE Çalışması (Survival of Patients with Acute Heart Failure in Need of Intravenous Inotropic Support). SURVIVE çalışması, levosimendan ile dobutamin arasında mortaliteyi karşılaştıran, 1327 hastanın katıldığı, geniş çaplı, randomize, çift kör bir çalışmadır. Standart tedaviye ek olarak levosimendan 12 µg/kg yükleme dozu sonrasında 0.1-0.2 µg/kg/dk dozda 24 saat, dobutamin ise minimum 5 µg/kg/dk infüzyon ile 24 saatten daha uzun süre verilmiştir. Birincil sonlanım noktası olan 180 günlük mortalite açısından iki grup arasında anlamlı fark izlenmemiştir (p=0.401). Ancak, levosimendan kolunda, 180. günden geriye doğru, tedavinin uygulandığı 24 saatlik süreye yaklaştıkça mortalitenin daha iyi olduğu dikkat çekmiştir. Dobutamine göre 31. günde %14, 5. günde %28 mortalite azalması, levosimendanın mortalite üzerine en büyük etkisinin ilacın uygulanmasından sonraki ilk günlerde olduğunu düşündürmüştür. İkincil sonlanımlardan biri olan BNP düzeyleri levosimendan kolunda dobutamine göre anlamlı derecede düşük bulunmuştur. Diğer ikincil sonlanım noktalarından olan 180 günlük sürede hastane dışında yaşam süresi ve 24 saat sonunda dispne durumunda değişiklik yönünden iki grup arasında farklılık saptanmamıştır. Otuz bir gün içinde izlenen kardiyovasküler yan etkilerden hipotansiyon (levosimendan ile %15.5, dobutamin ile %13.9) ve ventriküler taşikardi (levosimendan ile %7.9, dobutamin ile %7.3) iki grupta benzer bulunurken, levosimendan kolunda atriyal fibrilasyon (%9.1 ve %6.1) ve kalp yetersizliğinde kötüleşme (%17 ve %12.3) daha sık izlenmiştir(9). 48 Sonuç olarak; LIDO ve CASINO çalışmalarında, akut dekompanse KY’de intravenöz levosimendan tedavisinin hemodinamik, semptomatik ve sağkalım yararlarının hem dobutamin hem de plaseboya göre daha üstün olduğu ve genel olarak iyi tolere edildiği bildirilmiştir. Sonuçları yakın zamanda açıklanan daha geniş çaplı REVIVE-2 ve SURVIVE çalışmaları göz önünde bulundurulduğunda ise, levosimendan semptomları iyileştirmede plasebodan daha iyi, BNP düzeylerini azaltmada hem plasebo hem de dobutaminden daha iyi bulunmuş; mortalite açısından ise hem plasebo hem de dobutamin ile benzer sonuçlara ulaşılmıştır. Ayrıca, bu çalışmalarda atriyal fibrilasyon hem plasebo hem de dobutamine göre, ventriküler taşikardi de plaseboya göre daha fazla sıklıkta izlenmiştir. . Ülkemizin de içinde bulunduğu Avrupa ülkelerinde yürütülen levosimendanın güvenliği ve hastane içi tedavi sonlanımlarını değerlendirmek üzere planlanmış LEVICAR çalışması halen devam etmektedir. Genel olarak değerlendirildiğinde, levosimendan akut dekompanse KY tedavisi için günümüzdeki intravenöz inotroplar içinde en uygun tedavi seçeneklerinden birini oluşturmaktadır. Klinik Kullanım: Endikasyonlar, Kontrendikasyonlar, Doz ve Uygulama, Yan Etkiler Avrupa Kardiyoloji Derneği tarafından 2005 yılında yayınlanan akut KY tanı ve tedavi kılavuzuna göre, beraberinde konjesyon olsun veya olmasın, periferal perfüzyon bozukluğu (hipotansiyon, böbrek fonksiyonlarında bozulma) geliştiğinde ya da uygun dozdaki diüretik ve vazodilatör tedaviye dirençli pulmoner ödem varlığında intravenöz pozitif inotropik ajanların kullanılma endikasyonu vardır(96). Akut dekompanse KY tedavisinde inotropların klinik endikasyonları Şekil 1’de, önerilen dozları ise Tablo 6’de verilmiştir. Bu kılavuzda, kardiyak sistolik disfonksiyon sonucu düşük debili KY olan ve hipotansiyonu olmayan ciddi semptomatik hastalarda levosimendan tedavi önerisi sınıf IIa ve kanıt düzeyi B olarak yer almıştır. Aynı kılavuzda, dobutamin tedavisi sınıf IIa, kanıt düzeyi C; dopamin tedavisi ise sınıf IIb, kanıt düzeyi C olarak bildirilmiştir. Büyük çalışmalara bakıldığında, NYHA sınıf III-IV, ejeksiyon fraksiyonu %30-35’in altında, intravenöz diüretik ve nitratları da içeren yeterli medikal tedaviye rağmen ciddi semptomatik akut dekompanse KY olan hastalara levosimendan verildiği görülmektedir(7-9,91-95). Ayrıca, levosimendanın kardiyovasküler cerrahi sonrası gelişen KY tedavisinde de kullanıldığı bildirilmiştir(97). 49 Tablo 6. Akut kalp Yetersizliğinde kullanılan İnotroplar ve önerilen dozları Levosimendan, ventrikül doluşu ve çıkışını etkileyen önemli mekanik tıkanıklıklar, ciddi hipotansiyon (sistolik kan basıncı <85 mmHg) ve taşikardi, ciddi böbrek bozukluğu (kreatinin klirensi <30 ml/dk), ileri derecede karaciğer bozukluğu ve torsade de pointes öyküsü olan hastalarda kontrendikedir. Hafif ve orta derecede böbrek ve karaciğer hastalığı, aneminin eşlik ettiği iskemik kalp hastalığı, taşikardi veya yüksek ventrikül hızlı atriyal fibrilasyon, devam eden koroner iskemi, etyolojisine bakılmaksızın uzamış QTc varlığında levosimendan dikkatle ve yakın monitörizasyon eşliğinde uygulanmalıdır. On sekiz yaşından küçük hastalarda kullanımına ilişkin herhangi bir deneyim henüz yoktur(98). Şekil 1:Sistolik disfonksiyona bağlı akut kalp yetersizliğinde inotropik tedavi şeması Önerilen tedavi dozu 10 dakikada 6-24 µg/kg yüklemeyi takiben 24 saat boyunca 0.05-0.2 µg/kg/dk sürekli infüzyon şeklindedir(96-99).Tartışılan nokta, levosimendan tedavisine başlarken yükleme dozu yapılıp yapılmamasıdır. Sürekli infüzyonla tam 50 terapötik etkinliğe yaklaşık dört saat sonra ulaşılabildiği için, yalnızca ilk iki saat içinde hızlı etkinliğin istendiği hastalarda yükleme dozu önerilmektedir. Ayrıca, sistolik kan basıncı <90 mmHg olan hastalarda yükleme dozundan kaçınılmalıdır(96,99). Tedavi dozu ve süresi hastanın klinik durumuna ve tedaviye verdiği yanıta göre planlanmalıdır. Hipotansiyon ve taşikardi oluşması halinde doz 0.05 µg/kg/dk’ya düşülür ya da tedavi sonlandırılabilir. Eğer başlangıç dozu tolere edilmiş ve daha fazla hemodinamik yanıta ihtiyaç duyuluyorsa infüzyon 0.2 µg/kg/dk’ya çıkarılabilir. Tedavi boyunca kan basıncı, kalp hızı, EKG ve idrar çıkışı yakından takip edilmelidir. Levosimendanın hemodinamik etkileri aktif metabolitlerine bağlı olarak infüzyondan sonra da devam etmektedir. Tüm hemodinamik etkilerin süresi tam olarak belirlenememiş olsa da, kan basıncı üzerine etkileri 3-4 gün, kalp hızına etkileri 7-9 gün devam eder. Bu nedenle, infüzyon bitiminden sonra en az üç gün veya hasta klinik açıdan stabil olana kadar invaziv olmayan monitörizasyon önerilir. Hafif-orta derecede böbrek ve karaciğer bozukluğu olanlarda bu sürenin beş güne uzatılması önerilmektedir.(98) Akut dekompanse KY ile ilgili klinik çalışmalarda levosimendan hastalar tarafından genellikle iyi tolere edilmiştir(7,91,92,94). İlk klinik çalışmalardan birinde, levosimendan ile tedavi edilen 972 hastada en sık bildirilen yan etkiler baş ağrısı (%8.7) ve hipotansiyon (%6.5) olmuştur.(100) Ancak, sonuçları yakın zamanda açıklanan REVIVE-2 çalışmasında %50, SURVIVE çalışmasında %15.5 oranında hipotansiyon bildirilmiştir.(8,9) LIDO çalışmasında, angina pektoris, miyokard iskemisi ve hız/ritim bozuklukları dobutamin alanlarda levosimendan alanlara göre anlamlı derecede daha fazla izlenmiştir. Kalp yetersizliğinde kötüleşme levosimendan ile tedavi edilen hastaların %3.2’sinde gözlenirken, bu oran dobutamin ile tedavi edilenlerde %13.1 bulunmuştur(7). Üç yüz seksen altı hastanın incelendiği 10 klinik çalışmada levosimendan veya plasebo verilen hastalar arasında devamlı olmayan ventriküler taşikardi açısından anlamlı fark saptanmamıştır.(101) Ancak, yine son çalışmalarda levosimendana bağlı aritmik yan etki sıklığında artış dikkat çekmektedir(8,9). REVIVE çalışmasında ventriküler taşikardi (%25 ve %17) ve atriyal fibrilasyon (%8 ve %2) plaseboya göre daha fazla, SURVIVE çalışmasında da atriyal fibrilasyon dobutamine göre daha sık (%9.1 ve %6.1) izlenmiştir. Klasik inotropik ajanlar Akut dekompanse KY’de kullanılan klasik inotroplar beta-agonistler (dobutamin, dopamin) ve PDE III inhibitörleridir (amrinon, milrinon). Bu ilaçlar atım volümünü 51 artırarak kardiyak debiyi iyileştirirler. Bu etkilerini kardiyak miyositlerdeki cAMP düzeyini artırarak sağlarlar. Bu artış hücre içi iyonize Ca+ düzeyini artırır; böylece, daha fazla troponin-C iyonize Ca+ ile bağlanır ve sonuçta troponin-tropomiyozin kompleksinde yapısal değişiklikler meydana gelir. Aktin ve miyozin arasındaki bağlantı kolaylaşır ve kontraktilite artar. Ancak, kontraktilitedeki bu artış daha fazla enerji ve oksijen tüketimi demektir(102,103). Ayrıca, artmış hücre içi kalsiyum kardiyotoksik ve aritmojenik etki gösterir(104). Kısa dönemde hemodinamik ve semptomatik yarar sağlamalarına karşın, uzun dönemde mortaliteyi artırmaları bu ajanların kullanımını kısıtlamaktadır. Yirmi bir randomize çalışmanın meta-analizinde hem beta-agonistlerin hem de PDE III inhibitörlerinin mortaliteyi artırdığı gösterilmiştir(105). PROMISE çalışmasında (Prospective Randomized Milrinone Survival Evaluation) milrinon plaseboya göre bütün nedenlere bağlı mortaliteyi %28, kardiyovasküler mortaliteyi %34, ani ölüm riskini %69 oranında artırmıştır.(5) Oral PDE III inhibitörleri (enoksimon ve vesnarinon) ile ilgili çalışmalar da mortalitede artış ile sonuçlanmıştır(75,106). Klasik inotropların en önemli dezavantajlarından biri de proaritmik etkileridir. Yakın zamanda, Burger ve ark. dobutamin verilen dekompanse KY’li hastalarda ciddi ventriküler aritmilerin belirgin olarak arttığını bildirmişlerdir(107). OPTIME-CHF çalışmasında (Outcomes of a Prospective Trial of Intravenous Milrinone for Exacerbations of Chronic Heart Failure), milrinon ile tedavi edilen iskemik olmayan hastalarda iskemik hastalara göre sürekli ventriküler taşikardi ve ventriküler fibrilasyonun daha fazla olduğu gösterilmiştir(108). Ayrıca, özellikle adrenerjik agonistler olmak üzere pozitif inotroplar, miyokardın oksijen ihtiyacını artırarak miyokard iskemisine veya malign aritmilere zemin hazırlayabilmektedir. Betaagonistlerle adrenerjik reseptörlerin uzun süre uyarılması sonucunda gelişen betareseptör down-regülasyonu da bu ilaçların başka bir dezavantajını oluşturmaktadır(109). Dobutamin Sıklıkla kullanılan bir ajan olan dobutamin beta adrenerjik reseptörleri üzerinden hücre içi cAMP konsantrasyonunu arttırarak hücre içine kalsiyum girisini tetikler ve bu yolla pozitif inotropik etki gösterir. Hücre içine kalsiyum girisinin artısı, hücrenin enerji ihtiyacının ve sonuçta miyokardın oksijen tüketiminin artısına neden olmaktadır(91,110). Ayrıca, hücre içi cAMP ve Ca+ konsantrasyonu artısının kardiyotoksik etki yaptıgı da bildirilmiştir. 52 (91,101,110,112). Yüksek hücre içi kalsiyum konsantrasyonu miyosit elektrofizyolojisini etkileyerek yeniden giris ve ard-depolarizasyon mekanizmaları ile aritmileri tetiklemektedir (101,112,113). Bu durum hücrenin enerji ihtiyacının ve miyokardın oksijen tüketiminin daha da artmasına neden olmaktadır (101,112,113). Dobutamin kalp yetersizliğinin dekompanzasyon döneminde semptomların iyileştirilmesinde kısa dönem için yararlı olmakla birlikte, uzun dönemde hastalıgın ilerlemesini hızlandırdıgı, ciddi ventrikül aritmilerini tetikledigi ve ani ölüme neden olabilecegi bildirilmiştir (108,114-118). Dobutamin ile ilgili geniş kapsamlı olmamakla birlikte yapılan kontrollü klinik çalışmalarda varılan sonuç dobutaminin aritmi sıklıgını arttırdıgı ve klinik sonlanımı olumsuz etkiledigi yönündedir. Dobutaminle yapılan Flolan International Randomized Survival Trial (FIRST) çalışmasına sınıf III-IV KY olan 471 hasta alınmıs, dobutamin infüzyonu uygulanan grupla (80 hasta) uygulanmayan grup (391 hasta) karsılastırıldıgında istenmeyen olay (dobutamin %85.4, kontrol %64.5 p=0.0006) ve altı aylık mortalite (%70.5 ve %37.1, p=0.0001) dobutamin grubunda daha yüksek bulunmustur (6). Çalışmada, intravenöz dobutamin uygulamasının ölüm için bagımsız bir risk faktörü olduğu bildirilmiştir. Sınıf III-IV KY olan, tedaviye dirençli 60 hastanın alındığı randomize, kontrollü bir çalışmada, aralıklı dobutamin uygulanan grupla plasebo grubu karşılaştırılmış; ancak, tedaviye basladıktan sekiz hafta sonra dobutamin grubunda mortalitenin belirgin derecede yüksek olması nedeniyle (dobutamin grubunda 31 hastanın 13'ü, plasebo grubunda 29 hastanın 5'i) çalışma sonlandırılmiştir (115). Başka bir çalışmada da sınıf III-IV KY olan 113 hastada dobutamin ve nitroprussidin etkileri karşılaştırılmış, dobutamin grubunda mortalite daha yüksek bulunmustur (116). Son zamanlarda yayınlanan ve akut dekompanse KY ile hastaneye yatırılmıs nitrogliserin, nesiritid, dobutamin ya da milrinon uygulanmıs 65180 hastanın geriye dönük olarak degerlendirildigi Acute Decompensated Heart Failure National Registry (ADHERE) veritabanında, nitroprussid ve nesiritid alan hastalarda hastane içi mortalite pozitif inotropik tedavi alan gruptan daha düşük bulunmustur (p<0.005) (117). Bir beta-adrenerjik agonist olan dopaminin de düşük dozlarda (<2 d/kg/dk) yalnızca dopaminerjik resep-törleri etkileyerek vazodilatasyona neden olurken, daha yüksek dozlarda (>2d/kg/dk) beta-adrenerjik reseptörleri uyararak miyokardın kasılmasını ve kardiyak atım volümünü artırdıgı bilinmektedir (111,118,119). Öte 53 yandan, 5 d/kg/dk'nın üzerindeki dozlarda alfa-adrenerjik reseptörleri etkileyerek periferik direnci artırmaları nedeniyle hipotansifhastalarda yararlı olabilmekle birlikte, sol ventrikül ardyükünü, pulmoner arter basmcını ve pulmoner direnci artırması nedeniyle akut KY olumsuz da etkileyebilmektedir (111,119). Akut KY olan hipotansif hastalarda pozitif inotropik tedaviye ek olarak vazopresör tedavi de gerekli olabilmektedir. Bu amaçla dopamin dışında sık kullanılan ajanlar epinefrin ve norepinefrindir. Epinefrin, beta-1, beta-2 ve alfa-adreneıjik reseptörler üzerinden etki gösteren bir katekolamindir. Dobutamine yanıtsız hipotansiyonlu olgularda sistemik ve pulmoner arter monitörizasyonu ile kullanımı önerilmektedir (120). Norepinefrin, genellikle periferik direnci artırmak için kullanılan ve alfa-reseptör afinitesi yüksek olan bir katekolamindir. Epinefrine göre kalp hızını daha az artırmaktadır. Hemodinamiyi iyileştirmek için sıklıkla dobutaminle birlikte kullanılmaktadır (120). Beta-adrenerjik agonistlerin uzun süreli kullanımında reseptör downregülasyonu nedeniyle hemodinamik tolerans geliştigi bilinmektedir. Bunun dışında beta-bloker kullanan hastalarda da dobutamin etkisinin zayıf olduğu gösterilmiştir (7). QT ARALIĞI VE QT DİSPERSİYONU Şekil 2:Normal elektrokardiyogram 54 Q dalgasının başlangıcından T dalgasının izoelektrik hatta dönüşüne kadar geçen süre QT aralığı olarak adlandırılır.Standart dinlenme sonrası çekilen EKG’den kolaylıkla elde edilebilen QT aralığı her derivasyonda o lokalizasyona uyan ventrikül myokardının depolarizasyon ve repolarizasyonunun toplam süresini yansıtır. Erişkinlerde 0.35 ile 0.44 saniye arasında değişir. QT mesafesi kalp hızıyla değişkenlik gösterdiği için Bazzet formülü ile düzeltilerek hesaplanır. Bu süre; • Elektrolit bozuklukları • Bazı ilaçlar(antiaritmikler, psikotrop ilaçlar) • Santral sinir sistemi hastalıkları(subaraknoid kanama, menenjit) • Aritmiler(kronik idiyoventriküler ritim) • İskemi • Konjenital uzun QT sendromları • Hipotermi • Kalp hızı değişiklikleri gibi nedenler ile değişebilir. Diyabetik hastalarda da otonom nöropatiye bağlı olarak QT mesafesi uzamaktadır. QT mesafesindeki uzama, miyokard enfarktüsünden sonra gelişen aritmilerin ve kötü prognozun tahmininde de rol oynar. Kalp yetersizliğinde ani ölümlerle, artmış QT dağılımı arasında yakın ilişki saptanmıştır(121-123). QT DİSPERSİYONU İlk kez 1985’te, Campbell ve ark. bir digitizer programı kullanarak, değişik derivasyonlardaki QT mesafeleri arasında, küçük fakat devamlı farklar bulmuşlardır (124). Daha sonra yapılan çalışmalarda, derivasyonlar arasında QT mesafesi değişikliklerinin kayıtlardaki artefaktlardan kaynaklanmadığı ve ventrikül toparlanma bozukluklarının altındaki sebepleri belirlemede faydalı olabileceği yönündeki kanıtlar gittikçe artmıştır(125). QT dispersiyonu 12 derivasyonlu EKG’de ölçülen en uzun ve en kısa QT aralığının farkı olarak tanımlanmaktadır(126). QTd=QTmax –QTmin QT aralığı her derivasyonda o lokalizasyona uyan ventriküler miyokardının elektriksel aktivasyon ve istirahat toplam süresini verir; kalp hızı ile ters orantılı olarak değişir. Kalp hızının artması(taşikardi) QT aralığının kısalmasına neden olurken, hızın azalması 55 azalması (bradikardi) QT uzamasına neden olur. Bu nedenle QT süresinin beklenen değerlerde olduğunu veya anormal olarak uzadığını söylemek için kalp hızı hesaplanmalıdır.Çeşitli formüllerle QT aralığı kalp hızına göre düzeltilebilir.QTc (düzeltilmiş-corrected QT) kalp hızı dikkate alınarak ve bazı formüllerde ortalama kalp hızı 60 /dakikaya göre düzeltilmiş QT değeridir. Düzeltilmiş QT (corrected QT: QTc)EKG üzerinden hesaplanmış bir değerdir ve en sık olarak 1918 yılında tanımlanan Bazett formülü ile hesaplanabilir(127). Bazett Formülü: QTc=QT / √RR. Bazett formülü yüksek kalp hızlarında QT aralığında çok az bir düzeltme yaptığı için yoğun eleştirilere maruz kalmaktadır. Hodges ve arkadaşlarının formülü giderek daha geniş kabul görmektedir(128,129). Hodges Formülü: QTc=QT +1.75 (hız-60) Bu iki formülden başka da QTc hesaplama formülleri vardır. Ayrıca bazı EKG cihazlarında otomatik olarak da QTc ölçümü yapılabilmektedir(129). İlaç tedavisi almamış, genetik olarak saptanmış herediter uzun QT sendromlu (UQTS) hastaların büyük çoğunluğunda QTc 440 milisaniye(ms)’nin üstündedir. Sağlıklı kontrollerde QTc 440-465 ms düzeyindedir. Bu değerler temel olarak alınırsa ilaç tedavisi almayan hastalarda 420 ms’nin altındaki QTc değerleri kesinlikle normal, 420-440 ms arasındaki değerler sınırda, 440 ms üzerindeki QTc değerleri ise yüksek olarak kabul edilir. Ancak genetik olarak UQTS saptanan hastaların %12’sinde QTc değerlerinin 420-440 ms arasındaolduğu da dikkate alınmalıdır (130,131). EKG de ölçülen tek bir QT aralığı ventrikül dinlenme zamanı ve repolarizasyon dağılım değişkenliği hakkında bize bilgi vermez.Ancak QTd’nin ventriküldeki bölgesel değişiklikleri yansıtabildiği söylenmektedir(14). QT dispersiyonundaki artış non uniform ventriküler repolarizasyonu işaret eder bu da malign ventriküler aritmi oluşumunda bir neden olabilir.Endokardial monofazik aksiyon potansiyeli çalışmaları myokardial repolarizasyon süresinde yüzeyel EKG ile saptanabilen bölgesel değişikliklerin olabildiğini göstermektedir.Ventriküler depolarizasyon ve repolarizasyon toplam zamanının homogenitesinin aritmilere karşı 56 koruyucu olduğuna inanılmaktadır. Ventriküllerin farklı bölgelerindeki homojen olmayan ileti hızları veya repolarizasyon, reentri mekanizması yolu ile ciddi ventriküler aritmilere, dolayısıyla da ani kalp ölümlerine sebep olabilir(132,133) QTc uzaması ani ölüm için yaştan bağımsız bir risk faktörü olarak kabul edilmektedir(16).Bu ilişki iskemik kalp hastalıklarında yoğun olarak çalışılmıştır ve mortalitede 2-5 kat artış saptanmıştır (134). Uzun QT sendromu yüksek ventriküler fibrilasyon riski ile birliktedir ve kinidin gibi QT süresini uzatan ilaçlarda ani ölüme (aritmiye bağlı) neden olabilirler(135). QTc aralığının teşhis açısından değeri ventrikül istirahatinin tamamlandığını tesbit etmedeki güçlükler nedeni ile bazı yazarlar tarafından tartışmalıdır.Bu zorluğun nedenleri: 1. Genellikle değişik derivasyonlar arasında QT aralığı açısından bir çeşitlilik söz konusudur.Bu T dalgası dispersiyonu bazı derivasyonlarda T dalgasının sonlanan kısmı izoelektrik olduğunda ortaya çıkar.Bir çok derivasyonda ölçülen QT aralığının en uzunu bu nedenle gerçek QT aralığı olarak kabul edilmelidir. 2. U dalgası T dalgasının içine karışabilir ve EKG bazal çizgisinde yer almayan bir TU bileşkesi ortaya çıkabilir.Bu durumda U dalgasının başlangıcı yaklaşık QT aralığının sonu olarak kabul edilir. 3. Daha yüksek kalp hızlarında P dalgası ile T dalgası iç içe geçerek bazal çizgide yer almayan bir TP bileşkesi oluşturabilir.Bu durumda P dalgasının başlangıcı yaklaşık QT aralığının sonu olarak kabul edilir. QT Dispersiyonunun Prognostik Önemi Her ne kadar QT ölçümü konusundaki metodolojik problemler hala tam olarak çözülememişse de bu problemler QT dispersiyonunun kolay elde edilebilir non invaziv ve ucuz bir parametre olduğu gerçeğini göz ardı ettirmez.Yararı konusunda ise bir çok kardiyolojik çalışma yapılmış ve QT dispersiyonunun prognostik önemi ortaya konmuştur. 1. Akut veya kronik MI’lı hastaların incelendiği bir çok çalışmada aritmi gelişen hastalarda gelişmeyen hastalara göre daha uzun QT dispersiyonu saptanmıştır(136). 57 2. Bazı elektrofizyolojik çalışmalarda QT dispersiyonunun ventriküler aritmi gelişimini tayin edebildiği saptanmıştır(137).Ancak yine de QT dispersiyonunun invaziv elektrofizyolojik çalışmalara tercih edilmeyeceği ancak elektrofizyolojik araştırmanın yararlı ve kolay elde edilebilen ek bir parametresi olarak kabul edilmesi gerektiği belirtilmektedir(15). 3. Bir çok çalışma QT dispersiyonunun kalp yetersizliğinde sonlanım noktaları ile korelasyon gösterdiğini bulmuştur.ELİTE çalışmasında kaptopril ve losartan verilen kalp yetersizliği vakalarında losartanın QT dispersiyonunu arttırdığı saptanmıştır(138). 4. Bir çok yazar hipertrofik kardiyomyopatide ventriküler aritmilerin yüksek QT dispersiyonu ile birlikteliğini bulmuşlardır(139). 5. Uzun QT sendromunda beta blokerlere yanıtsız hastalarda yanıtlı hastalara göre daha yüksek QT dispersiyonu gözlenmiştir(140). 6. QT dispersiyonunu etkileyen ilaçların torsade de pointes’e yol açabildiği bulunmuştur.Bir çok araştırmacı kinidin,sotalol,dofetolide,propafenon ve terfenadine kullanımının daha yüksek QT dispersiyonu ve daha sık aritmiye yol açtığını bulmuşlardır(141). Non Kardiak Hastalıklarda QT dispersiyonu Non kardiyolojik hastaların incelendiği birçok klinik çalışmada da QT aralığı ve QT dispersiyonunun prognostik önemi gösterilmiştir. Bu çalışmalar arasında Tip 1 DM, Tip 2 DM’li hastalar, anoreksiya nervosa, carbonmonoksit zehirlenmesi, romatoid artrit, dializ hastaları, elektrolit bozukluğu olan hastalar, ankilozan spondilit,profesyonel atletlerin sol ventrikül hipertrofisi, ciddi yanıklar ve renal transplant hastalarının konu edildiği çalışmalar sayılabilir. Tip 2 DM ‘da uzamış QT aralığı ve yüksek QT dispersiyonu otonom nöropati ve koroner arter hastalığı ile ilişkili bulunmuştur(142). Ayrıca dializ hastalarında yüksek QT dispersiyonunun kardiak ve genel mortaliteyi arttırdığı bulunmuştur(143) 58 Kardiak Hastalıklarda QT dispersiyonu Birçok çalışmada çeşitli kardiyovasküler hastalıklarda yükselmiş QT dispersiyonu bulunmuştur.Bu hasta grupları arasında akut MI, kronik MI geçiren hastalar,çeşitli nedenlere bağlı sol ventrikül hipertrofisi olan hastalar,kalp yetersizliği olan hastalar ,idiopatik dilate kardiyomyopatili hastalar,hipertansif hastalar ve aort stenozu olan hastalar sayılabilir(122,123,144,145). 59 MATERYAL VE METOD HASTA SEÇİMİ VE DEĞERLENDİRİLMESİ Çalışmaya standard kalp yetersizliği tedavisine rağmen (diüretik, anjiyotensin dönüştürücü enzim inhibitörü, digoksin, beta bloker) kompanse olamayarak hastanemize ileri evre kalp yetersizliği (Newyork kalp sınıflamasına göre evre 3 ve 4) kliniği ile başvuran ve yatırılan, ekokardiyografik incelemede ejeksiyon fraksiyonu ≤% 35 saptanan hastalar dahil edilmiştir.Bu çalışmaya aşagıdaki özelliklere sahip hastalar alınmamıştır. 18 yaş altı ve 80 yaş üstü hastalar, Laktasyon, Hipertrofik kardiyomiyopati QT dispersiyonu yapan ilaç kullanımı olan hastalar (antipsikotik ilaçlar, Sotalol, prokainamid, propofenon vs.) Bradiaritmi ve kontrolsüz taşiaritmi olan hastalar, Akut koroner sendrom, Kreatinin > 2,0 mg/dl Karaciğer yetersizliği olanlar Enfenksiyonu olanlar Bir ay içinde miyokard infarktüsü geçiren hastalar Gebelik Daha önce tanı almış malignansi Tirotoksikoz Hemoglobin düzeyi 10 gr/dl altında olan hastalar, Sistolik kan basıncı 100 mm Hg altında olan hastalar Hipokalemi Çalışma Haydarpaşa Numune Eğitim ve Araştırma Hastanesi Etik kurulu tarafından onaylanmıştır. Bu hastalar levosimandan (n= 22 hasta) ve dobutamine grubu (n= 19 hasta) olarak 2 gruba randomize edildi ve her iki grup hastada tedavi öncesi ve sonrasında holter ile monitorize edilerek elektrokardiyografik kayıt alındı.. Levosimendan 0,1 mikrogram/kg/dk , Dobutamine 5 mikrogram/kg/dk dozunda 60 başlandı.ventriküler taşikardi, ciddi aritmiler ve hipotansiyon gibi yan etkiler olduğunda ara verilerek 24 saat devam edildi. QT DİSPERSİYONUNUN ÖLÇÜMÜ QT aralığının ölçümleri için holter EKG kayıtları alındı.. Q dalgasının başından T dalgasının izoelektrik hatta döndüğü son noktaya kadarki mesafe, QT aralığı olarak, milisaniye cinsinden ölçüldü. U dalgası olan EKG’lerde, T ve U dalgaları arasındaki en düşük nokta T dalgasının sonu olarak kabul edildi. T dalgasının bitişi tam olarak tespit edilemeyen derivasyonlar analiz edilmedi. QT dispersiyonu (QTd) EKG’deki en uzun QT mesafesi ile en kısa QT mesafesi arasındaki fark hesaplanarak elde edildi. Kalp hızına göre Bazzet formülü(QT/√R-R) ile düzeltilmiş QT aralığı hesaplandı. İSTATİSTİKSEL İNCELEMELER Çalışmada elde edilen bulgular değerlendirilirken, istatistiksel analizler için SPSS (Statistical Package for Social Sciences) for Windows 15.0 programı kullanıldı. Çalışma verileri değerlendirilirken niceliksel verilerin karşılaştırılmasında normal dağılım gösteren parametrelerin gruplar arası karşılaştırmalarında Student t testi; normal dağılım göstermeyen parametrelerin gruplar arası karşılaştırmalarında Mann Whitney U test kullanıldı. Normal dağılım gösteren parametrelerin grup içi karşılaştırmalarında paired sample t testi kullanıldı. Sonuçlar % 95’lik güven aralığında, anlamlılık p<0.05 düzeyinde değerlendirildi. 61 BULGULAR Çalışma, Haydarpaşa Numune Eğitim ve Araştırma Hastanesi Dahiliye kliniğinde toplam 41 olgu üzerinde yapılmıştır. Olgular Dobutamin (n=19) ve Levosimendan (n=22) olmak üzere iki grup altında incelenmiştir. Dobutamin 46,3% Levosimendan 53,7% Şekil 3: Grupların Dağılımı Tablo 7: QT Dispersiyonu Değerlendirmesi Tedavi Öncesi Tedavi Sonrası Tedavi öncesiTedavi sonrası p QT Dispersiyonu QT Dispersiyonu Dobutamin kullanan hasta grubu (Ort±SD) Levosimendan kullanan hasta grubu (Ort±SD) 31,18±17,27 (ms) 25,11±16,92 (ms) 0,298 28,50±13,06 (ms) 20,68±9,56 (ms) p 0,588 0,331 0,022* Gruplar arasında Student t test kullanıldı.Grup içi değerlendirmelerde paired sample t test kullanıldı* p<0.05 Tedavi öncesi QT dispersiyonu düzeylerine göre gruplar arasında istatistiksel olarak anlamlı bir farklılık bulunmamaktadır (p>0.05). Tedavi sonrası QT dispersiyonu düzeylerine göre gruplar arasında istatistiksel olarak anlamlı bir farklılık bulunmamaktadır (p>0.05). Dobutamin grubunda; tedavi öncesi QT dispersiyonu düzeyine göre (31,18±17,27) (ms) tedavi sonrası QT dispersiyon düzeyinde (25,11±16,92) (ms) görülen düşüş istatistiksel olarak anlamlı bulunmamıştır (p>0.05). Levosimendan grubunda; tedavi öncesi QT dispersiyonu düzeyine göre (28,50±13,06) (ms) tedavi sonrası QT dispersiyon düzeyinde (20,68±9,56) (ms) görülen düşüş istatistiksel olarak anlamlı bulunmuştur (p<0.05). 62 QT Dispersiyonu Ortalama (ms) QT Dispersiyonu 35 30 25 20 15 10 5 0 Dobutamin Levosimendan Tedavi Öncesi Tedavi Sonrası Şekil 4: QT Dispersiyon Grafiği Tedavi öncesi QT dispersiyonu düzeylerine göre, tedavi sonrası QT dispersiyonu düzeyinde görülen yüzde değişim miktarlarına göre gruplar arasında istatistiksel olarak anlamlı bir farklılık bulunmamaktadır (p>0.05). Tablo 8: QTc Değerlendirmesi QTc QTc Dobutamin kullanan hasta grubu Levosimendan kullanan hasta grubu (Ort±SD) (Ort±SD) 418,50±39,96 (ms) 409,20±31,17 (ms) Tedavi Öncesi 428,31±79,10 (ms) 419,50±29,45 (ms) Tedavi Sonrası Tedavi öncesi-Tedavi 0,438 0,271 sonrası p p 0,425 0,653 Gruplar arasında Student t test kullanıldı. Grup içi değerlendirmelerde paired sample t test kullanıldı. Tedavi öncesi QTc düzeylerine göre gruplar arasında istatistiksel olarak anlamlı bir farklılık bulunmamaktadır (p>0.05). Tedavi sonrası QTc düzeylerine göre gruplar arasında istatistiksel olarak anlamlı bir farklılık bulunmamaktadır (p>0.05). Dobutamin grubunda; tedavi öncesi QTc düzeyine göre (418,50±39,96) (ms) tedavi sonrası QTc düzeyinde (428,31±79,10) (ms) görülen artış istatistiksel olarak anlamlı görülmemiştir (p>0.05). Levosimendan grubunda; tedavi öncesi QTc düzeyine göre (409,20±31,17) (ms) tedavi sonrası QTc düzeyinde (419,50±29,45) (ms) görülen artış istatistiksel olarak anlamlı görülmemiştir (p>0.05). 63 QTc Ortalama (ms) 430 425 QTc 420 415 410 405 400 395 Dobutamin Levosimendan Tedavi Öncesi Tedavi Sonrası Şekil 5: QTc Grafiği Tedavi öncesi QTc düzeylerine göre, tedavi sonrası QTc düzeyinde görülen yüzde değişim miktarlarına göre gruplar arasında istatistiksel olarak anlamlı bir farklılık bulunmamaktadır (p>0.05). 64 TARTIŞMA ve SONUÇ Kalp yetersizliği (KY), kalp fonksiyonlarının akut yada kronik bozulmasına bağlı olarak gelişen semptomlar kompleksidir. Kardiyak atım hacminin dokuların metabolik ihtiyacını karşılayamayacak seviyede azalması, kalp yetersizliği semptomlarının olusumuna neden olur. KY, sıklıkla değisik kardiyak hastalıkların seyrinde, son evrede ortaya çıkar ve önemli bir mortalite ve morbidite nedeni olarak kabul edilir. Sol ventrikül sistolik fonksiyon bozukluğu nedeniyle kalp yetersizliği olan hastaların ventrikül aritmileri ve ani ölüm açısından yüksek riske sahip olduğu bilinmektedir(10). Deneysel ve klinik çalışmalar, ventrikül aritmilerinin gelişiminde homojen olmayan miyokardiyal repolarizasyonun önemli bir rol oynadığını göstermiştir.Repolarizasyon dispersiyonunun bir göstergesi olan QT dispersiyonu, ventrikül aritmilerinin gelişimi açısından önemli bir belirteç olarak düşünülmektedir(1113). QT aralığı ventriküler miyokardın elektriksel aktivasyon ve istirahat süreleri hakkında bilgi veren basit ve kolay uygulanabilen bir yöntemdir. EKG’deki en uzun QT mesafesi ile en kısa QT mesafesi arasındaki farkın hesaplanmasıyla elde edilen QT dispersiyonu (QTd) ventrikül repolarizasyonunun heterojenitesini gösteren; non-invazif olarak yüzey elektrokardiyografisinden hesaplanabilen bir parametredir. Artmış QT dispersiyonu birçok hasta ve hastalık grubunda ciddi aritmi ve ani ölüm riski ile ilişkili bulunmuştur(14-16). Ventriküler istirahat zamanının homogenitesinin aritmilere karşı koruyucu olduğuna inanılmaktadır(146). QT dispersiyonu ilk kez Cowan ve arkadaşları tarafından, standart 12 derivasyonlu EKG’de en uzun ve kısa QT mesafeleri arasındaki fark olarak tanımlanmıştır(147).Artmış QT dispersiyonunun artmış ventrikül repolarizasyonu heterojenitesini gösterdiği bilinmektedir(148). Day ve arkadaşları uzun QT sendromu olan hastalarda artmış QT dispersiyonunun ventriküler taşikardi riskini gösterebileceğini saptamışlardır(14).Sonraki birçok çalışmada da QT dispersiyonu ile ani ölüm ve aritmi insidansı arasında ilişki olduğu gösterilmiştir. QT dispersiyonunun antiaritmik ilaç etkisinin izlenmesinde, postoperatif Fallottetralojisi, hipertrofik kardiyomiyopatide, miyokard enfarktında, elektrolit dengesizliği, kalpyetersizliği, kapak hastalığı, ilaca bağlı toksisitede hayatı tehdit eden aritmilerle ilişkili olduğu bulunmuştur(149). 65 Fananapazir’in çalışmasında tek değişkenli analizde 80 msn üzerindeki QTd’nun total kardiyak ve ani ölümle ilişkisi saptanırken çok değişkenli analizde böyle bir ilişki bulunmamıştır (150). Ventriküler aritmi riskini kolay ve invazif olmayan bir yöntemle göstermesi QT dispersiyonunun en büyük avantajıdır. Manuel ölçümlerde gözlemciler arasında ve gözlemcilerin farklı ölçümleri arasındaki değişkenlik ölçümlerin doğruluğunu kısıtlayabilir. QT intervali için otomatik ölçüm yöntemleri de geliştirilmiş olup, elle yapılan ölçümlere kıyasla tekrarlanan ölçümlerde hata oranı daha azdır.Fakat otomatik ölçümlerde de metodolojik yöntemlere bağlı hatalar vardır ve manuel hesaplamaya karşı fazla üstünlükleri yoktur.Artmış QT dispersiyonu ventrikül repolarizasyon heterojenitesinin bir göstergesi olduğundan bu hastaların artmış disritmi riskine sahip olduğu düşünülebilir.Miyokardın repolarizasyonundaki homojenliğin kaybolduğunu gösteren QT dispersiyonundaki (QTd) artış çeşitli kardiyak patolojilerde fatal aritmi riskini belirlemede kullanılmıştır(151-153). Normal olgular ile karşılaştırıldığında kalp yetersizliği veya çeşitli nedenlere bağlı sol ventrikül disfonksiyonu gelişen hastalarda QT dispersiyonunun arttığı gösterilmiştir. Kalp yetersizliği olan hastalarda QT dispersiyonu ve klinik sonuçlar arasında anlamlı ilişki olduğu ileri sürülmüştür. Bununla birlikte, bu ilişki dofetilid kullanılan DIAMOND-CHF ve UK-HEART çalışmalarında ve 2263 hastadan oluşan prospektif bir başka çalışmada gösterilememiştir(154-158). Sol ventrikül sistolik fonksiyon bozukluğuna bağlı kronik kalp yetersizliğinin akut alevlenmesinin tedavisinde intravenöz pozitif inotropik ajanlar önemli bir rol oynamaktadır. ajanların da Kalp yetersizliği tedavisinde önemli bir yeri olan pozitif inotropik ventrikül aritmilerini tetiklediği ve mortaliteyi artırdığı bildirilmiştir(114,159,160).Günümüzde en sık kullanılan inotropik ajanlar betaadrenerjik reseptör agonistleri (örn. dobutamin) ve fosfodiesteraz inhibitörleridir. Betaadrenerjik reseptör agonistleri siklik adenozin monofosfat (cAMP) üretimini tetikleyerek; fosfodiesteraz inhibitörleri ise yıkımını inhibe ederek hücre içi cAMP düzeylerini yükseltmekte, miyosit içine kalsiyum girişini artırarak kontraktiliteyi iyileştirmektedir(10,91,101,110,112,114,159-165). Yüksek hücre içi kalsiyum konsantrasyonu miyosit elektrofizyolojisini belirgin olarak etkileyerek re-entry ve afterdepolarizasyon mekanizmalarıyla aritmileri tetiklemektedir (7,91,100,101,110,112,161,166). 66 Kalp hızını artırması, atriyal ve ventriküler aritmileri tetiklemesi nedeniyle bu grup ilaçlar, özellikle iskemik kardiyomiyopatili hastalarda miyokardiyal iskemiyi kötüleştirip, ani ölüm gibi ciddi istenmeyen olaylara neden olabilir(5,114,159-161). Bu nedenle, günümüzde dikkatler hücre içi kalsiyum konsantrasyonunu değiştirmeden miyokardiyal kontraktiliteyi artıran kalsiyum duyarlılaştırıcı ajanlara çevrilmiştir. Levosimendan, bu grup hastaların kısa dönem tedavisi için geliştirilmiş, miyokardiyal kalsiyum duyarlılaştırıcı ve vazodilatatör etkili yeni bir inotropik ajandır. Hücre içi kalsiyum konsantrasyonunu artırmaması nedeniyle, klinikte yaygın olarak kullanılan diğer pozitif inotropik ajanların istenmeyen etkilerini göstermeyeceği ileri sürülmüştür. ağrısı, Buna karşın, levosimendanın yan etkileri arasında hipotansiyon, baş taşikardi, atriyal fibrilasyon ve nadiren ventrikül aritmileri bildirilmiştir(91,100,101). Levosimendanın elektrokardiyografik parametreler üzerine olan etkisini gösteren sınırlı sayıda çalışma vardır. Bugüne kadar levosimendanla ilgili yayınlarda, aritmi insidansını diğer ajanlara göre daha az oranda artırması nedeniyle daha güvenli bir inotropik ajan olarak tanımlanmasına karşın, son dönemde özet verileri sunulan SURVIVE ve REVIVE II çalışmalarının sonuçları oldukça farklıdır. SURVIVE çalışmasında 1327 hasta çalışmaya alınmış ve levosimendan verilen hasta grubu ile dobutamin verilen hasta grubu karşılaştırılmıştır. Levosimendan grubunda istatistiksel olarak anlamlı olmamasına karşın mortalite daha düşük bulunurken, levosimendan ve dobutamin gruplarında sırasıyla atriyal fibrilasyon %9.1 ve %6.1, hipotansiyon %15.5 ve %13.9, ventrikül taşikardisi %7.9 ve %7.3 oranlarında gözlenmiştir. REVIVE II çalışmasına ise 600 hasta alınmış, standart tedaviye ek olarak levosimendan alan grup, standart tedaviyle birlikte plasebo alan grupla karşılaştırılmıştır. En sık görülen yan etkiler, levosimendan ve plasebo gruplarında sırasıyla hipotansiyon (%50 ve %36), ventrikül taşikardisi (%25 ve %17) ve atriyal fibrilasyon (%8 ve %2) olmuştur(8,9,101). Kaşıkçıoğlu ve arkadaşları tarafından yapılan bir çalışmada, tedavi dozlarındaki levosimendan infüzyonunun ventrikül aritmilerinde artış göstergesi olabilen QT parametrelerinde değişikliğe yol açmadığı görülmüştür.Bu çalışmada levosimendan infüzyonunun QT parametrelerini etkilememiş olmasına, iskemik kardiyomiyopatili hasta grubunda hem kalp hızını artırmamasının hem de iskemiyi önlemesinin katkısı olabileceği belirtilmiştir.Bu çalışma sırasında aritmi tespit edilmediği gibi levosimendan infüzyonunun, OT parametreleri üzerine anlamlı bir etkisinin olmamasının kullanılan 67 ilaç dozuyla ilişkili olabileceği belirtilmiştir(167).Bu bağlamda Singh ve ark. tarafından yapılan bir çalışmada, daha yüksek dozların QTc’de artışa neden olabileceği bildirilmiştir(101). Dekompanse kalp yetersizliği hastalarında güncel bir inotropik ajan olan levosimendan ile dobutamin tedavilerinin, ventrikül aritmilerinin gelişimi açısından önemli bir belirteç olan elektrokardiyografik bulgulardan QT dispersiyonu üzerine etkisini değerlendirmeyi amaçladığımız çalışmamızda Levosimendan grubunda; tedavi öncesi QT dispersiyonu düzeyine göre tedavi sonrası QT dispersiyon düzeyinde görülen düşüş istatistiksel olarak anlamlı bulunmasına karşın Dobutamin grubunda; tedavi öncesi QT dispersiyonu düzeyine göre tedavi sonrası QT dispersiyon düzeyinde görülen düşüş istatistiksel olarak anlamlı bulunmadı. Çalışmamızda levosimendan ile dobutamin tedavisi alan gruplar kendi aralarında karşılaştırıldığında Tedavi öncesi ve tedavi sonrası QT dispersiyonu düzeylerine göre gruplar arasında istatistiksel olarak anlamlı bir farklılık bulunmadı. QTc üzerine olan etkilerine baktığımızda; tedavi öncesi ve tedavi sonrası QTc düzeylerine göre gruplar arasında istatistiksel olarak anlamlı bir farklılık bulunmadı. Çalışmamız sırasında hem levosimendan hem de dobutamin alan hasta grubunda klinik açıdan anlamlı bir aritmi gözlenmedi.QT dispersiyonu üzerine her iki grupta elde ettiğimiz sonuçlar bu konuda daha önce yapılmış çalışmaların sonuçları ile benzerdi. Sonuç olarak; QT dispersiyonu kalp yetersizliğinde ani kardiak ölüm ve mortaliteyi belirleyen önemli bir prognostik faktördür.Kalp hızına göre düzeltilmiş QT intervalinin uzaması atrial ya da ventriküler aritmilerin gelişimi açısından önemli olabilen myokardın uzamış repolarizasyonunun göstergesidir. Çalışmamızda levosimendan grubunda tedavi öncesi QT dispersiyonu düzeyine göre tedavi sonrası QT dispersiyon düzeyinde görülen düşüş istatistiksel olarak anlamlı bulunmasına karşın dobutamin ile karşılaştırıldığında levosimendan infüzyonunun QT parametreleri üzerine anlamlı bir etkisinin olmadığı, proaritmi riskinin dobutaminle benzer olduğu ancak bu konuda daha çok hasta içeren yeni prospektif çalışmalara gereksinim duyulduğu sonucuna varılmıştır. 68 ÖZET Kalp yetersizliği (KY), kalp fonksiyonlarının akut yada kronik bozulmasına bağlı olarak gelişen semptomlar kompleksidir KY, sıklıkla değisik kardiyak hastalıkların seyrinde, son evrede ortaya çıkar ve önemli bir mortalite ve morbidite nedeni olarak kabul edilir. Sol ventrikül sistolik fonksiyon bozukluğu nedeniyle kalp yetersizliği olan hastaların ventrikül aritmileri ve ani ölüm açısından yüksek riske sahip olduğu ve kalp yetersizliği tedavisinde önemli bir yeri olan pozitif inotropik ajanların da ventrikül aritmilerini tetiklediği ve mortaliteyi artırdığı bilinmektedir. Ventrikül aritmilerinin gelişiminde homojen olmayan miyokardiyal repolarizasyonun önemli bir rol oynadığı ve repolarizasyon dispersiyonunun bir göstergesi olan QT dispersiyonunun, ventrikül aritmilerinin gelişimi açısından önemli bir belirteç olduğu düşünülmektedir. Dekompanse kalp yetersizliği hastalarında güncel bir inotropik ajan olan levosimendan ile dobutamin tedavilerinin, ventrikül aritmilerinin gelişimi açısından önemli bir belirteç olan QT dispersiyonu üzerine etkisini değerlendirmeyi amaçladığımız bu çalışmaya standard kalp yetersizliği tedavisine rağmen (diüretik, anjiyotensin dönüştürücü enzim inhibitörü, digoksin, beta bloker) kompanse olamayarak hastanemize ileri evre kalp yetersizliği (Newyork kalp sınıflamasına göre evre 3 ve 4) kliniği ile başvuran ve yatırılan, ekokardiyografik incelemede ejeksiyon fraksiyonu ≤% 35 saptanan hastalar dahil edildi. . Bu hastalar levosimandan (n= 22 hasta) ve dobutamine grubu (n= 19 hasta) olarak 2 gruba randomize edildi ve her iki grup hastada tedavi öncesi ve sonrasında monitorize edilerek elektrokardiyografik kayıt alındı.. Levosimendan 0,1 mikrogram/kg/dk, Dobutamine 5 mikrogram/kg/dk dozunda infüzyona başlandı ve 24 saat devam edildi. Alınan EKG kayıtlarından QT aralığı milisaniye cinsinden ölçüldü. QT dispersiyonu (QTd) EKG’deki en uzun QT mesafesi ile en kısa QT mesafesi arasındaki fark hesaplanarak elde edildi. Kalp hızına göre Bazzet formülü(QT/√R-R) ile düzeltilmiş QT aralığı hesaplandı. Çalışmanın verileri değerlendirildiğinde; Dobutamin grubunda; tedavi öncesi QT dispersiyonu düzeyine göre (31,18±17,27) tedavi sonrası QT dispersiyon düzeyinde (25,11±16,92) görülen düşüş istatistiksel olarak anlamlı bulunmamış (p>0.05); Levosimendan grubunda; tedavi öncesi QT dispersiyonu düzeyine göre (28,50±13,06) tedavi sonrası QT dispersiyon düzeyinde (20,68±9,56) görülen düşüş istatistiksel olarak anlamlı bulunmuş (p<0.05) ancak gruplar arasında istatistiksel olarak anlamlı bir farklılık bulunmamıştır. Sonuç olarak; QT dispersiyonu kalp yetersizliğinde ani kardiak ölüm ve mortaliteyi belirleyen önemli bir prognostik faktördür. Dobutamin ile karşılaştırıldığında levosimendan infüzyonunun QT parametreleri üzerine anlamlı bir etkisinin olmadığı, proaritmi riskinin dobutaminle benzer olduğu ancak bu konuda daha çok hasta içeren yeni prospektif çalışmalara gereksinim duyulduğu sonucuna varılmıştır. 69 KAYNAKLAR 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. Cleland JG, Khand A, Clark A. The heart failure epidemic: Exactly how big is it? Eur Heart J 2001;22:623-626. Stewart S. Prognosis of patients with heart failure compared with common types of cancer.Heart Fail Monit 2003;3:87-94. Sharpe N, Doughty R. Epidemiology of heart failure and ventricular dysfunction. Lancet 1998; 352 (suppl 1): 37. Brown AM, Cleland JG. Influence of concomitant disease on patterns of hospitalization in patients with heart failure discharged from Scottish hospitals in 1995. Eur Heart J 1998; 19:1063-1069. Packer M, Carver JR, Rodeheffer RJ, et al. Effect of oral milrinone on mortality in severe chronic heart failure. The PROMISE Study Research Group. N Engl J Med 1991;325:1468-1475. O’Connor CM,Gattis WA,Uretsky BF,et al.Continuous intravenous dobutamine isassociated with an increased risk of death in patients with advanced heart failure: Insights from the Flolan International Randomized Survival Trial (FIRST).Am Heart J 1999;138:78-86. Follath F, Cleland JG, Just H, et al. Efficacy and safety of intravenous levosimendan compared with dobutamine in severe low-output heart failure (the LIDO study): A randomised double-blind trial. Lancet 2002;360:196-202. Packer M, et al. REVIVE II: Multicenter placebo-controlled trial of levosimendan on clinical status in acutely decompensated heart failure. In: American Heart Association Scientific Sessions 2005; November 13-16, 2005; Dallas, Texas. Late Breaking Clinical Trials II. Circulation 2005;112:3363. Mebazaa A, Cohen-Solal A, Kleber F, et al. The SURVIVE-W Trial: Comparison of dobutamine and levosimendan on survival in acute decompensated heart failure. In: American Heart Association Scientific Sessions 2005; November 13-16, 2005; Dallas, Texas. Late Breaking Clinical Trials IV. Circulation 2005;112:3364. Alonso JL, Martinez P, Vallverdu M, Cygankiewicz I, Pitzalis MV, Bayes Geniş A, et al. Dynamics of ventricular repolarization in patients with dilated cardiomyopathy versus healthy subjects. Ann Noninvasive Electrocardiol 2005;10:121-8. Kuo CS, Munakata K, Reddy CP, Surawicz B. Characteristics and possible mechanism of ventricular arrhythmia dependent on the dispersion of action potential durations. Circulation 1983;67:1356-67. Vassallo JA, Cassidy DM, Kindwall KE, Marchlinski FE, Josephson ME. Nonuniform recovery of excitability in the left ventricle. Circulation 1988;78:1365-72. Zabel M, Portnoy S, Franz MR. Electrocardiographic indexes of dispersion of ventricular repolarization: an isolated heart validation study. J Am Coll Cardiol 1995;25:746-52. Day CP, McComb JM, Campbell RW. QT dispersion: an indication of arrhythmia risk in patients with long QT intervals. Br Heart J 1990; 63: 342-344. Somberg JS, Molnar J. Usefulness of QT dispersion as an electrocardiographically derived index. Am J Cardiol 2002; 89: 291-294. 70 16. 17. 18. 19. 20. 21. 22. 23. 24. 25. 26. 27. 28. 29. 30. 31. 32. 33. Van de loo A, Arendts W, Hohnloser SH. Variability of QT dispersion measurements in the surface electrocardiogram in patients with acute myocardial infarction and in normaL subjects. Am J Cardiol 1994; 74: 1113-1118. Textbook of Cardiovascular Medicine Eric J. Topol Lippincott Williams and Wilkins 1998 Section VI Heart Failure and Transplantation Page 2179 2327 Manual of Cardiovascular Medicine E.J. Topol Lippincot Williams and Wilkins 2004 second edition Heart Failure and Transplantation Page 101-175 Heart Disease A Textbook of Cardiovascular Medicine 7th Edition Eugene Braunwald, Douglas P. Zipes, Peter Libby, Robert O. Bonow Chapter 19-26 Page 457-652 E. Braunwald, Congestive Heart Failure: A Half Century Perspective Europian Heart Journal 2001;22:825-836 Baig K., Mahon N., McKenna W. The Pathophysiology of Advanced Heart Failure Am Heart J. 1998;135:S216-S230 Kannel WB, Abbott RD, Savage DD, et al. Epidemiologic features of chronic atrial fibrillation: the Framingham study. N Engl J Med 1982; 306:1018 –22.. Vasan RS, Benjamin EJ, Levy D. Prevalance, clinical features and prognosis of diastolic heart failure: An epidemiologic perspective. J An Coll Cardiol 1995; 26(7): 1565-1574 Vasan RS, Benjamin EJ, Levy D. Congestive heart failure with normal left ventricular sistolic function. Arch.İntern Med 1996; 156:146-157 Good CB, McDermott L, McCloskey B. Diet and serum potassium in patients on ACE inhibitors. JAMA 1995; 274: 538. Cooper HA, Exner DV, Domanski MJ. Light-to-moderate alcohol consumption and prognosis in patients with left ventricular systolic dysfunction. J Am Coll Cardiol 2000; 35: 1753-9. Anker SD, Chua TP, Ponikowski P et al. Hormonal changes and catabolic/anabolic imbalance in chronic heart failure and their importance for cardiac cachexia. Circulation 1997; 96: 526-34. Anker SD, Ponikowski P, Varney S, et al. Wasting as independent risk factor for mortality in chronic heart failure. Lancet 1997; 349: 1050-3. DeBusk R, Drory Y, Goldstein I et al. Management of sexual dysfunction in patients with cardiovascular disease: recommendations of The Princeton Consensus Panel. Am J Cardiol 2000; 86: 175-81. Feenstra J, Grobbee DE, Remme WJ, Strieker BH. Drug-induced heart failure. J Am Coll Cardiol 1999; 33: 1152-62. Working Group on Cardiac Rehabilitation and Exercise Physiology and Working Group on Heart Failure of the European Society of Cardiology. Recommendations for Exercise Testing in Chronic Heart Failure patients. Eur Heart J 2001; 22: 12535. LeJemtel TH, Sonnenblick EH, Frishman WH. Diagnosis and management of heart failure. Hurst's The Heart 9th ed, McGraw-Hill, New York 1998, 745-781. The SOLVD investigators. Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure. N Engl J Med 1991; 325:293-302. The SOLVD investigators. Effect of enalapril on mortality and the development of heart failure in asymptomatic patients with reduced left ventricular ejection fractions. N Engl J Med 1992; 327:685-691. 71 34. Cohn JN, Archibald DG, Ziesche S, et al. Effect of vasodilator therapy on mortality in chronic congestive heart failure: Results of the Veterans Administration Cooperative Study. N Engl J Med 1986; 314:1547-1552. 35. Pfeffer MA, Braunwald E, Moye LA, et al. Effect of captopril on mortality and morbidity in patients with left ventricular dysfunction after myocardial infarction: Results of the Survival and Ventricular Enlargement Trial. N Engl J Med 1992; 327:669-677. 36. The Acute Infarction Ramipril Efficacy (AIRE) Study Investigators. Effect of ramipril on mortality and morbidity of survivors of acute myocardial infarct with clinical evidence of heart failure. Lancet 1993; 1342:821-828. 37. Kober L, Torp-Pedersen C, Carlsen JE, et al. A clinical trial of the angiotensinconvertingenzyme inhibitor trandolapril in patients with left ventricular dysfunction after myocardial infarction. Trandolapril Cardiac Evaluation (TRACE) Study Group. N Engl J Med 1995; 33:1670-1676. 38. ACC/AHA Guidelines for the Evaluation and Management of Chronic Heart the Adult. J Am Coll Cardiol. 2005. 39. Remme WJ, Swedberg K. Task force report: Guidelines for the Diagnosis and Treatment of Chronic Heart Failure, European Society of Cardiology. European Heart Journal 2001; 22:1527-1560. 40. Packer M, Poole-Wison PA, Armstrong PW, et al. Comperative effects of low and high doses of the angiotensin-converting enzyme inhibitor, lisinopril, on mortality and morbidity in chronic heart failure. Circulation 1999; 100:2312-2318. 41. Jessup M, Borozana S. Heart failure. N Engl J Med 2003; 348:2007-2018. 42. Kaddoura S, Patel D, Parameshwar J et al. Objective assessment of the response to treatment of severe heart failure using a 9-minute walk test on a patient-powered treadmill. J Card Fail 1996; 2: 133-9. 43. Vargo DL, Kramer WG, Black PK, Smith WB, Serpas T, Brater DC. Bioavailability, pharmacokinetics, and pharma-codynamics of torasemide and furosemide in patients with congestive heart failure. Gin Pharmacol Ther 1995; 57: 601-9. 44. Channer K.S, McLean KA, Lawson-Matthew P, Richardson M. Combination diuretic treatment in severe heart failure: a randomised controlled trial. Br Heart J 1994; 71: 146-50. 45. Edmonds CJ, Jasani B. Total-body potassium in hypertension patients during prolonged diuretic therapy. Lancet 1972; 2: 8-12. 46. Jessup M. Aldosterone blockade and heart failure. N Engl J Med 2003; 348:13801382. 47. Pitt B, Zannad F, Remme WJ, et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. N Engl J Med 1999; 341:709-717. 48. Pitt B, Remme W, Zannad F, et al. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med 2003; 348:1309-1321. 49. Hurst JW. Diagnosis and management of heart failure. In: Hurst JW, ed. The heart. 10th ed. International Edition McGraw Hill, 2001; 687-725. 50. Cohn JN. Improving outcomes in congestive heart failure: Val-HeFT. Valsartan in heart failure trial. Cardiology 1999;91(Suppl 1):19-22. 51. Swedberg K, Pfeffer M, Granger C, Held P, McMurray J, Ohlin G, Olofsson B, Ostergren J, Yusuf S. Candesartan in heart failure--assessment of reduction in 72 52. 53. 54. 55. 56. 57. 58. 59. 60. 61. 62. 63. 64. 65. 66. 67. 68. 69. mortality and morbidity (CHARM): rationale and design. J Card Fail. 1999 Sep;5(3):276-282 Khand AU, Rankin AC, Kaye GC, Cleland JG. Systematic review of the management of atrial fibrillation in patients with heart failure. Eur Heart J 2000; 2: 614-12. The Digitalis Investigation Group. The effect of digoxin on mortality and morbidity in patients with heart failure. N Engl J Med 1997; 336: 525-33. Cohn JN, Johnson G, Ziesche S et al. A comparison of enalapril with hydralazineisosorbide dinitrate in the treatment of chronic congestive heart failure. N Engl J Med 1991; 325: 303-10. Braunwald E. Clinical aspects of heart failure. In: Braunwald E, ed. High-output failure; pulmonary edema' in heart disease. Philadelphia: WB Saunders, 2001; 534-61. Uretsky BF, Young JB, Shahidi FE, et al. Randomized study assesing the effect of digoxin withdrawal in patients with mild-moderate chronic congestive heart failure: results of the PROVED trial. J Am Coll Cardiol 1993; 22:955-962. Packer M, Gheorghiade M, Young JB, et al. Withdrawal of digoxin from patients with chronic heart failure treated with angiotensin-converting enzyme inhibitors. N Engl JMed 1993; 329:1-7. The Digitalis Investigation Group. The effect of digoxin on mortality and morbidity in patients with heart failure. N Engl J Med 1997; 336:525-533 Jessup M, Borozana S. Heart failure. N Engl J Med 2003; 348:2007-2018. Adams KF, Gheorghiade M, Uretsky BF, Petterson JH, Schwartz TA, Young JB. Clinical benefits of low digoxin concentrations in heart failure. J Am Coll Cardiol 2002; 39:946-953. Eichhorn EJ, Gheorghiade M. Digoxin-new perspective on an old drug. N Engl J Med 2002; 347:1394-1395. Feldman AM, Li YY, McTieman CF. Matrix metalloproteinases in pathophysiology and treatment of heart failure. Lancet 2001; 357:654-655. Packer M, Bristow MR, Cohn JN, et al. The effect of carvedilol on morbidity and mortality in patients with chronic heart failure. U.S. Carvedilol Heart Failure Study Group. N Engl J Med 1996; 334:1349-1355. Hjalmarson A, Goldstein S, Fagerberg B, et al. Effects of controlled-release metoprolol on total mortality, hospitalizations, and well-being in patients with heart failure: The Metoprolol CR/XL Randomized Intervention Trial in congestive heart failure (MERIT-HF). MERIT-HF Study Group. JAMA 2000; 283:12951302. The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): A randomised trial. Lancet 1999;353:9-13. Eichhorn EJ, Bristow MR. The Carvedilol Prospective Randomized Cumulative Survival (COPERNICUS) trial. Curr Control Trials Cardiovasc Med 2001; 2:2023. Dargie HJ. Effect of carvedilol on outcome after myocardial infarction in patients with leftventricular dysfunction: the CAPRICORN randomised trial. Lancet 2001; 357: 1385-1390. Braunwald E. Expanding indications for beta-blockers in heart failure. N Engl J Med 2001;344:1711-1712. Cohn JN, Ziesche S, Smith R et al. Effect of the calcium antagonist felodipine as supplementary vasodilator therapy in patients with chronic heart failure treated 73 70. 71. 72. 73. 74. 75. 76. 77. 78. 79. 80. 81. 82. 83. with enalapril: V-HeFT III. Vasodilator-Heart Failure Trial (V-HeFT) Study Group. Circulation 1997; 96: 856-63. Cohn JN, Ziesche S, Smith R et al. Effect of the calcium antagonist felodipine as supplementary vasodilator therapy in patients with chronic heart failure treated with enalapril: V-HeFT III. Vasodilator-Heart Failure Trial (V-HeFT) Study Group. Circulation 1997; 96: 856-63. Thackray S, Witte K, Clark AL, Cleland JG. Clinical trials update: OPTIMECHF, PRAISE-2, ALL-HAT. Eur J Heart Fail 2000; 2: 209-12. Hampton JR, van Vekihuisen DJ, KJeber FX et al. for the Second Prospective Randomised Study of Ibopamine on Mortality and Efficacy (PRIME II) Investigators. Randomised study of effect of ibopamine on survival in patients with advanced severe heart failure. Lancet 1997; 349:971-7. Cleland JG, Cowburn PJ, Falk RH. Should all patients with atrial fibrillation receive warfarin? Evidence from randomized clinical trials. Eur Heart J 1996; 17: 674-81. Steinbeck G, Andresen D, Bach P et al. A comparison of electrophysiologically guided antiarrhythmic drug therapy with betablocker therapy in patients with symptomatic, sustained ventricular tachyarrhythmias. N Engl J Med 1992; 327: 987-92. Cohn JN, Goldstein SO, Greenberg BH, Lorell BH, Bourge RC, Jaski BE, et al. A dose-dependent increase in mortality with vesnarinone among patients with severe heart failure. Vesnarinone Trial Investigators. N Engl J Med 1998;339:1810-6. Holubarsch C. New inotropic concepts: rationale for and differences between calcium sensitizers and phosphodiesterase inhibitors. Cardiology 1997;88 Suppl 2:12-20. Holubarsch C, Ludemann J, Wiessner S, Ruf T, Schulte-Baukloh H, SchmidtSchweda S, et al. Shortening versus isometric contractions in isolated human failing and non-failing left ventricular myocardium: dependency of external work and force on muscle length, heart rate and inotropic stimulation. Cardiovasc Res 1998;37:46-57. Haikala H, Linden IB. Mechanisms of action of calcium- sensitizing drugs. J Cardiovasc Pharmacol 1995;26 Suppl 1:S10-9. Haikala H, Kaivola J, Nissinen E, Wall P, Levijoki J, Linden IB. Cardiac troponin C as a target protein for a novel calcium sensitizing drug, levosimendan. J Mol Cell Cardiol 1995;27:1859-66. Sorsa T, Heikkinen S, Abbott MB, Abusamhadneh E, Laakso T, Tilgmann C, et al. Binding of levosimendan, a calcium sensitizer, to cardiac troponin C. J Biol Chem 2001;276:9337-43. Hasenfuss G, Pieske B, Castell M, Kretschmann B, Maier LS, Just H. Influence of the novel inotropic agent levosimendan on isometric tension and calcium cycling in failing human myocardium. Circulation 1998; 98:2141-7. Bowman P, Haikala H, Paul RJ. Levosimendan, a calcium sensitizer in cardiac muscle, induces relaxation in coronary smooth muscle through calcium desensitization. J Pharmacol Exp Ther 1999;288:316-25. Kaheinen P, Pollesello P, Levijoki J, Haikala H.Levosimendan increases diastolic coronary flow in isolated guinea-pig heart by opening ATP-sensitive potassium channels. J Cardiovasc Pharmacol 2001;37:367-74. 74 84. 85. 86. 87. 88. 89. 90. 91. 92. 93. 94. 95. 96. 97. Haikala H, Kaheinen P, Levijoki J, Linden IB. The role of cAMP- and cGMPdependent protein kinases in the cardiac actions of the new calcium sensitizer, levosimendan. Cardiovasc Res 1997;34:536-46. Jamali IN, Kersten JR, Pagel PS, Hettrick DA, Warltier DC. Intracoronary levosimendan enhances contractile function of stunned myocardium. Anesth Analg 1997;85:23-9. Lubsen J, Just H, Hjalmarsson AC, La Framboise D,Remme WJ, Heinrich-Nols J, et al. Effect of pimobendan on exercise capacity in patients with heart failure:main results from the Pimobendan in Congestive Heart Failure (PICO) trial. Heart 1996;76:223-31. Kivikko M, Antila S, Eha J, Lehtonen L, Pentikainen PJ. Pharmacokinetics of levosimendan and its metabolites during and after a 24-hour continuous infusion in patients with severe heart failure. Int J Clin Pharmacol Ther 2002;40:465-71. Antila S, Honkanen T, Lehtonen L, Neuvonen PJ. The CYP3A4 inhibitor intraconazole does not affect the pharmacokinetics of a new calcium-sensitizing drug levosimendan. Int J Clin Pharmacol Ther 1998; 36:446-9. Antila S, Jarvinen A, Honkanen T, Lehtonen L. Pharmacokinetic and pharmacodynamic interactions between the novel calcium sensitiser levosimendan and warfarin. Eur J Clin Pharmacol 2000;56:705-10. Lehtonen L, Sundberg S. The contractility enhancing effect of the calcium sensitiser levosimendan is not attenuated by carvedilol in healthy subjects. Eur J Clin Pharmacol 2002;58:449-52. Slawsky MT, Colucci WS, Gottlieb SS, Greenberg BH, Haeusslein E, Hare J, et al. Acute hemodynamic and clinical effects of levosimendan in patients with severe heart failure. Study Investigators. Circulation 2000; 102:2222-7. Nieminen MS, Akkila J, Hasenfuss G, Kleber FX, Lehtonen LA, Mitrovic V, et al. Hemodynamic and neurohumoral effects of continuous infusion of levosimendan in patients with congestive heart failure. J Am Coll Cardiol 2000;36:1903-12. Thackray S, Easthaugh J, Freemantle N, Cleland JG.The effectiveness and relative effectiveness of intravenous inotropic drugs acting through the adrenergic pathway in patients with heart failure-a meta-regres-sion analysis. Eur J Heart Fail 2002;4:515-29. Moiseyev VS, Poder P, Andrejevs N, Ruda MY, Golikov AP, Lazebnik LB, et al. Safety and efficacy of a novel calcium sensitizer, levosimendan, in patients with left ventricular failure due to an acute myocardial infarction. A randomized, placebo-controlled, double-blind study (RUSSLAN). Eur Heart J 2002;23:142232. Zairis MN, Apostalatos C, Anastassiadis F, Kouris N, Grassos H, Sifaki M, et al. Comparison of the effect of levosimendan, or dobutamine or plasebo in chronic low output decompansated heart failure. CAlcium Sensitizer or Inotrope or NOne in Low-Output Heart Failure (CASINO) study. In: Program and abstracts of the European Society of Cardiology, Heart Failure Update 2004; June 12-15, 2004; Wroclaw, Poland. Abstract 273. Nieminen MS, Bohm M, Cowie MR, Drexler H, Filippatos GS, Jondeau G, et al. Executive summary of the guidelines on the diagnosis and treatment of acute heart failure: the Task Force on Acute Heart Failure of the European Society of Cardiology. Eur Heart J 2005; 26:384-416. Lilleberg J, Nieminen MS, Akkila J, Heikkila L, Kuitunen A, Lehtonen L, et al. Effects of a new calcium sensitizer, levosimendan, on haemodynamics, coronary 75 98. 99. 100. 101. 102. 103. 104. 105. 106. 107. 108. 109. 110. 111. 112. 113. 114. blood flow and myocardial substrate utilization early after coronary artery bypass grafting. Eur Heart J 1998; 19:660-8. Swedish Medical Pruducts Agency [homepage on the Internet]. Simdax (levosimendan): summary of the product characteristics. Available from: http://www. lakemedelsverket.se/upload/SPC_PIL/Pdf/enhumspc/Simdax Follath F, Franco F, Cardoso JS. European experience on the practical use of levosimendan in patients with acute heart failure syndromes. Am J Cardiol 2005; 96:80G-5G. Figgitt DP, Gillies PS, Goa KL. Levosimendan. Drugs 2001;61:613-27. Singh BN, Lilleberg J, Sandell EP, Ylonen V, Lehtonen L, Toivonen L. Effects of levosimendan on cardiac arrhythmia: electrophysiologic and ambulatory electrocardiographic findings in phase II and phase III clinical studies in cardiac failure. Am J Cardiol 1999;83:16(I)-20(I). Packer M, Leier CV. Survival in congestive heart failure during treatment with drugs with positive inotropic actions. Circulation 1987;75(5 Pt 2):IV55-63. Holroyde MJ, Robertson SP, Johnson JD, Solaro RJ, Potter JD. The calcium and magnesium binding sites on cardiac troponin and their role in the regulation of myofibrillar adenosine triphosphatase. J Biol Chem 1980;255:11688-93. Podzuweit T, Lubbe WF, Opie LH. Cyclic adenosine monophosphate, ventricular fibrillation, and antiarrhythmic drugs. Lancet 1976;1:341-2. Yusuf S, Teo KK. Inotropic agents increase mortality in patients with congestive heart failure [Abstract]. Circulation 1990;82(Suppl. III):673. Uretsky BF, Jessup M, Konstam MA, Dec GW, Leier CV, Benotti J, et al. Multicenter trial of oral enoximone in patients with moderate to moderately severe congestive heart failure. Lack of benefit compared with placebo. Enoximone Multicenter Trial Group. Circulation 1990;82:774-80. Burger AJ, Horton DP, LeJemtel T, Ghali JK, Torre G, Dennish G, et al. Effect of nesiritide (B-type natriuretic peptide) and dobutamine on ventricular arrhythmias in the treatment of patients with acutely decompensated congestive heart failure: the PRECEDENT study. Am Heart J 2002;144:1102-8. Felker GM, Benza RL, Chandler AB, Leimberger JD, Cuffe MS, Califf RM, et al. Heart failure etiology and response to milrinone in decompensated heart failure: results from the OPTIME-CHF study. J Am Coll Cardiol 2003;41:997-1003. Unverferth DA, Blanford M, Kates RE, Leier CV. Tolerance to dobutamine after a 72 hour continuous infusion. Am J Med 1980;69:262-6. Colucci WS, Wright RF, Braunwald E. New positive inotropic agents in the treatment of congestive heart failure. Mechanisms of action and recent clinical developments. 2. N Engl J Med 1986;314:349-358. Leier CV, Binkley PF. Parenteral inotropic support for advanced congestive heart failure. Prog Cadiovasc Dis. 1998; 41(3): 207-224. Stevenson LW. Clinical use of inotropic therapy for heart failure: looking backward or forward? Part I: inotropic infusions during hospitalization. Circulation 2003;108:367-372. Kivikko M, Antila S, Eha J, Lehtonen L, Pentikainen PJ. Pharmacodynamics and safety of a new calcium sensitizer, levosimendan, and its metabolites during an extended infusion in patients with severe heart failure. J Clin Pharmacol 2002;42:43-51. Stevenson LW. Inotropic therapy for heart failure. N Engl J Med 1998;339:18481850. 76 115. Dies F, Krell MJ, Whitlow P, Liang CS, Goldenberg I, Applefeld MM, et aL. Intermittent dobutamine in ambulatory outpatients with chronic cardiac failure [Abstract]. Circulation 1986;74 (Suppl 11):11-38. 116. Capomolla S, Febo O, Opasich C, Guazzotti G, Caporotondi A, La Rovere MT, et aL. Chronic infusion of dobutamine and nitroprusside in patients with end-stage heart failureawaiting heart transplantation: safety and clinical outcome. Eur J Heart Fail 2001;3:601-610. 117. Abraham WT, Adams KF, Fonarow GC, Costanzo MR, Berkowitz RL, LeJemtel TH, et al. In-hospital mortality in patients with acute decompensated heart failure requiring intravenous yasoactive medications: an analysis from the Acute Decompensated Heart Failure National Registry (ADHERE). J Am Coll CardioI2005;46:57-64. 118. Maskin CS, Ocken S, Chadwick B, LeJemtel TR. Comparatiye systemic and renal effects of dopamine and angiotensin-converting enzyme inhibition with enalaprilat in patients with heart failure. Circulation 1985;72: 846-852. 119. Metra M, Missale C, Spano PF, Cas LD. Dopaminergic drugs in congestive heart failure: hemodynamic and neuroendocrine responses to ibopamine, dopamine, and dihydroergotoxine. J Cardiovasc Pharmacol 1995;25: 732-740. 120. Neiminen MS, Bohm M, Cowie MR, Drexler H, Filippatos GS, Jondeau, et al. Executive summary of the guidelines on diagnosis and treathment of acute herat failure: the Task Force on Acute Herat Failure of the European Society of Cardiology. Eur Heart J 2005; 26:384-416. 121. Pagani M, Malfatto G,Pierini S et al. Spectral analysis of heart rate variability in the assasment of diabetic autonomic neuropathy.J Auron Nerv.Sys 1988; 23(2):143-153 122. Glancy JM,Garrat CJ, Woods Kl.. QT dispersion and mortality after miyocardial infarction.Lancet 1995;345:945-948 123. Barr CS, Naas A, Lang Cc et al. QT dispersion and sudden unexpected death in chronic heart failure. Lancet 1994;343:327-329 124. Campbell RWF,Gardiner P,Amos PA.Measurement of the QT interval.Eur Heart J 1985;6:81-83 125. Cowan JC, Yusoff K, Moore M. Importence of lead selection in QT interval measurement-Higham PD, Hilton CJ, Aitcheson DA.QT dispersion does reflect regional variation in ventricular recovery.Circulation 1992;86:392 126. Hnatkova K,Malik M,Yi G,Camm AJ.Adjustment of QT dispersion assessed from 12 lead ECG’s for different number of analysed elektrocardiographic leads:comparison of stability of different methods.Br Heart J 1994;72:390-396. 127. Bazett HC.An analysis of time relations of electrograms.Heart 1920;7:353-70 128. Hodges M,Salerno Q,Erlien D.Bazett’s QT correction reviewed.Evidence that a linear QT correction for heart rate is better.J Am Coll Cardiol 1983;1:694 129. Macfarlane PW,Lawrie TDV.The normal electrocardiogram and vectorcardiogram.In:Macfarlane PW,Lawrie TDV,eds.Comprehensive Electrocardiology.Oxford,UK.Pergamon Pres;1989;1:407-57. 130. Schwartz PJ, Moss AJ, Vincent GM, Crampton RS. Diagnostic criteria for the long QT syndrome. An update. Circulation 1993; 88:782-4. 131. Vincent GM, Timothy KW, Leppert M, et al. The spectrum of symptoms and QT intervals in carriers of the gene for the long QT syndrome. N Engl J Med 1992; 327:846-52. 77 132. Allan WC, Timothy KW, Vincent GM, et al. Long QT syndrome in children: the value of rate corrected QT interval and DNA analysis as screening tests in the general population. J Med Screen 2001; 8:173-7 133. Pye Mp, Cobbe Sm:Mechanisms of ventricular arrhytmias in cardiac failure and hypertrophy.Cardiovasc Res 1992;26:740-750 134. Zabel M,Klingenheben T,Franz MR,Hohnloser SH.Assesment of QT dispersion for prediction of mortality or arrhythmic events after myocardial infarction:Result of prospective long tern follow up study.Circulation 1998;97:2543-2550 135. Balanescu S, Galinier M, Fourcade J, et al. Correlation between QT interval dispersion and ventricular arrhythmia in hypertension. Arch Mal Coeur Vaiss 1996; 89: 987-90. 136. Papandonokis E,TsoukasA,Chiristakos S QT dispersionas a non invasive arrhytmogenic marker in acute myocardial infarction. Ann Noninvas Electrocardiol 1999;4:35-38 137. Lee KW,Okin PM,Kligfield P,et al.Precorfial QT dispersion and inducible ventricular tachycardia.Am Heart J 1997;134:1005-1013 138. Brooksby P,Robinson PJ,Segal R,et al.onbehalf of the ELİTE study group .Effects of losartan and captopril on QT dispersion in elderly patients with heart failure.Lancet 1999;534:395-396 139. Baranowski R,Malecka L,Poplawska W et al . Analysis of QT dispersions in patients with hypertrophic cardiomyopathy correlation with clinical data and survival(abst).Eur Heart J 1998;19:suppl:428 140. Priori SG,Napolitano C,Diehl L et al.Dispersions of the QT interval.A marker of therapeutic efficacy in the idiopatic long QT syndrome.Circulation 1994 ;89:16811689. 141. Glassman AH,Roose SP,Rivelli SK,Preud’Homme XA.Cardiovascular effects of antidepressant drugs.Nord J Psychiatry 1993;30:41-47 142. Veglio M,Bruno G,Borra M, et al.Prevalance of increased QT interval duration and dispersion in type 2 diabetic patients and its relationship with coronary heart disease:a population-based cohort.J Intern Med 2002;251:317-324. 143. Beaubien ER,Pylypchuk GB,Akhtar J et al.Value of corrected QT interval dispersion inidentifying patients initiating dialysis at increased risk of total and cardiovascular mortality.Am J Kidney Dis 2002;39:834-842. 144. Clarkson PB,Naas AA,McMahon A,MacLeod C,Struthers AD,MacDonald TM.QT dispersion in essential hypertension.QJM 1995;88:327-32. 145. Bujag G,Miorelli M,Turrini P,Melacini P,Nova A,Comparison of QT dispersion in hypertrophic cardiomyopathy between patients with and without ventricular arrhytmias and sudden death.Am J Cardiol 1993;72:973-6. 146. Elming H,SonneJ,Lublin HK.The importance of QT interval :a review of the literature.Acta Psychiatr Scand 2003;107:96-101. 147. Cowan JC, Yusoff K, Moore M, et al. Importance of lead selection in QT interval measurement. Am J Cardiol 1988; 61: 83-87. 148. Higham PD, Campell RW. QT dispersion. Br Heart J 1994; 71: 508-510. 149. Helming H,Holm E,Jun L et al .The prognostic value of QT interval and QT dispersion in all cause and cardiak mortality and morbidity in a population of danish citizens.Eur Heart J ;19:1391-13401998 150. Fananapazir L, Chang AC, Epstein SE, McAreavey D. Prognostic determinants in hypertrophic cardiomyopathy. Prospective evaluation of a therapeutic strategy 78 151. 152. 153. 154. 155. 156. 157. 158. 159. 160. 161. 162. 163. 164. 165. 166. based on clinical, Holter,hemodynamic,and electrophysiological findings.Circulation 1992; 86: 730-40. Savelieva I,Yi G, Guo X, Hnatkova K, Malik M. Agreement and reproducibility of automatic versus manual measurement of QT interval and QT dispersion. Am J Cardiol 1998; 81: 471-477. McLaughlin NB, Campbell RW, Murray A. Accuracy of four automatic QT measurement techniques in cardiac patients and healthy subjects. Heart 1996;76 422- 426. Grimm W, Steder U, Menz V, Hoffman J, Maisch B. QT dispersion and arrhythmic events in idiopathic dilated cardiomyopathy. Am J Cardiol 1996; 78: 458-61. Bonnar CE, Davie AP, Caruana L, Fenn L, Ogston SA, McMurray JJ, et al. QT dispersion in patients with chronic heart failure: beta-blockers are associated with a reduction in QT dispersion. Heart 1999;81:297-302. Galinier M, Vialette JC, Fourcade J, Cabrol P, Dongay B, Massabuau P, et al. QT interval dispersion as a predictor of arrhythmic events in congestive heart failure. Importance of aetiology. Eur Heart J 1998;19:1054-62. Brendorp B, Elming H, Jun L, Kober L, Malik M, Jensen GB, et al. QT dispersion has no prognostic information for patients with advanced congestive heart failure and reduced left ventricular systolic function. Circulation 2001;103:831-5. Brooksby P, Batin PD, Nolan J, Lindsay SJ, Andrews R, Mullen M, et al. The relationship between QT intervals and mortality in ambulant patients with chronic heart failure. The United Kingdom Heart Failure Evaluation and Assessment of Risk Trial (UK-HEART). Eur Heart J 1999;20:1335-41. Radmanabhan S, Amin J, Silvet H, Pai RG. QT dispersion has no impact on mortality in patients with moderate and severe left ventricular dysfunction: Results from a cohort of 2263 patients. [Abstract] J Am Coll Cardiol 1999;33:107A Ambulatory intermittent. 6-month low-dose dobutamine infusion in severe heart failure: DICE multicenter trial. J Am Coll Cardiol 1997;29:326A. Ferrick KJ, Fein SA, Ferrick AM, Doyle JT. Effect of milrinone on ventricular arrhythmias in congestive heart failure. Am J Cardiol 1990;66:431-4. Dies F, Krell MJ, Whitlow P, Liang CS, Goldenberg I, Applefeld MM, et al. Intermittent dobutamine in ambulatory outpatients with chronic cardiac failure. Circulation 1986;74:II-38. Malik M, Batchvarov VN. Measurement, interpretation and clinical potential of QT dispersion. J Am Coll Cardiol 2000;36:1749-66. Zareba W, Moss AJ, le Cessie S. Dispersion of ventricular repolarization and arrhythmic cardiac death in coronary artery disease. Am J Cardiol 1994;74:550-3. Schiller NB, Shah PM, Crawford M, DeMaria A, Devereux R, Feigenbaum H, et al. Recommendations for quantitation of the left ventricle by two-dimensional echocardiography. American Society of Echocardiography Committee on Standards, Subcommittee on Quantitation of Two-Dimensional Echocardiograms. J Am Soc Echocardiogr 1989;2:358-67. Kasikcioglu HA, Unal S, Tartan Z, Uyarel H, Okmen E, Kasikcioglu E, et al. Effects of levosimendan on left ventricular functional remodelling and exercise intolerance: a tissue Doppler study. J Int Med Res 2005; 33:397-405. Greenberg B, Borghi C, Perrone S. Pharmacotherapeutic approaches for decompensated heart failure: a role for the calcium sensitiser, levosimendan? Eur J Heart Fail 2003;5:13-21. 79 167. Kaşıkcıoğlu A, Tartan Z, Uyarel H, Ünal Ş. . İskemik kardiyomiyopatinin akut dekompansasyonunda levosimendan tedavisinin QT dispersiyonu üzerine etkisi. XXI. Ulusal Kardiyoloji Kongresi. 80