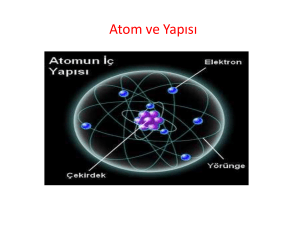
Slayt 1
advertisement

4. PERİYODİK TABLO 1 2 3 4 5 6 7 8 9 (8 B grubu 3 kolon içerir.) 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 Oktet Kuralı Atomlar daha kararlı olabilmek için son yörünge elektronlarını sekize (s2 p6) tamamlamak isterler (soygaz yapısına benzemek için). Bu şekilde en dış enerji seviyesindeki elektron sayısını kendilerine en yakın olan soygazınkine benzetmeye çalışırlar. Atomların bu eğilimine sekizli anlamına gelen oktet kuralı denir. 34 35 36 37 38 39 40 41 42 43 Atom Yarıçapı Atomun çekirdeği ile çekirdeğe en uzak mesafedeki elektron arasındaki uzaklıktır. Elementlerle ilgili özellikler atomun yarıçapı ile yakından ilgilidir. Aynı zamanda atomun elektron verme ve alma kabiliyetini de etkiler. Atom yarıçapları ancak X-ışınları kırınımıyla tespit edilmektedir. Periyodik tabloda aynı grupta yukarıdan aşağıya inildikçe (atom numarası arttıkça) atomik yarıçap artar. Bu da çekirdek çevresindeki elektron bulutunun daha da genişlemesi anlamına gelir. Artan elektron sayısı ile yeni enerji seviyeleri ve yeni orbitaller dolmaya başlar. Proton sayısının da artması çekirdeğin çekim gücünü arttırır. Ancak bu çekim atom hacminde meydana gelecek çok aşırı artışları azaltır. Periyodik tabloda soldan sağa gidildikçe de atom yarıçapı küçülür. Aynı periyotta (aynı yörüngede) soldan sağa elektron sayısı arttığı için çapın artması gerektiği düşünülebilir. Ancak elektron sayısı artınca, proton sayısı da artar. Proton sayısının artması çekirdeğin çekim gücünü arttırdığından, atom yarıçapı aynı periyotta soldan sağa doğru gidildikçe 44 küçülür. 1H 3Li 4Be 5B 6C 7N 8O 9F 10Ne 3Li 11Na 45 İyon Yarıçapı Atomların iyonlarının yarıçapları arasındaki eğilimler, atomik yarıçaplardaki sistematik değişmeye benzer eğilimler gösterir. Katyonların yarıçapları oluştukları atomlardan daha küçük, anyonların yarıçapları ise türetildikleri atomlardan daha büyüktür. İyonik yarıçap, soldan sağa küçülür ve yukarıdan aşağıya doğru artar. Pozitif iyonlarda, dış yörünge elektronlarının azalması ile kalan elektronların her birinin daha fazla protonla çekilmesi mümkün olur. Yani proton sayısının fazla olması çekirdeğin çekim gücünü arttıracağından, birim elektron başına düşen çekirdek çekimi artar ve yarıçap küçülür. Negatif iyonlarda, eklenen fazla elektronlar dış orbitallerde elektronların birbirini itme gücünü arttırır. Dolayısıyla anyonlar oluştukları ametal atomlarından daha büyük yarıçapa sahip olur. Kısaca, çekirdek yükü fazla olanın yarıçapı daha küçük olur. 46 İyonik Yarıçaplar: Li → Li+ 155 60 Na → Na+ 190 95 Be → Be2+ 112 31 Mg → Mg2+ 160 65 F → F- 64 136 Cl → Cl99 181 47 48 49 50 51 52 53 54 Elektronegatiflik Bir molekülde aralarında bağ bulunan her bir atomun bağ elektronlarını göreceli olarak çekme kabiliyetidir. Atomun çekirdek yükü ve çekirdeğin bağ elektronlarına uzaklığına bağlıdır. Periyodik tabloda soldan sağa elektronegatiflik artarken, yukarıdan aşağıya azalır. Atom yarıçapı küçüldükçe, atomun değerlik elektronlarını çekme gücü artar. Yarıçap büyüdükçe de atomun değerlik elektronlarını çekme gücü azalır. Bağ yapan iki atomun elektronegatiflik farkı çok küçükse, bağ elektronlarını ortaklaşa kullanırlar ve bağ kovalenttir. Fark çok büyükse, bağ elektronegatifliği fazla olanın tarafındadır ve iyonik bağdır. Atom yarıçapının artması, elektronegatifliği azalttığından atomlar arasındaki bağın gücü de azalır. Bağ yapımında kullanılan elektronları daha çok çeken atomun elektronegatifliği büyük, daha az çekenin ise elektronegatifliği küçüktür. Böylelikle elektronegatifliği büyük olan atom eksi değerlikli, küçük olan ise artı değerlikli olur. 55 56 57 Elektronegatiflik, aslında bir atomun bir elektron alma eğilimini tarif eder. Klor gibi 1s2 2s2 2p6 3s2 [3p5] dış enerji seviyeleri hemen hemen tamamen doldurulmuş atomlar güçlü elektronegatiftirler ve kolaylıkla elektron alırlar. Buna karşın sodyum gibi dış seviyeleri hemen hemen boş olan 1s2 2s2 2p6 [3s1] şeklindeki atomlar kolaylıkla elektronlarını verirler ve güçlü elektropozitiftirler. Yüksek atom numaralı elementler de düşük elektronegatifliğe sahiptirler. Çünkü dış elektronlar, pozitif çekirdeklerden oldukça uzaktadırlar ve elektronlar atomlara doğru kuvvetlice çekilmezler. Bileşik yapan iki ayrı cins atomun elektronegatiflik değerleri birbirinden çıkarılır. Eğer bu fark 1.7 den büyükse bağ iyonik bağdır. Atomlar arasındaki elektronegativite farkı 1.7 ile 0.5 arasında ise bağ polar kovalent bağ, 0.5 den küçük ise bağ apolar kovalent bağ olarak nitelendirilir. 58