lenfosit immunfenotipleme
advertisement

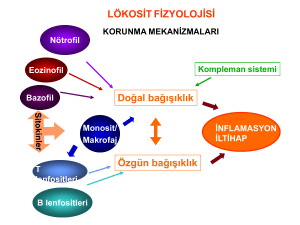
TÜRK İMMUNOLOJİ DERNEĞİ AKAN HÜCRE ÖLÇER ALT GRUBU KILAVUZ BİLGİLER - 1 LENFOSİT İMMUNFENOTİPLEMESİ için KILAVUZ BİLGİLER İlk Çalışma Kopyası Eylül 2010 Akan Hücre Ölçer (Flow Cytometry) Alt Komitesi tarafından hazırlanan bu kılavuz bilgiler, Türk İmmunoloji Derneği web sitesine üyelerin değerlendirme yapmaları; hem içerik hem de format ile ilgili öneri, eleştiri ve eklemelerini bildirmeleri amacı ile eklenmiştir. Yazışmalarınızı [email protected] adresine 30 Ekim 2010 tarihine dek iletmenizi rica ederiz. TÜRK İMMUNOLOJİ DERNEĞİ AKAN HÜCRE ÖLÇER ALT ÇALIŞMA GRUBU Gülderen Yanıkkaya Demirel Günnur Deniz Emel Ekşioğlu Demiralp TÜRK İMMUNOLOJİ DERNEĞİ AKAN HÜCRE ÖLÇER ALT GRUBU KILAVUZ BİLGİLER - 1 1. GENEL BİLGİLER İmmunfenotipleme 1970’li yıllarda monoklonal antikor teknolojilerinin geliştirilmesi sonrasında, tıbbın bir çok alanında yaygın olarak kullanılmaktadır. İmmünfenotipleme; floresan boyalarla görünür hale gelen hücre yüzeyi ve hücre içi belirteçlerin saptanması yöntemidir. Özgül antikorlarla saptanmak istenen antijenik yapıların varlığı ya da yokluğu saptanmaktadır. 1970’li yıllarda mikroskopla immunfenotipleme yapılmakta iken; immunolojide ve akan hücre ölçer programlarının (flow hızla immünfenotipleme cytometry) aşama sistemlerindeki gelişmeler kaydetmesi analizlerinin kısa sayesinde sürede ve günümüzde yapılabilmesi çok yazılım renkli mümkündür. İmmunfenotipleme; tanı, prognoz öngörüsü ve takip aşamalarında klinisyene yararlı bilgiler sağlayan ve yönlendirici olan bir yöntemdir. Bu yazıda lenfosit immünfenotiplemesi ile ilgili temel bilgilerle birlikte preanalitik, analitik ve post analitik dönem özellikleri; temel immunoloji bakışı ve klinisyene baz bilgi oluşturabilecek bir formatla anlatılmaya çalışılmıştır. 1.1. Lenfositler İmmün sistemin temel hücre gruplarından olan lenfositler kandaki çekirdekli hücrelerin ortalama %25’ini oluştururlar. Yaşa göre farklı oranlarda saptanmaktadırlar. Boyutça küçük lenfositler 7-10 μm çapında çekirdekleri daha koyu renkle boyanan hücreler iken daha büyük boyutlu, LGL (Large Granular Lymphocyte) olanlar 10-12 μm çapında, sitoplazmaları daha geniş ve granüllü hücrelerdir. Çevre kanında dolaşan lenfosit alt gruplarını kabaca T, B ve NK (Doğal öldürücü) hücreler olarak sınıflandırabiliriz. Kanda dolaşan lenfositlerin ortalama %80’ini T hücre, %10’unu B hücre geri kalan %10’unu ise NK hücreler oluşturmaktadır. Bu oranlar hücrelerin alındığı dokuya göre değişebilmektedir, timusta hücrelerin nerede ise %90’ı T hücre iken dalak ve lenf nodunda %30-40 oranında T hücre görülmekte, B hücreler daha baskın oranda (%60-70) izlenmektedir (1). TÜRK İMMUNOLOJİ DERNEĞİ AKAN HÜCRE ÖLÇER ALT GRUBU KILAVUZ BİLGİLER - 1 1.1.1. T hücreler kemik iliğinde oluşan prekürsör hücrelerin timusta farklılaşması, olgunlaşması sonrasında çevre kanına çıkarlar. T hücreler immün yanıttaki rollerinin yanı sıra CD4 veya CD8 taşıma özelliklerine göre alt gruplara ayrılırlar. CD4 taşıyan T helper hücrelerin antikor salınımına yardım ederek immün yanıtta rol aldıkları, CD8 taşıyan hücrelerin ise sitotoksik T lenfositler oldukları düşünülse de son yıllarda yapılan araştırmalara göre durum daha karmaşık görünmektedir. Günümüzde daha çok THR (T hücre reseptörü) ile etkileşimlerine göre ayırım yapılması uygun görülmektedir. CD4+ T lenfositler MHC Sınıf II aracılığı ile antijen tanırken, CD8+ hücreler MHC Sınıf I aracılığı ile antijen tanımaktadırlar. T lenfositler salgıladıkları sitokin profili ile de uyumlu olarak Th0, Th1, Th2, Th17 gibi alt gruplara da ayrılmaktadırlar. Dolaşımdaki T hücrelerin yaklaşık %95’i THR alfa/beta pozitiftir, CD4 ya da CD8 pozitifliği taşımayan <%5 oranındaki T lenfositler ise THR gamma/delta pozitiftirler. NKT hücreleri olarak adlandırılan bir alt grup ise CD4 ya da CD8 ile birlikte tek bir V (variable) alfa zinciri (Vα24) şırlar, ta antijenik yapıları MHC üzerinden değil dendritik hücreler üzerinde var olan CD1a üzerinden tanırlar. Erişkin kanında %14 oranında saptanabilen Treg (T regülatör) hücreler ise bir diğer alt gruptur. Treg hücrelerin immün yanıt düzenlenmesinde etkin rol aldıkları, otoimmünite olgularında azalırken kanserde arttıkları, GVHD (Graft versus Host Disease) oluşmasında da rolleri olduğu bildirilmektedir. 1.1.2. B hücreler 7-10 μm çapında lenfositlerdir. Diğer belirteçler yanında yüzey immunoglobulin, özellikle IgM ve IgD taşırlar, düşük oranda IgG ve IgA taşıyabilmektedirler. normalde dolaşımda B hücrelerden gelişen bulunmazlar, bölünme plazma hücreleri yetileri yoktur, (10-15 μm) immunglobulin üretme görevlerini yerine getirirler. CD19, CD20 pozitifliklerinin yanı sıra CD40, CD79, HLA-DR, FcγRII resept örleri (CD32) ve kompleman reseptörleri CD21, CD35 taşırlar. T hücrelerdeki THR benzeri BHR (B Hücre Reseptörü) kompleksini B hücrelerde CD19, CD21 ve CD81 oluştururlar. 1.1.3. NK (Doğal Öldürücü) Hücreler doğal bağışıklık sisteminin parçasıdırlar, diğer lenfositlere göre daha granüllü hücrelerdir. Etkileri sitotoksik T lenfositlere benzerdir, ancak reseptörleri farklıdır ve somatik rekombinasyon genleri ile kodlanmazlar. Sadece NKT hücreleri adı verilen düşük oranlı bir NK hücre grubu somatik rekombinasyonla kodlanan alfa/beta reseptörlerini taşır. NK hücreleri TÜRK İMMUNOLOJİ DERNEĞİ AKAN HÜCRE ÖLÇER ALT GRUBU KILAVUZ BİLGİLER - 1 yüzeylerinde CD16, CD16+56+, CD49b, CD56, CD57, CD314, CD335, CD336, CD337 taşırlar. Sitotoksik etkilerini granzyme ve perforin salımı ile gösterirler. Son yıllarda kabul gören sınıflandırmalara göre ise, T lenfositler alfa/beta ve gamma/delta T lenfositler olarak iki ana gruba ayrılmakta NKT hücreleri ayrı bir alt grup olarak incelenmektedirler (Bakınız. Tablo 1). Tablo 1. Lenfosit Alt Grupları Sınıflandırması Lenfosit Tipi İşlevleri αβ T Hücreler CD4+ helper CD8+ sitotoksik Treg hücreler γδ T hücreler B hücreler Doğal Öldürücü Hücreler NKT hücreler B hücre farklılaşması (humoral immünite) Makrofaj aktivasyonu (hücre aracılı immünite) Enfekte hücreler ve tümör hücrelerinin öldürülmesi Diğer T hücrelerin işlevini baskılar (immün yanıtın düzenlenmesi, öze yönelik toleransın sağlanması) Helper ve sitotoksik işlevler (doğuştan bağışıklık) Antikor oluşturma (humoral immünite) Virüsle enfekte ya da hasarlı hücrelerin öldürülmesi (doğal bağışıklık) Doğuştan ve kazanılmış immün yanıtları baskılar ya da aktive eder. Antijen reseptör ve özgüllüğü αβ heterodimerler peptid-Sınıf II MHC kompleksi için geniş bir özgüllük αβ heterodimerler peptid-Sınıf I MHC kompleksi için geniş bir özgüllük αβ heterodimerler γδ heterodimerler Petid ve non peptid antijenler için kısıtlı kısıtlı özgüllükler Yüzey antikoru Her tipte molekül için geniş spektrumda özgüllükler Farklı aktivatör ve inhibitör reseptörler MHC ve MHC benzeri moleküller için sınırlı özgüllükler αβ heterodimerler (Glikolipid-CD1 için sınırlı özgüllük) Belli başlı belirteçler CD3+, CD8- CD4+, CD3+, CD8+ CD4-, CD3+, CD4+, CD25+ (En çok bilinen immunfenotip, farklı alt grupları var) CD3+, CD4 ve CD8 değişken Fc reseptörleri, Class II MHC, CD19, CD21 CD16 (IgG için Fc reseptörü), CD56, bazı alt gruplarda CD57, KIR, KAR CD16 (IgG için Fc reseptörü), CD3 % Oran Çevre Kanı Lenf Nodu Dalak 50 – 60 50 – 60 50 – 60 20 - 25 15 – 20 10 – 15 <%5 10 10 <%5 ? ? 10 – 15 20 - 25 40 – 45 10 Ender 10 10 Ender 10 Abbas AK ve ark. Cells and Tissues of the Adaptive System, Cellular and Molecular Immunology Int. Edition (6th ed.), 2007’den modifiye edilerek alıntılanmıştır. TÜRK İMMUNOLOJİ DERNEĞİ AKAN HÜCRE ÖLÇER ALT GRUBU KILAVUZ BİLGİLER - 1 2. AKAN HÜCRE ÖLÇER ile LENFOSİT İMMÜNFENOTİPLEMESİ 1970’li yıllarda monoklonal antikor ve floresan boya teknolojilerindeki gelişmeler daha önce DNA ve partikül analizi için kullanılan akan hücre ölçer sistemlerinin immünfenotipleme için kullanılmasına yol açmıştır. Diğer bir çok laboratuar testinde olduğu gibi immünfenotipleme için de preanalitik, analitik, veri analizi ve raporlama aşamaları sonuçların kalitesi açısından önemlidir. 2.1. PRE ANALİTİK AŞAMA 2.1.1. Monoklonal Antikor ve Panel Seçimi Günümüzde daha çok bilgi sağlayıcı olmaları nedeni ile çok renkli paneller kullanılmaktadır. Tek renkle çalışıldığında bir parametre hakkında bilgi sağlanabilmekte iken, çok renkli çalışmada renk sayısı arttıkça değerlendirilebilen parametre seçimi de artmaktadır. Renk ayırımı, standardizasyonun iyi sağlanamaması gibi nedenlerle rutin uygulamalarda dört renkli kombinasyonların uygulanmasının yeterli olacağını düşünmekteyiz. Panel seçiminde özellikle dikkatli olunması gereken unsurları sıralarsak; öncelikle hangi parametreyi çalışmak üzere bu analizi yapmak istediğimizi belirlemek gerekir. İlgili antikorların klonlarının amaca uygunluğu mutlaka kontrol edilmelidir, üretici kataloglarına bakıldığında CD3 gibi temel bir belirteç için bile birden fazla klon seçeneği olduğu görülecektir. Her klon analizde ölçülmek istenen epitopu tanımayabilir, bu nedenle uygunluğu mutlaka doğrulanmalıdır. Total lenfosit tanısında CD3 yerine CD2 kullanılması doğal öldürücü hücrelerin de (NK) CD2 taşımaları nedeni ile uygun değildir (3). Çok renkli çalışmalarda renk kombinasyonlarının seçimi önemlidir. Bazı antikorlar bazı floresan boyalarla uygun sonuçlar vermeyebilir (Bazı antikorlar FITC konjuge olduklarında yanlış pozitifliklere yol açabilirken aynı antikorun PE konjugatı ile daha sağlıklı sonuçlar elde edilmektedir, örneğin CD10). 2.1.2. Örnek Özellikleri ve Örnek Taşınması Çevre kanı, kemik iliği aspirasyon örnekleri, beyin omur ilik sıvısı, periton sıvısı, solid doku örneklerinden yapılabilmektedir. (lenf nodu vb.) lenfosit immunfenotiplemesi TÜRK İMMUNOLOJİ DERNEĞİ AKAN HÜCRE ÖLÇER ALT GRUBU KILAVUZ BİLGİLER - 1 Her türlü immunfenotipleme için örnek alımı ve laboratuara ulaştırılmasında dikkat edilmesi gereken kurallar bu örnekler için de geçerlidir. Çevre kanı, kemik iliği örnekleri heparin veya EDTA’lı tüplere alınabilirler. Bu tüpler oda ısısında saklandıklarında ortalama 24 saate dek örneklerde belirgin değişikliğe yol açmamaktadırlar. Kan sayımlarının da sağlıklı yapılabilmesi için pratikte daha çok EDTA’lı tüpler kullanılmaktadır. Hücrelerin herhangi bir reaktif ile fikse edilmesi; frajil hücrelerin kaybı, antijen ekspresyonunun azalması ve otofloresansın artması gibi istenmeyen etkilerin ortaya çıkmasına yol açmaktadır. Pıhtılaşmış, içinde aggregatlar olan örneklerden hücrelerin aggregatlara yapışmış olması nedeni ile immünfenotipleme yapılmamalıdır. Şekil 1. Örnek dağılım özelliklerinin zaman içinde değişimi Örnek alındığında 12 saat sonra 24 saat sonra Aynı örneğin zaman içinde boyut ve granülariteye göre saçınım özelliklerinin değişimi ve işaretleme alanında oluşan değişiklikler Şekil 1.de izlenmektedir. 24 saat sonrasında ölü hücrelerin artması, hücre membranında oluşan değişiklikler nedeni ile granülosit popülasyonu azalırken lenfosit popülasyonu net sınırlarla izlenemez hale gelmektedir. Çevre kanı ve kemik iliği örnekleri alınırken; tüplerin amaca uygun antikoagülan içerdikleri, tüp üzerinde işaretli volüm kadar örnek alındığı, etiketlemenin doğru yapıldığı mutlaka kontrol edilmelidir. TÜRK İMMUNOLOJİ DERNEĞİ AKAN HÜCRE ÖLÇER ALT GRUBU KILAVUZ BİLGİLER - 1 Beyin omur ilik sıvısı, periton sıvısı vb. sıvılar oda ısısında herhangi bir additif içermeyen steril kaplar içinde taşınmalıdır. Bu tür örneklerin en geç iki-altı saat içinde çalışmaya alınması gereklidir. Hücrelerin daha uzun süre etkilenmeden kalabilmesi için hücre kültürü medyumu ile 1:1 oranında sulandırılarak 48 saate dek bekletilmeleri mümkün olabilmektedir. Ancak bu tür örnekler kıymetli örnekler oldukları için bekletilmeden çalışılmaları uygundur. Solid doku örnekleri mutlaka dondurulmadan ve fikze edilmeden en geç 1 saat içinde laboratuvara ulaştırılmalıdır. İdeal taşıma ve saklama yöntemi steril bir kapta serum fizyolojik içinde örnek gönderilmesidir. Islatılmış sargı bezi içinde gönderilen örneklerde hızla hücre ölümü gerçekleşmesi nedeni ile analiz yapılamamaktadır. Örnek 1 saat içinde laboratuara ulaştırılamayacaksa yaklaşık 0.5 cm.lik kesitler yapılarak serum fizyolojik içine alınması daha doğru olacaktır. Bu tür örneklerden patoloji laboratuarına da örnek gönderilecekse akan hücre ölçer laboratuarı ile patoloji laboratuarının iyi bir iletişim ve iş birliği oluşturması gereklidir. Tüm immünfenotipleme örneklerinin ortam ısısında (17 – 25oC) taşınması gereklidir. Daha soğuk ya da daha sıcak ortamlarda örnek transportu hücre membranında değişikliklere yol açarak antijenlerin saptanma oranlarını etkilemektedir. İmmünfenotipleme örnekleri buzdolabında saklanmamalıdır. Takip gerektiren örneklerin (belirli zaman dilimlerinde yeniden ölçüm yapılması gereken örneklerin) günün aynı saatinde alınması sonuçların karşılaştırılabilirliği açısından önemlidir. 2.1.3. Örneklerin Hazırlanması Örnek hazırlama ve yıkama aşamalarında kullanılan tüm solüsyonların steril bidistile su ile hazırlanması, pH değerlerinin her gün ölçülerek 7.2 – 7.4 değerinde tutulması, tüm solüsyonların 0.2 mikronluk laboratuar tipi filtrelerden geçirilerek kullanılması önemlidir. İmmunfenotipleme örneklerinin hazırlanmasında çevre kanı ve kemik iliği aspirasyonu örnekleri için tam kan lizis uygulaması standart hale gelmiş bulunmaktadır. Mononükleer hücre süspansiyonu hazırlayarak çalışmak bazı hücrelerin yüzeyinden antijenik bağlanma bölgesinin kopmasına (CD8, CD56 vb.), hücrelerin bir bölümünün kaybedilmesine yol açtığı için giderek daha az kullanılan bir yöntem haline gelmiştir. Tüm akan hücre ölçer analizlerinde olduğu TÜRK İMMUNOLOJİ DERNEĞİ AKAN HÜCRE ÖLÇER ALT GRUBU KILAVUZ BİLGİLER - 1 gibi lenfosit immunfenotipleme örneklerinde de hücre sayısının bilinmesi ve hazırlık aşamasında <10,000 hücre/µl olacak şekilde hücre konsantrasyonunun ayarlanması gerekir. Kalibrasyonu iyi yapılmış, günlük kalite kontrolleri düzenli olarak yapılan konsantrasyonun bir kan sayım ayarlanması sistemi hem de ile kan işaretli sayımı alandaki yapılması hücre hem oranının karşılaştırılabilmesi için veri sağlayacaktır. Günümüzde daha çok direkt boyama yöntemleri kullanılarak örnek hazırlanmaktadır. Hazırlık aşamasında her laboratuar çalışılan teste uygun olarak hazırlık yöntemi belirlemektedir. Son yıllarda “no wash/lyse” yöntemi olarak adlandırılan yıkama yapmadan örnek hazırlama yöntemi daha ideal bir yöntem olarak kabul edilmekte ise de değişken floresan/protein oranları, non spesifik bağlanmaların tam anlamı ile bertaraf edilememesi nedeni ile pratikte, ”lyse/wash” sistemi daha iyi sonuçlar elde edilmesini sağlamaktadır. Bu amaç için kullanılmak üzere çok sayıda ticari kit bulunmaktadır, ancak laboratuarların kendi lizis solüsyonlarını hazırlamaları (örneğin, NH 4 Cl 2 ) hem daha ucuz hem de pratiktir. Lizis solüsyonlarının pH değeri 7.2 – 7.4 olmalıdır. Örnek laboratuara ulaştıktan sonra lenfosit immünfenotiplemesi için temel aşamalar aşağıdaki akış şemasında özetlenmiştir. Şekil 2. Lenfosit immunfenotipleme örnekleri analizi akış şeması TÜRK İMMUNOLOJİ DERNEĞİ AKAN HÜCRE ÖLÇER ALT GRUBU KILAVUZ BİLGİLER - 1 Örnek Kabulu Hücre Sayımı (otomatik kan sayım cihazı ya da manuel yöntemle) Hücre Konsantrasyonunun <10.000 hücre/μl’ye ayarlanması 100 μl kan + titrasyonla belirlenen miktarda antikor 15 – 30 dk oda ısısı ya da buzdolabında karanlıkta inkübasyon 2 ml lizis solüsyonu 10 dk oda ısısında karanlıkta inkübasyon 2 kez yıkama 400 g, 5 dakika Lab protokolünde varsa fikzatif 1:1 oranında Akan hücre ölçer analizi Lenfosit immunfenotipleme panellerinde araştırma amacı ile çok farklı monoklonal antikor kombinasyonları kullanarak bir çok alt grubu tanımlamak mümkündür. Aşağıda Tablo 2’de daha çok rutin amaçla kullanılabilecek antijenik yapılar listelenmiştir. Tablo 2. Lenfosit Yüzey Antijenleri T hücreler Pan T hücre : CD3, CD2, CD7, CD5 T hücre Alt Grubu : CD4 (T helper), CD8 (T sitotoksik/supressor) İşlevsel Yüzey Belirteçleri : CD28, CD38, CD45RA, CD45RO, CD62L Aktivasyon Belirteçleri : CD25, CD40L, CD69, CD71, HLA-DR B Hücreler Pan B Hücreler : CD19, CD20, yüzey immunoglobulinler B hücre Alt Grubu : CD5, CD21 İşlevsel yüzey belirteçleri : CD27, CD40 TÜRK İMMUNOLOJİ DERNEĞİ AKAN HÜCRE ÖLÇER ALT GRUBU KILAVUZ BİLGİLER - 1 Aktivasyon belirteçleri : CD23, CD25 NK (Doğal Öldürücü) Hücreler Pan NK hücresi : CD16, CD56 NK Alt Grubu : CD2, CD8, CD57 2.1.4. Çevre Kanı Dışındaki Örneklerin Hazırlanması Vücut sıvılarından alınan örneklerin hazırlanması doku parçaları içermedikleri takdirde oldukça kolaydır. Örneklerin 300 g de santrifüjlenmesi, süpernatan atıldıktan sonra hücrelerden sayım yapılarak konsantrasyon ayarlaması yapılması gereklidir. Hücrelerin boyanmasında izlenen yöntem çevre kanı ve kemik iliği aspirasyonu örnekleri ile aynıdır. Solid doku örneklerinde örnek özelliklerine göre hazırlık aşaması farklılık gösterebilir. Lenf nodu örneklerinde izotonik bir çözelti içine alınan örnek laboratuvara ulaşır ulaşmaz bir petri içinde bisturi ve pens yardımı ile ikiye ayrılır. Gerekli ise bir bölümü patoloji laboratuarına gönderilir, diğer bölümü ise solüsyonunun içinde, bisturi yardımı ile kazınarak hücre süspansiyonu elde edilir. İstenirse anatomik/histolojik bölgelerden ayrı ayrı hücre süspansiyonu elde edilebilmesi mümkündür. Solüsyona dökülen hücreler tüpe aktarılıp 50 mikronluk bir filtreden geçirildikten sonra santrifüjlenir, hücre sayımı yapılıp hücre konsantrasyonu (1000 -10,000 hücre /mikrolitre) ayarlandıktan sonra boyama aşamasına geçilir. Hücre kültürlerinden immünfenotipleme yapılabilmektedir, ancak hücre ve örnek özelliklerinin çalışmayı yapacak kişi tarafından tam olarak bilinmesi gereklidir. Süspansiyon halinde bir kültürden immünfenotipleme yapılması yapışan hücrelere göre çok kolaydır. Süspansiyon kültürünün alınıp 50 mikronluk bir filtreden geçirilmesi sonrasında hücre konsantrasyonu ayarlanıp direkt ya da indirekt boyama yöntemleri ile hücrelerin boyanması ve rutin analize benzer şekilde analizi yeterlidir. Yapışan hücreler için sorun, flasktan kaldırma aşamasında hücre membran bütünlüğünün etkilenmesi, kullanılan solüsyonlara bağlı olarak membrandan “shedding” ile antijenik yapıların yitmesidir. Bu örneklerden hücre içi yapılarla ilgili immünfenotipleme göreceli olarak daha kolay yapılabilmektedir. 2.1.5. Sistem Kalibrasyonu ve Kalite Güvencenin Sağlanması TÜRK İMMUNOLOJİ DERNEĞİ AKAN HÜCRE ÖLÇER ALT GRUBU KILAVUZ BİLGİLER - 1 Masa üstü akan hücre ölçer sistemlerinin kalibrasyon ve bakımı “sorting” yapan sistemlere göre daha kolaydır. Örnek analizi öncesinde sistem her açıldığında kalibrasyon kontrolü ve renk ayırımı ile ilgili standardize edilmiş boncuklar geçirilerek sistemin performansı kontrol edilmeli, geçerli sonuçlar elde ediliyorsa analiz aşamasına devam edilmelidir. Her laboratuar bu konuda kendi kalite kontrol programını oluşturmalı, yapılan tüm işlemler kayıt altına alınmalıdır. Kullanılan antikorlar MultiCheck, Cyto-Trol benzeri ticari ürünler kullanılarak mutlaka kontrol edilmelidir. Her laboratuar bu kontrol malzemelerini kullanma sıklığını kendi koşullarına uygun olarak belirlemeli, elde edilen sonuçlar zaman parametresi olan grafiklerle (Levy-Jennings grafikleri) süreklilik açısından izlenmelidir. Şekil 2’de CD4 için örnek bir izleme grafiği görülmektedir. Yüzde Pozitiflik Analiz Günleri Levy-Jennings grafiklerinin kullanımı sadece floresans parametreleri için değil, FS (Forward Scatter-Öne Saçınım) ve SS (Side Scatter-Yana Saçınım) parametreleri, sistem voltaj ve kazanç değerleri için de kullanılabilir ve geriye dönük olarak sistem performansı hakkında değerli bilgiler sağlar. Biyolojik değişkenlikler nedeni ile sadece lenfosit immunfenotiplemesi değil, tüm akan hücre ölçer testleri için biyokimya laboratuarlarında geçerli olan kesinlik (precision), doğruluk (accuracy), bias hesaplamalarının yapılması zordur. Bu nedenle özellikle yeni başlayan laboratuarların kontrol amacı ile sağlıklı bilinen kan örneklerini hasta örnekleri ile eş zamanlı çalışmaları, yapılan analizin kalitesini güvence altına almak için uygun olacaktır. 2.2. ANALİZ AŞAMASI Analiz aşamasına gelindiğinde dikkat edilecek konuları ana başlıklar altında toplarsak; - Örnek geçirilecek protokol, panel ile tüple çalışılan monoklonal antikor kombinasyonu uyumlu olmalıdır. Kullanıcı FL1’de yeşil floresans veren FITC benzeri boya, FL2’de PE gibi portakal rengi floresans, FL3’te kırmızı, FL4’de TÜRK İMMUNOLOJİ DERNEĞİ AKAN HÜCRE ÖLÇER ALT GRUBU KILAVUZ BİLGİLER - 1 bordo/mor renkli floresans ölçebileceğini bilmelidir. Her cihaz modelinde filtre özellikleri farklı olabileceği için kullanıcının kendi sisteminin özelliklerini iyi öğrenmesi gereklidir. - Voltaj ve kazanç ayarları kalibrasyon kontrolünde kullanılan ayarlarla aynı olmalıdır. Örnek analizi sırasında değişiklik yapılıyorsa mutlaka kaydı olmalıdır. Kantitatif ölçüm yapılıyorsa kantitasyon boncuklarının geçirildiği ayarlarla hücrelerin analizinin yapıldığı ayarlar aynı olmalıdır. - Önceden hazırlanmış ve standardize edilmiş panellerden örnek geçirilmesi her zaman daha sağlıklı sonuçlar elde edilmesini sağlayacaktır. - Her tüpte belirli sayıda hücre sayılmalıdır. Genel eğilim her tüpte 5,000 10,000, işaretlenen bölgede en az 2500 hücre sayılması yönündedir. Az sayıda hücre saptamaya yönelik analizlerde >1000 hücre/işaretli alan saymak ve her tüpte aynı sayıda hücre saymaya çaba gösterilmelidir. - Analizi yapan kişinin ne tür bilgi toplamaya çalışıldığı hakkında fikri olmalıdır. - Panel ismi, tüp numaraları vb bilgiler sisteme eksiksiz ve genel geçer nomenklatüre uygun yazılmalıdır. - Paneldeki sıralama ile tüpler üzerindeki etiket sıralaması uyumlu olmalıdır. - Analiz sırasında kullanıcı ekranı izlemeli, “flow cell”den geçen hücre sayısında, saçınımda değişiklikler olması halinde analizi durdurarak sorunu giderdikten sonra yeniden analiz yapmalıdır. Çevre kanı örneklerinde FS/SS doğrusal (linear), floresan parametreler ise logaritmik skala ile çalışılmalıdır. Dağılımın iyi olmadığı vücut sıvıları, doku örnekleri vb örneklerde SS de logaritmik olabilir. Ancak rutin uygulamada kullanılmamalıdır. TÜRK İMMUNOLOJİ DERNEĞİ AKAN HÜCRE ÖLÇER ALT GRUBU KILAVUZ BİLGİLER - 1 Şekil 1. CD45/SS ve FS/SS grafiklerinde lenfosit popülasyonlarının işaretlenmesi. Şekil 1’de de izlendiği üzere lenfositler daha küçük boyutlu, granülsüz, CD45 ile parlak boyanan hücrelerdir. 2.2.1. İşaretleme (Gating) Lenfosit popülasyonuna ölü hücreler, çekirdekli eritrositler ve dev trombositlerin karışması ile hücre kontaminasyonu gelişebilir. Saf lenfosit popülasyonu üzerinde analiz yapabilmek için CD45/CD14 (CD45=Pan Lökosit belirteci; CD14=Olgun Monosit belirteci) işaretlemesi ile kontrol uygulamak özellikle yeni başlayanlar için çok yararlıdır. Lenfositler CD45/SC grafiklerinde daha az granüler ve CD45parlak olmaları ile diğer hücrelerden ayırt edilebilirler. Kan sayımında saptanan lenfosit yüzde oranının en az %90 oranında işaretleme alanı içinde olması beklenir. Eğer bu oran sağlanamıyorsa örnek hazırlama ile ilgili önemli sorunlar yaşanmış kabul edilerek yeniden örnek hazırlama yoluna gidilmelidir. Bazı lenfoma ve AIDS olgularında hücrelerin aşırı frajilitesi nedeni ile bu oran sağlanamayabilir, bu örneklerde vorteksleme daha düşük hızlarda yapılmalı, santrifüjleme ve yıkamalarda daha dikkatli olunmalıdır. Eğer lenfosit işaretleme alanında %90 üzerinde lenfosit yoksa elde edilen sonuçlarda düzeltme yapılması gereklidir. Bu düzeltme işlemi elde edilen antikor pozitifliğinin işaretleme alanındaki lenfosit saflık oranına bölümü ile yapılmaktadır. Örneğin CD4 %44 oranında pozitifse ve işaretli alanda lenfosit oranı %83 saflıkta ise 44:0.83= %53 gerçek CD4 pozitifliği oranıdır. TÜRK İMMUNOLOJİ DERNEĞİ AKAN HÜCRE ÖLÇER ALT GRUBU KILAVUZ BİLGİLER - 1 Şekil 3. Lenfosit Alt Grupları için “dot plot” grafiklerle antikor pozitiflikleri. Çok renkli çalışmalarda renk ayrımının (kompenzasyon) doğru yapılması önemlidir. Son beş yılda geliştirilen akan hücre ölçer sistemlerinde renk ayırımı analiz sonrasında da yapılabilmektedir; ancak şu anda ülkemizde yaygın olarak kullanılan eski sistemlerde, örneklerin geçmesi aşamasında renk ayırımı ayarlarını yaparak örnek analizi yapılması gereklidir. Doğru kompenzasyon yapabilmek için çok renkli çalışmada kullanılan antikorların tek renkle geçirildiklerinde elde edilen pozitiflikleri ile renk ayrımı sonrasında elde edilen pozitiflikleri karşılaştırılmalıdır. FL2 FL1 Şekil 4. Solda kompenzasyonu yapılmamış çifte pozitiflik var gibi görünen grafik, sağda aynı verilerle kompenzasyon yapılmış olan grafik. Analiz sırasında en sık karşılaşılan sorunlar ve çözüm önerileri Tablo 3’te sunulmuştur. TÜRK İMMUNOLOJİ DERNEĞİ AKAN HÜCRE ÖLÇER ALT GRUBU KILAVUZ BİLGİLER - 1 Tablo 3. İmmünfenotipleme Analizinde Karşılaşılan Sorunlar ve Çözümleri SORUNLAR “Non specific” bağlanma ÇÖZÜMLERİ Ortamda ölü hücreler varsa işaretleme ya da canlılık boyaları (7-AAD, PI) ile canlı hücrelerin ayrılması Fc reseptör bloklama İnsan IgG veya PBS içinde %10 otolog serum (AB serum da olabilir) Reseptör “recycling” (Antijenin yüzeyde daha az oranda eksprese edilmesi) Örnek çalışılırken uyulması gereken ortam şartlarının (ısı, nem vb) uygun olması, santrifüjlemede hız ve sürelere azami uyum gösterilmesi Yüksek oranda öz ışıma (otofloresans) Her panelde antikor ve boya olmadan tüm işlemlerden geçirilmiş bir ilk tüp kullanımı İlaç kullanımı ile ilgili bilgilerin bilinmesi (Bazı antibiyotikler ve anti kanser ilaçlar hücrelerin öz ışımasını artırmaktadır) Renklerin karışımı Kompenzasyon İlk kez çalışılan testlerde tek renkli antikorla kontrol Çok soluk ya da parlak boyanmaların olması Antikorların titrasyonu Sistem kalibrasyonu, PMT’lerin kontrolü Antikor/floresan kombinasyonunun uygun olmaması Bazı antikorlar bazı floresan boyalarla birlikte iyi sonuç vermeyebilirler. Klinik sonuç verilecekse IVD (in vitro diagnostic use) onayı olan antikorların kullanımına özen gösterilmelidir. Protein/floresan konsantrasyonu mümkün olduğunca 1’e yakın antikorlar kullanılmalıdır. Analiz sırasında aniden geçişin durması Aynı panelde tüpler arası saçınım farklılıkları Hatlarda tıkanıklık olabilir. Önce “Prime” düğmesine basarak basınçla sıvı geçirmek gerekir. Hatlar açılmazsa sırası ile proteolitik solüsyon, düşük konsantrasyonda çamaşır suyu (%10) ve distile su ile sistemde yıkama yapılmalıdır. Akan hücre ölçer sistemlerinin standardizasyonu İçin günlük, aylık, yıllık kalite kontrol ve bakımların düzenli olarak yapılması ve takibi, sistemin UPS aracılığı ile güç kaynağına bağlı TÜRK İMMUNOLOJİ DERNEĞİ AKAN HÜCRE ÖLÇER ALT GRUBU KILAVUZ BİLGİLER - 1 olması Retiküloz, aşırı eksersiz sonrası kan alımı, gün içi değişiklikler, örnek taşıma ve saklama koşulları lenfositler üzerine etkidikleri için analiz kalitesini de etkilemektedirler. Kortikosteroidlerin kullanımı lenfosit marjinasyonunu artırır, CD4 pozitifliği bu kişilerde daha düşük düzeyde izlenebilir, bu olgunun hastalığa bağlı bir değişim olmayabileceği değerlendirilmede göz önünde bulundurulmalıdır. Akan hücre ölçer testleri için validasyon yapılması oldukça zordur, bu nedenle daha çok laboratuarlar arası karşılaştırma programlarına katılımla değerlendirme yapılmaktadır. 3. VERİ ANALİZİ Veri analizinde tüm belirteçler için aynı işaretli bölgeden analiz yapılması gereklidir. İşaretlemede her laboratuvar kendine özgü yöntemi seçmekte özgür olsa da, genel geçer kurallara uyulması gereklidir. FS/SS (Forward Scatter/Side Scatter), CD45/SS, CD3, CD19 vb işaretli bölgelerden analiz yapılabilmesi mümkündür. Son yıllarda daha çok tercih edilen yöntem CD45/SS işaretleme bölgesinin kullanımıdır. Bu yöntem tercih edildiğinde her tüpte CD45 bulunması gerekliliği pratikte göz önünden bulundurulması gereken bir unsurdur. Örneğin: T helper hücrelerin saptanmasına yönelik CD45-FITC/CD4-PE/CD3PerCp işaretli bir tüpün analizinde; CD45/SS, CD3/CD45, CD3/CD4 scattergramları olmalıdır. Bu scattergramlardan birincisinde (CD45/SS) CD45 pozitif hücreler üzerinde ilk işaretleme alanı (Gate 1) CD3/CD45 scattergramında ise ikinci işaretleme alanı olmalıdır (CD3+ hücreler üzerinde), üçüncü scattergram ikinci scattergramda yapılan işaretleme üzerinden CD3+ hücreler içinde CD3+CD4+ hücrelerin oranını sağlamalıdır. Tüm hücreler içindeki CD3+CD4+ hücreler saptanmak isteniyorsa CD45/SS ile izlenen işaretli alandan ölçüm yapılmalıdır (Şekil 1). Örnek analizinin doğrulaması için sık kullanılan öğelerden birisi “Lymphosum” hesaplanmasıdır (5). Aşağıdaki formülle hesaplanmaktadır. “Lymphosum” = T hücre + B hücre + NK hücre = %100 ± 5 TÜRK İMMUNOLOJİ DERNEĞİ AKAN HÜCRE ÖLÇER ALT GRUBU KILAVUZ BİLGİLER - 1 Örneğin: “Lymphosum” = CD3 + CD19 + CD56 = %100 ± 5 Benzer bir formülle (CD2 + CD19/CD20 = %95 ± 5) de doğrulama yapılabileceği de bildirilmektedir ancak pratikte daha çok CD3, CD19 ve CD56 ile hesaplama yapılan formül kullanılmaktadır (6). Tekrarlanabilirlik için en sık uygulanan yöntem aynı hastadan en az üç, mümkünse altı ayrı örnek aynı anda alınıp her biri ayrı ayrı boyanır. Örnekler arasında ±%3 farklılık kabul edilebilir değerdir. Bu değer dışında değerler elde ediliyorsa yöntem, sistem ve kullanıcı ile ilgili olası sorunlar gözden geçirilmelidir. Veri analizi için geliştirilmiş manuel, otomatik ve yarı otomatik modlarla çalışan bir çok yazılım programı bulunmaktadır. Her üretici kendi yazılım programını sistemle birlikte sağlamaktadır ancak gereksinimlere yönelik geliştirilmiş bağımsız yazılım programları olan Flow Jo, FCS Express gibi programlar da yaygın olarak kullanılmaktadır. Özellikle çoklu analizler için gelişkin yazılım programlarının kullanılması bir çok bilgiye daha doğru ve hızlı erişimi sağlamaktadır. Veri analizi için sorunlu alanlardan birisi veri analizinin kullanımı iyi bilen kişiler tarafından daha çok manuel yöntemlerle yapılmasıdır, ancak son yıllarda geliştirilen programlarla 96 ve 384 kuyucuklu mikro plaklardan dahi okuma yapıp otomatik analiz yapacak sistemler geliştirilmektedir. 4. RAPORLAMA Lenfosit immünfenotipleme raporlarında ülkemizde geliştirilmiş bir standart format bulunmamaktadır. Yurt dışında yapılan standardizasyon çalışmalarında her raporda hasta kimlik bilgilerinin yanı sıra örnekteki hücre miktarı, örnek alma tarihi, çalışma tarihi, çalışmayı yapan kurum, teknisyen ve onaylayan kişi ile ilgili bilgilerle birlikte kullanılan monoklonal antikorların IVD (in vitro diagnostic use – in vitro tanıda kullanım) onayı olup olmadığı, kullanılan sistem, dış kalite kontrol programı katılımı vb bilgilerin yer alması önerilmektedir. Tek başına yüzde pozitifliklerin sonuç olarak verilmesi uygun bulunmamaktadır. Absolut değerler ve mümkün ise MFI (Mean Florescent Intensity – Ortalama Floresan Yoğunluğu) ya da MESF (Molecular Equivalent of Soluble Florochromes) değerlerinin birlikte verilmesi önerilmektedir. Parlak ve soluk boyanmalar, farklı boyanma özellikleri gösteren hücre grupları raporda bildirilmelidir. Absolut değerlendirmeler örnek analizi sırasında referans boncuklar (TruCount vb) geçirilerek tek aşamada TÜRK İMMUNOLOJİ DERNEĞİ AKAN HÜCRE ÖLÇER ALT GRUBU KILAVUZ BİLGİLER - 1 yapılabileceği gibi kan sayım sonuçlarından yararlanılarak iki aşamada da yapılabilir. İki aşamalı yöntemde aşağıdaki formül uygulanır: Lökosit sayısı x %lenfosit x %antikor pozitifliği = Absolut sayı/μL 10,000 Yaş ve cinsiyete uygun normal değerler, her laboratuarın kendi popülasyonu için oluşturması gereken değerlerdir. Genel bir referans kullanılması istenirse, çocuklar için yurdumuzda yapılmış, Ankara Üniversitesi Tıp Fakültesi tarafından yayınlanmış sağlıklı bir çalışmanın sonuçları referans değerler olarak kullanılabilir (7). Lenfosit immünfenotiplemesi ile bazı hastalıkların prognozu, bazı tedavi ya da uygulamalara oluşturacakları immün yanıtın önceden tahmin edilebilmesi de mümkün olmaktadır. HIV Syndrome) hastalığının ile tanı, oluşan AIDS (Acquired Immune takip ve tedavisinde CD4 Deficiency ve CD38 immünfenotiplemesi önemli bir yer tutmaktadır. Hematopoietik kök hücre transplantlarında, transplanttan sonra ilk 7-21 saatte CD3+CD4+CD8β+ hücrelerin oranında artış olması GvHD (Graft versus Host Disease) için yüksek oranda prediktif bir test olarak bildirilmektedir (8). 5. DİĞER BİLGİLER İmmunfenotipleme sonuçları her ne kadar çok gelişmiş akan hücre ölçer sistemleri ile elde ediliyor olsa da yorumlanarak hasta sonucu verilen testler olması nedeni ile kullanıcı ve raporlama yapan doktorun bilgi birikimi ve deneyimi sonucu etkilemektedir. Rutin lenfosit immünfenotiplemesi yapan tüm laboratuvarların dış kalite kontrol programlarına katılarak sonuçlarının karşılaştırılabilirliğini saptaması gereklidir. Dış kalite kontrol programları sayesinde rutin uygulamada fark edilemeyen bir çok aksaklık gözlenebilir (9). Özellikle ABD’de akan hücre ölçer laboratuarları karşılaştırma programlarında aldıkları sonuçlara göre sınıflandırılmakta, karşılaştırma programlarında kabul edilir (acceptable) sonuç alan laboratuarlara sertifika verilirken herhangi bir dönemde geçerli sonucu olmayan laboratuar sertifikalı aşamasından bir alt aşama olan “provisionally certified” konumuna geçmektedir. Üst üste iki dönem yeniden geçerli sonuç alan laboratuarların yeniden sertifikalı olmaya hak kazanmaktadırlar. Birbirini izleyen üç dönemde olumsuz sonuç alan laboratuarlar “suspended” laboratuar olarak TÜRK İMMUNOLOJİ DERNEĞİ AKAN HÜCRE ÖLÇER ALT GRUBU KILAVUZ BİLGİLER - 1 değerlendirilmektedirler. Ülkemizde gönüllü katılımla üç yıldan beri gerçekleştirilen bir lenfosit alt grupları laboratuarlar arası karşılaştırma programı bulunmaktadır. İmmünfenotipleme sonuçlarının nihai değerlendirmesi ilgili klinisyen tarafından yapılacaktır. Ancak örnek ya da sonuç ile ilgili özellikli durum söz konusu ise laboratuvar hekimi bu durumu raporda belirtmelidir. Sadece lenfosit immunfenotiplemesi için değil tüm akan hücre ölçer testleri için; kalibrasyonu iyi yapılmış sistemlerde, optimizasyonu iyi yapılmış hazırlık yöntemleri ile bilinçli kullanıcıların test üretmeleri hasta sağlığı ve hekimin sonuçların doğru kullanımı açısından önemlidir. Kaynaklar: 1. Rich RR. The human immune response. Clinical Immunology, Principles and Practice. Editörler: Rich RR, Fleisher TA, Shearer WT, Schroeder HW, Frew AJ, Weyand CM. Mosby Elsevier, ABD, say. 3 – 17, 2008. 2. Abbas AK ve ark. Cells and Tissues of the Adaptive System, Cellular and Molecular Immunology Int. Edition (6th ed.), 2007. 3. Landay A, Ohlsson-Wilhelm B, Giorgi JV. Application of flow cytometry to the study of HIV infection. AIDS 4:479-497, 1990. 4. Landay A, Auer R, Duque R et al. Quality assurance and immunophenotyping of peripheral blood lymphocytes; Tentative guideline. National Committee for Clinical Laboratory Standards 1992;Guideline No H42T. 5. Clinical and Laboratory Standards Institute. Enumeration of Immunologically Defined Cell Populations by Flow Cytometry; Approved Guideline, 2nd ed. CLSI document H42-A2. Wayne, PA:Clinical and Laboratory Standards Institute; 2007. 6. Perfetto S, Ross W, Riley RS ve ark. Quality assurance and quality control in flow cytometry. Riley RS, Mahin EJ, Ross W. Editörler. Clinical Applications of Flow Cytometry. New York, NY: Igaku-Shoin; 1993. 7. İkincioğulları A, Kendirli T, Doğu F, Eğin Y, Reisli I, Cin S, Babacan E. Peripheral blood lymphocyte subsets in healthy Turkish children. Turk J Pediatr. 46(2):125130, 2004. 8. Brinkman RR, Gasparetto M, Shang-Yung JL, Ribickas A, Perkins J, Jannsen W, Smiley R, Smith C. High content flow cytometry and temporal data analysis for defining a cellular signature of Graft versus Host Disease. Biol Blood Marrow Transplant. 13(6):691-700, 2007. 9. Centro FC PT ILC programı, TÜRKAK web sitesi. http://www.turkak.org.tr/pt/ab_proje.asp?#YTler 10. Gratama JW, Kraan J, Van den Beemd R, Hooibrink B, Van Bockstaele DR, Hooijkaas H. Analysis of Variation in Results of Flow Cytometric Lymphocyte Immunophenotyping in a Multicenter StudyCytometry (Communications in Clinical Cytometry) 30:166–177, 1997.




![Teknik Katalog [Çevre Ölçüm Cihazı]](http://s1.studylibtr.com/store/data/003025199_1-5828c9071a4ba2ecb5d081aa71ee2f1f-300x300.png)
![Teknik Katalog [Ses Ölçüm Cihazı]](http://s1.studylibtr.com/store/data/003446913_1-090da28c06de98c0df9ce1a5cd7f136f-300x300.png)
![Teknik Katalog [İklim Ölçüm Cihazı]](http://s2.studylibtr.com/store/data/005331939_1-e0e883d989e543e93f2bc02d9c1fd83c-300x300.png)


![Teknik Katalog [Akım Ölçer]](http://s1.studylibtr.com/store/data/004702071_1-d2ec3c2b1f6bf84211f5f7a4e6478afb-300x300.png)