ppt
advertisement

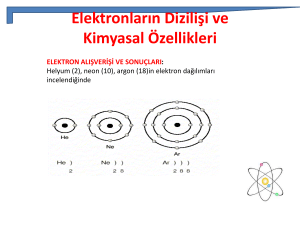
KİMYA KİMYA MADDE SAF MADDE ELEMENT BİLEŞİK KARIŞIMLAR HOMOJEN HETEROJEN ELEMENTLER VE SEMBOLLERİ KİMYA Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Bir elementi oluşturan bütün atomların büyüklükleri ve atomların arasındaki uzaklık aynıdır. Fakat bir elementin atomları ile başka bir elementin atomlarının büyüklükleri ve atomların arasındaki uzaklıkları farklıdır. Aynı elementten yapılan farklı maddeler de aynı cins atomlardan oluşurlar. Elementi oluşturan atomların birbirine olan uzaklığı elementin katı, sıvı ve gaz haline göre değişebilir. Canlı ve cansız varlıkların tamamı elementlerden oluşurlar. 1- Atomik Yapıdaki Elementler : KİMYA Bazı elementleri oluşturan aynı cins atomlar doğada tek başlarına bulunurlar. Böyle atomlara sahip elementlere atomik yapılı elementler denir. Atomik yapılı elementlerin en küçük taneciği atomlardır. Örnek: Demir, bakır, alüminyum, çinko, kurşun, altın gibi elementler atomik yapılıdır. 2- Moleküler Yapıdaki Elementler : Bazı elementleri oluşturan aynı cins atomlar doğada ikili gruplar halinde bulunurlar. Böyle atomlara sahip elementlere moleküler yapılı elementler denir. Moleküler yapılı elementlerin en küçük taneciği moleküllerdir. Örnek: Hidrojen, oksijen, iyot, karbon, fosfor, kükürt, azot... Günümüzde bilinen 118 element vardır. Bu elementlerin 92 tanesi KİMYA doğada bulunurken geri kalanı da laboratuarlarda elde edilen yapay elementlerdir. Elementler sembollerle gösterilir ve her elementin kendine özgü sembolü vardır. Element sembolü yazılırken; • Sembol tek harfli ise büyük harfle yazılır. • Sembol iki veya üç harfli ise ilk harf daima büyük, diğer harfler küçük yazılır. (Sembollerin iki veya üç harften oluşmasının nedeni, bazı elementlerin baş harflerinin aynı olmasıdır). Elementlerin sembollerle gösterilmesinin nedeni, bütün Dünya’da ortak bir bilim dili oluşturmak, bilimsel iletişimi ve yazımlarını kolaylaştırmaktır. KİMYA Elementin Adı Sembolü SODYUM Na HİDROJEN H KLOR CI FLOR F KALSİYUM Ca LİTYUM Li MAGNEZYUM Mg NEON Ne DEMİR Fe GÜMÜŞ Ag ATOM VE YAPISI KİMYA Elementlerin tüm özelliğini gösteren en küçük parçasına atom denir. Atomu oluşturan parçacıklar farklı yüklere sahiptir. Atomda bulunan yükler; negatif yükler ve pozitif yüklerdir. Atomu oluşturan parçacıklar: Cisimden cisme elektrik yüklerini taşıyan negatif yük elektron. Elektronların yükünü dengeleyen aynı sayıda ama pozitif yüklü olan proton. Elektrik yükü taşımayan nötr denir. ELEKTRONLAR ÇEKİRDEK ELEKTRONLR ELEKTRONLAR Atom iki kısımdan oluşur : KİMYA 1.Çekirdek (merkez) 2.Katmanlar (yörünge; enerji düzeyi) Çekirdek, hacim olarak küçük olmasına karşın, atomun tüm kütlesini oluşturur. Çekirdekte proton ve nötronlar bulunur. Elektronlar ise çekirdek çevresindeki katmanlarda bulunur KİMYA PROTON ATOM ÇEKİRDEK NÖTRON KATMANLAR KİMYA Proton sayısı atomlar (elementler) için ayırt edici özelliktir. Yani proton sayısının farklı olması elementin diğerinden farklı olduğu anlamına gelir. Elektronların bulunma olasılığının olduğu bölgelere elektron bulutu denir. Kimyasal olaylarda (reaksiyonlarda) yalnızca elektron sayısı değişir. Proton ve nötron, çekirdekte bulunduğu için sayıları değişmez. Nötr bir atom için; elektron sayısı= proton sayısı (A.N.) Atom numarası= proton sayısı Çekirdek yükü= proton sayısı İyon yükü= proton sayısı – elektron sayısı (E.S.) (K.N.) Kütle numarası= proton + (N.S)nötron sayısı (Nükleon sayısı)(atom ağırlığı) Atom Numarası = Proton Sayısı = Çekirdek Yükü = Elektron sayısı KİMYA İzotop atom: Proton sayıları (atom numaraları)aynı, nötron sayıları farklı olan atomlara denir. İzotop atomların kimyasal özellikleri aynı (p aynı) , fiziksel özellikleri farklıdır (n farklı). Nötr halde bulunmayan, iyon halindeki izotop atomların hem fiziksel, hem kimyasal özellikleri farklıdır. ELEKTRON DİZİLİMİ VE KİMYASAL ÖZELLİKLERİ KİMYA • ELEKTRON ALIŞVERİŞİ VE SONUÇLARI: Helyum (2), neon (10), argon (18)in elektron dağılımlarını aşağıda yapalım Eğer bu üç elementin birer elektronu daha olsaydı, her birinde yeni bir katman oluşacaktı. Çünkü her üçünün de en dıştaki katmanları tamamen dolu durumdadır. • 1.Katmanda en çok 2 elektron bulunması durumu dublet kuralı, 2. ve 3. katmanlarda en çok 8 elektron bulunması durumu oktet kuralı olarak adlandırılır. Helyum dublet, neon ve argon oktet kuralına uyar. Oktet veya dublet kuralına uyan atomlar kararlı yapıya sahiptir. KİMYA KARARLI YAPI OKTET DUBLET KİMYA KİMYA KİMYASAL BAĞLAR KİMYA Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır. İyonik bağlar; elektronlar bir atomdan diğerine aktarıldığı zaman meydana gelir. Tepkimeye giren elementlerden birinin atomları,elektron kaybedip pozitif yüklü iyonlara dönüşürken,diğer elementin atomları elektron kazanıp negatif yüklü iyon oluştururlar. Kovalent bağlarda elektronlar; bir atomdan diğerine KİMYA aktarılmaksızın ortaklaşa kullanılır. Tek kovalent bağ,iki atom tarafından bölünmüş yani ortaklaşa kullanılan bir elektron çiftinden ibarettir. Moleküller birbirlerine kovalent bağlarla bağlanmış atomlardan meydana gelir. Kovalent bağlar yapısına göre ikiye ayrılır: KİMYA Apolar Kovalent Bağ: Aynı cins iki ametal atomunun birleşmesiyle oluşur. kovalent Apolar bağa en iyi örneklerden biri, iki oksijen atomunun elektronlarını ortaklaşa kullanarak oluşturdukları bağıdır. H₂ H₂ Polar Kovalent Bağlar: KİMYA İki farklı cins atomun bir araya gelmesiyle oluşur. Bu bağlarda ametallerden biri ortaklaşa kullanıldığından dolayı molekülün bir ucu pozitif (+), diğer ucu negatif (-) yüklenir Kovalent bağ kuran atomlar arasında ortaklaşa kullanılan KİMYA elektronlar, her iki atomu da dublet ya da oktete ulaştırır. Her iki atoma da iyon diyemeyiz. Çünkü elektron almamış, vermKovalent bağlı yapılar molekül oluşturur. Atomlar arasında elektron ortaklaşması veya elektron alışverişi olmazsa kimyasal bağ da olmaz. KİMYA BİLEŞİKLER VE FORMÜLLERİ HCI NH₃ H₂SO₄ H₂O NaF İki ya da daha fazla farklı element atomunun kendi özellikleriniKİMYA kaybedip belirli oranlarda bir araya gelerek kimyasal bağ oluşturması sonucu meydana gelen yeni ve saf maddelere bileşik denir. Bileşiklerin Özellikleri Bileşiği oluşturan elementler belirli oranlarda birleşirler. Bileşiği oluşturan element atomları arasında kimyasal bağlar bulunur. Bileşikler saf ve homojen maddelerdir. KİMYA Bileşikler oluşurken enerji alışverişi olur. Bileşikler, kimyasal değişmeler sonucu (tepkimelerle) oluşur ve kimyasal yollarla ayrılırlar. Bileşikler en az iki farklı elementten yani atomdan oluşurlar. Bileşiklerin belirli erime, kaynama, donma ve yoğunlaşma sıcaklıkları vardır. Bileşiklerin öz kütleleri sabittir. Bileşikler formüllerle gösterilir KİMYA Bileşikler moleküler yapıda olabilecekleri gibi, olmayabilirler de. Örneğin su, su moleküllerinden oluşur. Çünkü suyu oluşturan hidrojen ve oksijen arasında kovalent bağ vardır.( amonyak, karbondioksit, basit şeker, kükürtdioksit gibi.) Bileşikler moleküler yapıda değilse, bileşiği oluşturan atomlar arasında iyonik bağ vardır. Bu tür bileşiklere iyonik yapılı bileşik denir. İyonlar yığınlar halinde düzgün bir örgü oluşturur.kalsiyumoksit, sodyumiyodür gibi.) Bileşikler içerdikleri elementlere göre adlandırılır. Bileşikleri göstermek için element sembollerini kullanırız. Bunlara formül denir. Bir bileşik formülünde, o bileşiği oluşturan elementlerin sembolleri ve o elementin atomlarından kaç tane olduğu yazılır. CO de 1 karbon atomu, 2 oksijen atomu, HCI’de 1 hidrojen atomu, 1 klor atomu , C H O ‘da 6 karbon, 12 hidrojen, 6 oksijen atomu vardır. BİLEŞİGİN ADI FORMÜLÜ Kalsiyum oksit CaO Su H₂O Sodyum florür NaF Amonyak NH₃ Magnezyum klörür MgCI Karbondioksit CO₂ Azotdioksit NO₂ KİMYA KİMYA KİMYA KİMYA Aerosol (sıvı- gaz) Bir sıvının gaz ile oluşturduğu heterojen karışımlardır.Örnek:deodorantlar, sis, spreyler. Heterojen Karışımların Özellikleri Heterojen özellik gösterirler Bulanık görünürler. Dipte çökelti oluştururlar. Genellikle tanecikleri gözle görülür. Fiziksel yolla (süzme) ayrılırlar. KİMYA KİMYA Homojen Karışımlar (Çözeltiler): Karışımı oluşturan KİMYA maddeler, karışımın her tarafına eşit olarak dağılmışlardır. Örnek: bronz, çelik, sirke, hava, tuzlusu Çözeltiler fiziksel hallerine bağlı olarak katı, sıvı veya gaz halde bulunabilirler. Katı-Katı çözeltiler: Alaşımlar =metal+metal Sıvı çözeltiler: Sıvı- Katı: burun damlası, şerbet Sıvı- Sıvı: kolonya, sirke Sıvı- Gaz: gazoz, deniz suyu Gaz çözeltiler: Gaz- gaz çözeltiler= hava, doğalgaz... Homojen Karışımların Özellikleri KİMYA Dipte çökelti oluşturmazlar. Berrak görünüşlüdürler. Tanecikleri gözle görülmez. Süzme ile ayrılmazlar. Belirli erime, kaynama noktaları yoktur Çözünen madde miktarı arttıkça kaynama noktası yükselir donma noktası düşer. KİMYA Çözen ve çözünen madde miktarına göre çözeltiler : KİMYA Seyreltik Çözelti: Bir başka çözeltiye göre; Çözünen madde miktarı az, çözen madde miktarı ( çözücü) fazla olan çözeltilerdir. (Ör: 100gr su+ 1 gr şeker çözeltisi, 100gr su+ 10 gr şeker çözeltisine göre seyreltiktir.) Derişik Çözelti: Bir başka çözeltiye göre; Çözünen madde miktarı fazla, çözücüsü az olan çözeltilerdir. (Ör: 100gr su+ 15 gr şeker çözeltisi, 100gr su+ 5 gr şeker çözeltisine göre derişiktir.)