SU KİMYASI - Ankara Üniversitesi Açık Ders Malzemeleri
advertisement
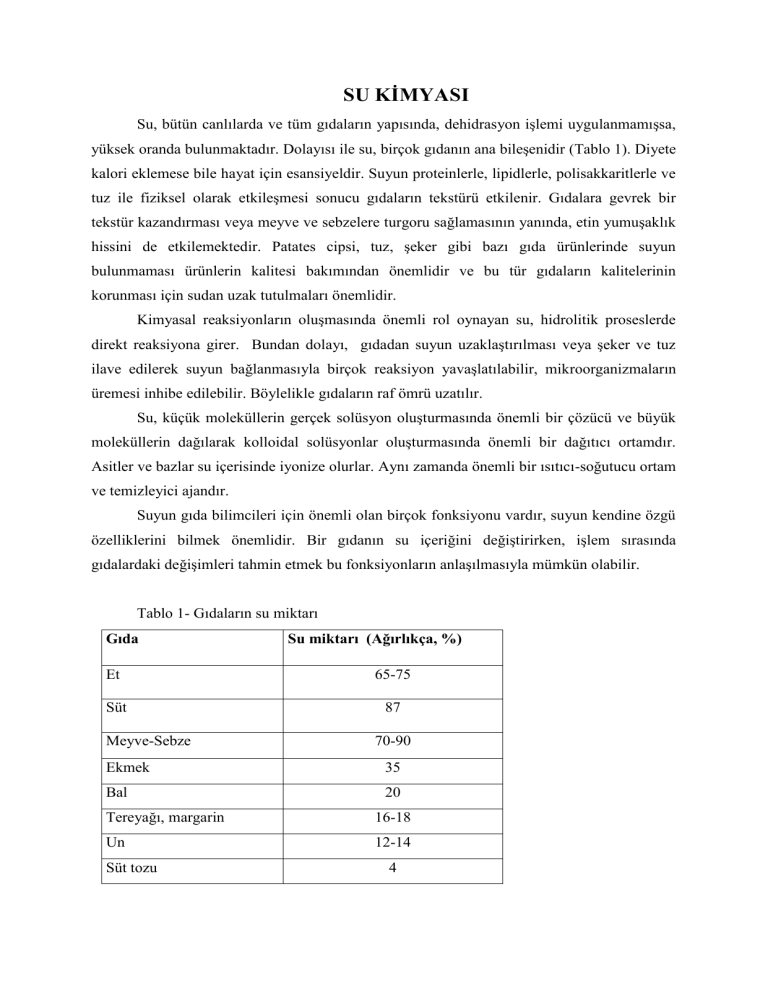
SU KİMYASI Su, bütün canlılarda ve tüm gıdaların yapısında, dehidrasyon işlemi uygulanmamışsa, yüksek oranda bulunmaktadır. Dolayısı ile su, birçok gıdanın ana bileşenidir (Tablo 1). Diyete kalori eklemese bile hayat için esansiyeldir. Suyun proteinlerle, lipidlerle, polisakkaritlerle ve tuz ile fiziksel olarak etkileşmesi sonucu gıdaların tekstürü etkilenir. Gıdalara gevrek bir tekstür kazandırması veya meyve ve sebzelere turgoru sağlamasının yanında, etin yumuşaklık hissini de etkilemektedir. Patates cipsi, tuz, şeker gibi bazı gıda ürünlerinde suyun bulunmaması ürünlerin kalitesi bakımından önemlidir ve bu tür gıdaların kalitelerinin korunması için sudan uzak tutulmaları önemlidir. Kimyasal reaksiyonların oluşmasında önemli rol oynayan su, hidrolitik proseslerde direkt reaksiyona girer. Bundan dolayı, gıdadan suyun uzaklaştırılması veya şeker ve tuz ilave edilerek suyun bağlanmasıyla birçok reaksiyon yavaşlatılabilir, mikroorganizmaların üremesi inhibe edilebilir. Böylelikle gıdaların raf ömrü uzatılır. Su, küçük moleküllerin gerçek solüsyon oluşturmasında önemli bir çözücü ve büyük moleküllerin dağılarak kolloidal solüsyonlar oluşturmasında önemli bir dağıtıcı ortamdır. Asitler ve bazlar su içerisinde iyonize olurlar. Aynı zamanda önemli bir ısıtıcı-soğutucu ortam ve temizleyici ajandır. Suyun gıda bilimcileri için önemli olan birçok fonksiyonu vardır, suyun kendine özgü özelliklerini bilmek önemlidir. Bir gıdanın su içeriğini değiştirirken, işlem sırasında gıdalardaki değişimleri tahmin etmek bu fonksiyonların anlaşılmasıyla mümkün olabilir. Tablo 1- Gıdaların su miktarı Gıda Su miktarı (Ağırlıkça, %) Et 65-75 Süt 87 Meyve-Sebze 70-90 Ekmek 35 Bal 20 Tereyağı, margarin 16-18 Un 12-14 Süt tozu 4 SUYUN YAPISI Suyun kimyasal formülü H2O’dur. Bir su molekülü 2 hidrojen, 1 oksijen atomundan oluştuğu için bir H iyonuna bağlanmış OH iyonu şeklinde tanımlanabilir. Alternatif olarak su dihidrojenmonoksit, hidrojen hidroksit olarak da isimlendirilebilir. Su molekülünde oksijen atomu ile iki hidrojen atomu arasında kuvvetli kovalent bağ vardır ve bağ açısı 104.5° dir. Su buz haline dönüştüğünde daha büyük bir açıyla 109.6° olur. Su molekülünde oksijen tetrahedral yapının merkezinde yer alır. Şekil 1- Su molekülünün yapısı Her bir H atomu oksijen ile bir çift elektron paylaşarak kovalent bağ ile bağlıdır. Oksijen aynı zamanda iki paylaşılmamış elektron çiftine sahiptir. Böylece, oksijen atomunun 4 elektron çiftinden ikisi hidrojenle kovalent bağ içerir, ikisi ise paylaşılmamış haldedir. Oksijen hidrojene kıyasla elektronegatiftir. Farklı iki atom kovalent bağ ile birbirlerine bağlandıklarında bağ elektronlarını farklı şekillerde çekerler. Bu tip durumlarda bağ dipolardır (iki kutupludur), yani bir tarafı negatif (), diğer tarafı pozitif yüklü () dür. Aynı iki atom arasında oluşmuş bağlar ise nonpolar (polar olmayan) bağlar olarak adlandırılır ve bağın iki tarafındaki atomlar elektronları eşit şekilde çektiğinden bir elektrik yükü oluşturmazlar. Su polar moleküldür. Su molekülü nötr olmasına (yani eşit sayıda elektron ve proton içermesine) rağmen, elektronların asimetrik şekilde dağılımı molekülü polar hale getirir.Yani elektrik yükü dağılımı asimetriktir. Su molekülü oksijen atomuna yakın bölgede negatif elektrik yükü, H atomuna yakın bölgede ise pozitif elektrik yükü taşır. Oksijen çekirdeği hidrojenlerden elektron çeker ve molekülün H atomları tarafında kalan kısmı () yüklü hale geçer. Oksijen atomu etrafında ise, elektron yoğunluğu arttığından molekülün bu tarafı () yüklü hale gelir.Bu farklı elektrik yükü nedeniyle su molekülleri kendi aralarında H bağları ile bağlıdır (Şekil 2). Hidrojen köprüsü Şekil 2- Su molekülleri arasında hidrojen bağları Hidrojen bağı kovalent ve iyonik bağlar gibi diğer bağlarla kıyaslandığında daha zayıftır. Fakat sayıları çok fazla olduğundan bileşik üzerine kümülatif bir etki yaparlar. Her bir su molekülünde 4 hidrojen bağı vardır. Su, periyodik tablodaki yerine bakılıp benzer bileşikler ile kıyaslandığında oda sıcaklığında gaz olması beklenirken, içerdiği fazla hidrojen atomlarından dolayı sıvıdır. Hidrojen ve oksijen atomları arasındaki hidrojen bağları yaygındır. Sadece su molekülleri arasında değil, gıdaların önemli bileşenlerinden şeker, nişasta, pektin ve protein gibi moleküller arasında da oluşmaktadır. V şeklindeki yapısından dolayı her su molekülü yakınındaki moleküllerle dört hidrojen bağı yapabilmektedir. Her hidrojen atomu bir hidrojen bağı yapabilirken oksijen atomu iki hidrojen bağı yapabilmektedir. Böylece buzun üç boyutlu yapısı oluşmaktadır. Buzun yapısı dinamiktir ve hidrojen bağları su molekülleri arasında devamlı parçalanıp yeniden oluşmaktadır. Su da hidrojen bağları içermektedir ve bu bağlar da değişik bir düzenle yıkılıp yeniden oluşmaktadır. 100°C’de su moleküllerinin % 80’i hidrojen bağı içerirken, 0°C’de bu değer % 90 civarındadır. Su molekülleri arasında buzdan daha küçük bir bağ açısı olduğundan moleküller daha sıkı olarak bir arada bulunurlar. Bu nedenle koordinasyon numarası olarak ifade edilen komşu molekül sayısı suda buzdan daha yüksektir. Su molekülleri arasındaki ortalama uzaklık sıcaklıktan etkilenir ve sıcaklık artışıyla birlikte moleküllerin daha fazla kinetik enerjiye sahip olup daha hızlı hareket etmesinden dolayı uzaklık artar. Her iki faktör de suyun yoğunluğunu etkilemektedir. Fakat koordinasyon numarasının etkisi daha fazladır. Buz sudan daha küçük bir koordinasyon numarasına sahip olmasından ve moleküllerin su kadar birbirine yakın olmamasından dolayı daha az yoğundur. Bundan dolayı buz suyun üzerinde yüzer. Su donarken yoğunluğu düşer ve hacmi % 9 civarı artar. Su miktarı fazla olan gıdalarda bu oldukça belirgindir. Kap ve ekipmanlar dondurma işlemi sırasındaki hacim artışına uyum gösterecek şekilde dizayn edilmelidir. Örneğin buzlu şekerler için üretilen kaplar genişlemeye izin vermelidir. Bu hacim artışı aynı zamanda yumuşak meyveler dondurulurken çeşitli hasarlara da sebep olmaktadır. Su, 4°C’nin üzerine ısıtıldığında moleküllerin birbirinde uzaklaşmasıyla yoğunlukta azalma oluşur. SUYUN ÖZ ISISI ve LATENT ISISI Buz ısıtıldığında, sıcaklık uygulanan ısıyla orantılı olarak artar. Suyun öz ısısı 1 gram suyun sıcaklığını 1˚C yükseltmek için gerekli olan enerjidir. Gerekli olan enerji miktarı su ve buz için aynıdır, değişmez ve hidrojen bağları nedeniyle diğer maddelere kıyasla daha yüksektir. Suyun öz ısısı her ˚C için 1 cal/g dır. Bu, 1 g suyun sıcaklığını 0°C’ dan 100˚C’ye çıkarmak için 100 cal gerektiği anlamına gelmektedir. Tablo 2 - Çeşitli maddelerin öz ısıları Madde Öz ısı (j/g °C)* Madde Su 4.18 Oksijen Alkol 2.54 Civa Zeytinyağı 1.96 Alüminyum Demir 0.46 Kurşun Bakır 0.37 *Bir kalori yaklaşık 4,184 joule'e eşittir Öz ısı (j/g °C) 0.92 0.12 0.91 0.13 Erime ısısı: Erime sıcaklığına ulaşmış 1 gram saf katı maddenin tamamen erimesi için gerekli ısı miktarına erime ısısı denir. Hal değiştiren bir maddenin aldığı ısı enerjisi, maddenin tanecikleri arasındaki mesafeyi artırarak moleküller arasındaki çekim kuvvetinin azalmasını sağlar. Her maddenin tanecikleri arasındaki çekim kuvveti aynı değildir. Bu nedenle çekim kuvvetinin zayıflatılması için maddelere verilmesi gereken ısı miktarları da aynı olmayacaktır. Yani her maddenin erime ısısı birbirinden farklıdır. Bu nedenle erime ısısı maddeler için ayırt edici bir özelliktir. Erime ısısı sadece erime sıcaklığındaki maddeler için söz konusudur. Örneğin buzun erime ısısı 334,4 J/g (80 cal) ’dır. Bu ısı -20 ºC’deki bir buza verildiğinde buzun sıcaklığı artar ama buz erimez. Ancak aynı ısı 0 ºC’deki buza verildiğinde buzun sıcaklığı artmaz ama erir. Buradan şöyle bir sonuç çıkıyor: Hal değiştiren bir maddenin sıcaklığı sabit kalır. Çünkü bu sırada maddeye verilen ısı, maddenin taneciklerinin birbirinden uzaklaştırılması için kullanılır. Latent erime ısısı 1 g buzun 0˚C de suya dönüşmesi için gereken enerjidir ve 80 cal dir, donma noktasındaki 1 g buz gerekli olan 80 cal enerjiyi absorbe eder ve sıvı faza geçer. Buharlaşma ısısı: Kaynama sıcaklığındaki 1 gram saf sıvıyı aynı sıcaklıktaki 1 gram buhar haline getirmek için gerekli ısıdır. Sıvı halde bulunan bir maddenin gaz haline geçmesi olayına buharlaşma denir. Buharlaşma olayının gerçekleşmesi için maddenin ısıya ihtiyaç vardır. Maddenin aldığı bu ısı, tanecikler arasındaki bağların yok olacak kadar zayıflamasına neden olur ve tanecikler birbirinden bağımsız hale gelir. Bu sırada maddenin sıcaklığı değişmez. Sıvı buharlaşırken çevresinden ısı aldığı için ve çevresini soğutur. Latent buharlaşma ısısı 1 g suyun 100˚C de buhara dönüşmesi için gereken enerjidir ve 540 cal dir, kaynama noktasındaki 1 g su gerekli olan 540 cal’i absorbe eder ve buhar haline dönüşür. Diğer birçok bileşikle kıyaslandığında suyun hem öz ısı hem latent ısısı oldukça yüksektir ve bu durum ısı transfer medyumu olarak su kullanıldığında göze alınması gereken önemli bir etmendir. Önemli miktarda enerjiyle suyun sıcaklığı yükseldikten sonra sıcaklık gıdaya transfer olabilmektedir. Suda ısıtılan gıdalar yavaş ısınmaktadır. Suyun buharlaşabilmesi için de önemli miktarda ısı gereklidir. Isıyı etrafından aldığından iyi bir soğutucu ajandır. Buz vakumlanır ve ısıtılırsa, sıvı faza geçmeden doğtudan buharlaşır. Bu olay sublimleşme olarak bilinir ve bu, gıdalarda uygulanan liyofilizasyon (soğuk kurutma) işleminin temelidir. Kahve bu işlem ile elde edilen gıdalara bir örnektir. Bu pahalı bir işlemdir ve sadece yüksek fiyatla satılan kahve gibi gıdalarda uygulanır. Kahve çekirdekleri dondurulur ve ardından yüksek vakum uygulanırken ısı işlemi uygulanır ve neredeyse tüm su süblimleştirme ile uzaklaştırılır. Donma yanığı da yine süblimleşmenin bir sonucudur. BUHAR BASINCI ve KAYNAMA NOKTASI Buhar basıncı Eğer küçük bir su birikintisi bir veya iki gün yerde kalır ise, sıvı buharlaşacağından kuruyacaktır. Su kaynamadığı halde birkaç su molekülü sıvıdan gaz hale geçecek enerjiye ulaşarak buharlaşmaktadır. Bir süre sonunda açık küçük bir havuz bu yolla kuruyabilir. Eğer sıvı kapalı bir kapta ise, dengeli olarak, bazı moleküller buharlaşırken bazı moleküller yoğunlaşır, bu sayede sistem içersinde bir değişiklik olmaz. Sıvı halden ayrılmış olan buhar molekülleri sıvının yüzeyine buhar basıncı adı verilen bir basınç uygular. Buhar basıncı yüksekken, sıvı kolayca buharlaşır ve birçok molekül buhar halde bulunur, kaynama noktası düşer. Tersine, düşük bir buhar basıncı ise sıvının kolay buharlaşmasını engeller ve az molekül buhar halde bulunur. Bu tür sıvıların kaynama noktası yüksektir. Sıvılar, buhar basıncı ile dış basınç eşit olduğunda kaynarlar. Buhar basıncı yükselen sıcaklıkla birlikte yükselir. Yüksek sıcaklıklarda, moleküller daha fazla enerjiye sahiptirler ve kendilerini tutan güçlere karşı gelip sıvıdan gaz hale kolayca geçerler; bu sayede çok sayıda buhar halinde molekül bulunur. Buhar basıncı tuz veya şeker gibi çözünebilen maddelerin eklenmesiyle düşer. Çözünen madde suyu seyreltir, bundan dolayı daha az su molekülü (aynı hacimde) buharlaşabilir halde olur ve az miktarda molekül buhar halinde kalır ve buhar basıncı düşer. Çözünen maddenin çekimi de buharlaşmayı kısıtlar. Kaynama noktası Eğer dış basınç ısıtma ile artırılırsa, kaynama noktası yükselir ve gıdalar normalden daha kısa sürede pişirilebilir (konserve teknolojisinde olduğu gibi). Örneğin, gıdalar konserve kutularına konup ısıtılırken buhar basıncı arttırılıp kaynama noktası 239-250˚F(115-121˚C) civarına çıkarılabilir. Aksine, eğer dış basınç düşürülürse, örneğin yüksek bir yerde, su daha düşük sıcaklıklarda kaynar ve gıdalar daha uzun sürede pişerler. Su yüksek kesimlerde daha hızlı kaynasa bile, sıcaklık deniz seviyesiyle aynı değildir. BİR ÇÖZÜCÜ OLARAK SU Maddelerin çözünen, su içerisinde dağılmış veya süspansiyon halinde olmaları sudaki partikül büyüklüklerine ve çözünürlüklerine bağlıdır. Su genel çözücü bir ortamdır. Solüsyon Su tuzlar, şekerler veya suda çözünen vitaminler gibi küçük molekülleri iyonize veya moleküler olarak çözer ve gerçek solüsyonlar oluşturur. Tuzlar, asitler veya bazlar su içerisinde iyonize olarak iyonik solüsyonlar oluştururlar. Örneği Sodyum klorürde sodyum (Na+) ve klor (Cl-) iyonlarını bir arada tutan iyonik bağlar bulunur. Suyun içerisine konulduğu zaman zıt yüklü iyonlar arasındaki çekim kuvveti su molekülleri tarafından azaltılır, iyonik bağlar yıkılır ve iyonların etraflarını su molekülleri çevirir başka bir deyişle hidrate olurlar. Her iyon altı tane su molekülü ile çevrelenir; iyonlar birbirlerinden bağımsız halde hareket ederler (Şekil 3). NaCl’ün kristal yapısı Suda çözünen NaCl Şekil 3- NaCl’nin suda çözünmesi Şekerler gibi polar moleküller yapılarında hidrojen bağları içerirler ve çözünerek moleküler solüsyonlar oluştururlar. Bir şeker kristali çözündüğünde, şeker molekülünün hidroksil grupları arasındaki hidrojen bağları kopar ve su molekülleri ile aralarında tekrar oluşur. Bu sayede şeker molekülleri yavaş yavaş hidrate olur ve her şeker molekülü su molekülleri tarafından çevrelenmiş olur. Su molekülleri, şeker moleküllerindeki polar grupları hidrojen bağları ile bağlarlar. Şeker molekülleri şeker kristalinden ayrılır ve etraflarındaki su molekülleri ile hidrate olur ve hidrojen bağları ile bağlanırlar. Hidrojen bağları arasındaki değişim söz konusu olduğunda, çözünürlük yükselen sıcaklıkla birlikte artar. Isıtma hidrojen bağlarını bozar ve su-su, sukroz-sukroz çekimini azaltır, bu durum, su ve sukroz molekülleri arasında hidrojen bağlarının oluşmasını ve sukrozun hidrate olmasını kolaylaştırır. Bundan dolayı, sukroz sıcak su içerisinde soğuk su içerisinden daha fazla çözünebilir haldedir. Çözünen madde suyun kaynama noktasını yükseltir ve sukrozun çözünürlüğü sıcaklık ile birlikte artar, özellikle 100˚C üzerindeki sıcaklıklarda, sukroz solüsyonlarında sukroz konsantrasyonu, solüsyonun kaynama noktası ölçülerek bulunabilir. Bu şekerleme veya pektin jölesi yapımında önemlidir. Kolloidal Dağılım Gerçek solüsyon oluşturamayacak kadar büyük moleküller su içerisinde dağılım gösterirler. Boyutlar 1-100 nm arasında olan parçacıklar ayrışarak kolloidal yapı veya sol oluştururlar. Selüloz, pişmiş nişasta, pektin bileşikleri, sakızlar ve bazı gıda proteinleri gibi moleküller buna örnektir. Kolloidal ayrışma genellikle değişkendir; eğer bir gıda üretimi söz konusu olacaksa kolloidal durum stabilize edilmelidir. Isıtma, dondurma veya pH değişiklikleri gibi faktörlerler bu değişkenliği etkiler. Koşulları değiştirerek stabil bir ayrışma sağlanması çökme veya jelleşmelere sebep olabilir; bu pektin jöleleri yapımı gibi bazı durumlarda istenen bir durumdur. Gel sistemlerinde elastik bir katı sıvı içerisinde ayrışmış bir halde bulunmaktadır. Gıda teknolojisinde kollodial faz içeren gıdaların stabilitesi ve çeşitli reaksiyonlara olan hassaslıkları, kolloid bilimi kapsamında incelenir. Süspansiyon Su içersinde bulunan 100 nm den büyük partiküller kolloidal ayrışma göstermek için fazla büyüktürler. Bunlar su ile karıştırıldıklarında süspansiyon oluştururlar. Süspansiyon içerisinde bulunan partiküller zamanla ayrılırlar. Buna örnek olarak su içerisine katılmış olan pişmemiş nişasta gösterilebilir. Geçici olarak dağılım gösterir ve kolayca ayrılabilir, bekledikçe içerisinde bulunduğu kabın dibine çökmeye başlar. Nişastalar, karıştırma işlemi sayesinde sıvı içerisinde dağılmış olarak bulunur. Nişastalar çözünmezler. Sabit bir şekilde bırakılırlarsa kabın dibine çökmeye başlarlar. SERBEST, BAĞLI ve TUTULAN SU Su bütün canlı varlıklar içerisinde bol miktarda bulunur, bunun sonucu olarak eğer uzaklaştırma işlemi yapılmamış ise gıdalarda da yüksek miktarlarda bulunmaktadır. Çoğu gıda dehidrasyona tabi tutulmamış yapısında % 70 e kadar su içerir, sebze ve meyveler de su oranı % 95 ve üzerindedir. Sudan kolayca sıkma, kesme veya presleme ile çıkarılan su serbest su olarak, bu tür yöntemlerle kolayca çıkarılamayan su ise bağlı su olarak adlandırılır. Bağlı su çeşitli yollar kullanılarak belirlenebilir; farklı metotlar bir gıda içerisindeki bağlı su değerini ölçmek amacıyla kullanılır. Gıdaları oluşturan bir çok madde kolayca ayrılmayacak şekilde suyu bağlayabilir veya su moleküllerine tutunabilir. Bağlı suyun bazı karakteristikleri şunlardır: - Tuzlar ve şekerler için çözücü olamaz, - Suyun donma noktasının altındaki sıcaklıklarda donar. - Buhar basıncı gösteremez, - Yoğunluğu serbest suyun yoğunluğundan daha fazladır. Bağlı su yapısal bağlılık gösterdiğinden çözücü olarak görev yapamaz. Moleküller buhar haline geçemez, sıvı haldeki sudan daha sıkı bir yapı gösterir bundan dolayı yoğunluğu yüksektir. Bağlı suya örnek olarak kaktüslerdeki veya çam ağaçlarının iğnelerindeki su verilebilir, bu su sıkarak veya preslenerek dışarı çıkarılamaz; çölde yüksek sıcaklık veya kışın oluşan donma olayları bu bağlı suyu etkilemez ve bitkiler bu şekilde canlı kalır. Dehidrasyondan sonra bile gıdalar bağlı su içerirler. Su molekülleri nişastalar, pektinler ve proteinler gibi moleküllerin polar gruplarında veya iyonik bölgelerine bağlanırlar. Su aynı zamanda pektin jelleri, meyveler ve sebzeler gibi gıdalarda tutulmuş formda bulunurlar. Tutulmuş olan su kapiller yapılarda veya hücreler içinde hareketsizdir, fakat kesilme veya hasar alma sonrasında serbest hale geçebilirler. Tutulmuş su, bağlı suyun değil serbest suyun özelliklerine sahiptir. Bir ürünün tazeliği içerdiği su miktarına bağlıdır. Gıdalar dehidrasyonla yüksek oranda su kaybederlerse solmuş bir görünüme sahip olurlar. SU AKTİVİTESİ (Aw) Su aktivitesi, veya Aw, bir solüsyondaki suyun buhar basıncının (Ps), saf suyun buhar basıncına (Pw) olan oranıdır. Aw=Ps/Pw Bakteri, maya ve küf gibi mikroorganizmalar yüksek Aw değerinde çoğalırlar. Bu mikroorganizmaların gelişmelerinin kontrol edilmesi gerektiğinden, gıdanın su aktivitesi bu açıdan göz önüne alınmalıdır. Su aktivitesi 0.85 ten daha aşağıya düşürüldüğünde daha az bir bakteri gelişimi söz konusu olmaktadır. Bunun dışında bakteriyel gelişimi etkileyen başka faktörlerde bulunmaktadır. (Gıda, optimum pH vb.) Yüksek şeker konsantrasyonu kullanılarak hazırlanan reçel ve jöle gibi gıdalar, yüksek tuz konsantrasyonları ile hazırlanan salamura gıda ürünlerinde, tuz ve şeker, su aktivitesini düşürmek amacıyla kullanılmaktadır. Tuz kimyasal yapısı sayesinde iyonize olarak ve suyu çekerek su aktivitesini şekerden daha fazla etkiler. Tablo 3- Bazı gıdaların su aktivitesi değerleri Gıda Su aktivitesi aw Saf su 100 Taze et ve balık 0.99 Ekmek 0.95 Eski kaşar 0.85 Reçel ve marmelat 0.8 Kuru meyve 0.6 Baharat 0.5 Yumurta tozu 0.4 Bisküvi, kraker 0.3 Süt tozu 0.2 İnstant kahve, toz çorba 0.03 GIDA MUHAFAZASINDA SUYUN ROLÜ Kurutma ve dondurma gıda muhafazasında uygulanan tekniklerdendir. Gıdalar dehidrate edilerek veya dondurularak su miktarları düşürülür ve raf ömürleri uzatılır. Gıdalardaki su miktarı, gıda kalitesini ve raf ömrünü etkilediğinden büyük önem taşır Örneğin, gıdalar gevrek veya kuru olarak sunulabilmektedir. Dondurma ve kurutma, gıdaların raf ömrünü gıdadaki suyu patojen ve bozulmaya neden olan bakterilerin kullanamayacağı hale getirerek uzatmak amacıyla kullanılan yöntemlerdir. Gıda içerisindeki su ne kadar hızlı dondurulursa, gıdalarda da hücresel açıdan o oranda daha az hasar meydana gelir. Küf veya mayaların üremesini engellemek amacıyla koruyucu maddeler eklenebilir. Suya affinitesi olan nem tutucular belli bir oranda nemin tutulması amacıyla gıdalara katılabilir.














