2. ÜNİTE = ATOM VE PERİYODİK SİSTEM 3. BÖLÜM : Atom
advertisement
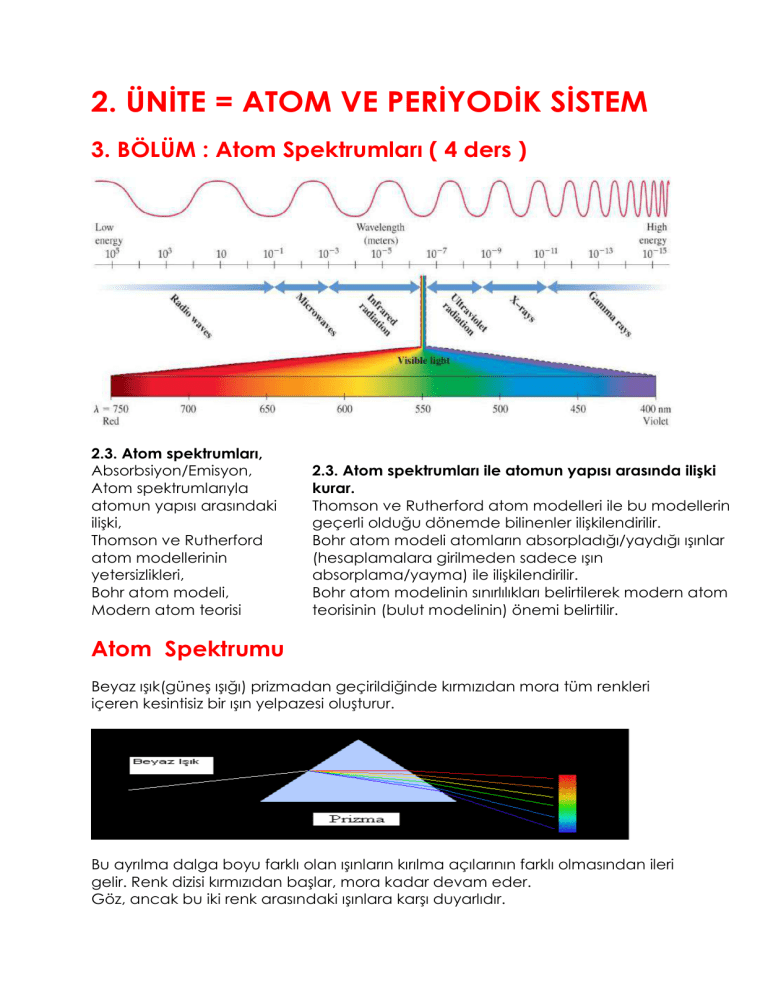
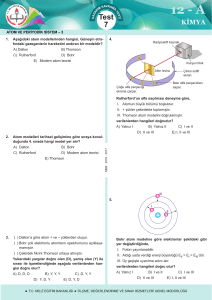
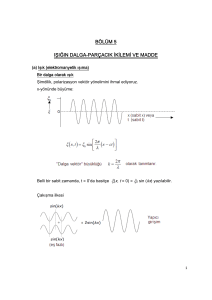
2. ÜNİTE = ATOM VE PERİYODİK SİSTEM 3. BÖLÜM : Atom Spektrumları ( 4 ders ) 2.3. Atom spektrumları, Absorbsiyon/Emisyon, Atom spektrumlarıyla atomun yapısı arasındaki ilişki, Thomson ve Rutherford atom modellerinin yetersizlikleri, Bohr atom modeli, Modern atom teorisi 2.3. Atom spektrumları ile atomun yapısı arasında ilişki kurar. Thomson ve Rutherford atom modelleri ile bu modellerin geçerli olduğu dönemde bilinenler ilişkilendirilir. Bohr atom modeli atomların absorpladığı/yaydığı ışınlar (hesaplamalara girilmeden sadece ışın absorplama/yayma) ile ilişkilendirilir. Bohr atom modelinin sınırlılıkları belirtilerek modern atom teorisinin (bulut modelinin) önemi belirtilir. Atom Spektrumu Beyaz ışık(güneş ışığı) prizmadan geçirildiğinde kırmızıdan mora tüm renkleri içeren kesintisiz bir ışın yelpazesi oluşturur. Bu ayrılma dalga boyu farklı olan ışınların kırılma açılarının farklı olmasından ileri gelir. Renk dizisi kırmızıdan başlar, mora kadar devam eder. Göz, ancak bu iki renk arasındaki ışınlara karşı duyarlıdır. Renkler arasında kesin bir sınır olmaması nedeniyle buna sürekli spektrum denir. Yağmurlu havalarda oluşan gök kuşağı da sürekli spektrumdur. Eğer bir atomdan yayılan ışın prizmadan geçirilecek olursa kesikli spektrum veya çizgi spektrumu elde edilir. Hidrojen gazının görünür bölgedeki çizgi spektrumu görülmektedir. Her elementin farklı bir çizgi spektrumu vardır. Parmak izi gibi ayırt edicidir. Havai fişeklerde her rengin oluşmasına farklı bir element yol açar. Na – sarı, Cu – yeşil, Sr – kırmızı, Ca – kiremit rengi ışın yayar. Rutherford Atom Modeli atom spektrumlarını açıklayamadığı için kısa zamanda terk edilmiştir. 1913 de Danimarkalı fizikçi Niels Bohr, hidrojen atomunun spektrum çizgilerini kullanarak güneş sistemine benzeyen yeni bir atom modeli geliştirdi: 4 - Bohr Atom Teorisi (Güneş Sistemi Modeli) 1. Proton ve nötronlardan ibaret çekirdek merkezde bulunur, 2. Bir atomdaki elektronlar çekirdekten belirli uzaklıktaki dairesel yörüngelerde hareket eder. 3. Bu yörüngelere enerji düzeyi veya katman denir. 4. Bu dairesel yörüngelerin merkezi çekirdek olup içten dışa doğru 1, 2, 3, 4,…… gibi sayılarla ve ya K, L, M, N, gibi harflerle gösterilir. 5. Yörüngelerin enerjisi çekirdekten uzaklaştıkça artar. E1<E2<E3<E4<………… 6. Elektron en düşük enerji düzeyinde bulunmak ister. Buna Temel(kararlı) Hal denir. Bu halde atom ışıma yapmaz. 7. Atom ısıtıldığında enerji soğurur (absorpsiyon) ve elektron temel halden daha yüksek enerji düzeyine çıkar. Buna Uyarılmış Hal denir. Kararsız bir yapıdır. 8. Elektron yüksek enerji düzeyinden daha düşük enerji düzeyine dönerken, yörüngeler arasındaki enerji farkına eşit bir ışın(foton) yayınlar. (emisyon) Bohr Atom Modelinin Yetersizlikleri Bohr modeli hidrojen atomu ve tek elektronlu iyonların davranışını başarılı bir şekilde açıklayabilmesine rağmen çok elektronlu atomların davranışlarını açıklamada yetersiz kalıyordu. Bu nedenle modern atom teorisi 1926’da Bohr modelinin yerini almıştır. 5- Modern Atom Teorisi Avusturyalı fizikçi Erwin Shrödinger (Örvin Şrödinger) ve Alman fizikçi Werner Heisenberg (Vörnır Hayzenberg), atomdaki elektronların doğasını daha ayrıntılı bir şekilde açıkladılar. Modern atom teorisine göre elektronlar Bohr’un teklif ettiği gibi belli yörüngelerde hareket etmezler. Modern atom teorisine göre elektron atom içerisinde her an her yerde bulanabilir. Bu nedenle belli bir zamanda elektronun nerede olacağını söylemek olanaksızdır. Atomda elektronun bulunma olasılığının yüksek olduğu bölgeler vardır. Bu bölgelere elektron bulutu veya orbital denir. Atom Modellerinin Tarihsel Gelişimi Dalton, ‘’atom bölünemez’’ - Faraday’ın elektroliz deneyleri bu teoriyi çürüttü. Thomson, ‘’Üzümlü Kek Modeli’’ - Atomda (+) ve (-) yükler rastgele dağılmamıştır. - Nötronlardan ve çekirdekten söz edilmemiştir. - Alfa ışınları deneyi bu teoriyi geçersiz kılmıştır. Rutherford, ‘’Çekirdekli Atom Modeli’’ - Atomların yaptığı ışımaları açıklayamamıştır. - Elektronların yerlerini ve hareketlerini tam olarak açıklayamamıştır. Bohr, ‘’Güneş Sistemi Modeli’’ -Çok elektronlu atomların elektron dağılımını açıklayamamıştır. Modern Atom Modeli Geliştirilmeye devam ediliyor.