Slayt 1 - Hadde Metal
advertisement

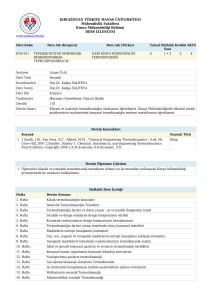
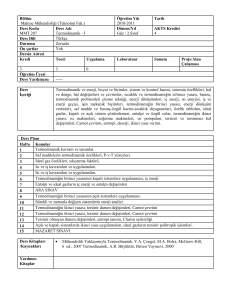
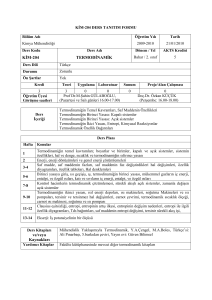
1-DERSİN İÇERİĞİ: •Giriş ve termodinamik terimlerin tanımı •Termodinamiğin 1. kanunu •Termodinamiğin 2. kanunu •İstatistik entropi •Termodinamik için yardımcı temel matematik eşitlikler •Isı kapasitesi, entalpi, entropi ve termodinamiğin 3. kanunu •Bir bileşenli sistemlerde faz dengesi •Gaz kanunları •Gaz reaksiyonları •Gaz fazlarında ve sıvı fazlarda reaksiyon dengesi •Çözünenlerin davranışı •İki Bileşenli Alaşımlarda Serbest Enerji-Bileşen ve faz Diyagramları •Çözünmüş sıvıların reaksiyon dengeleri •Elektrokimya 2-DERSİN YAYIN KAYNAKLAR: •“Introduction to Metallurgical Thermodynamics” , David R. Gaskell, McGraw-Hill •“Metall Thermodynamics”, David Ronage, YTÜ Sabancı Kütüphanesi, •“Metalurji Termodinamiği”, Prof.Dr.Veli Aytekin İTÜ Yayını •“Çözümlü Metalurji Termodinamiği Problemleri”, Prof.Dr. Feridun DikeçProf. Dr. Süheyla Aydın 3-SINAV VE DEĞERLENDİRME: 1. Yıl içi sınavı %40 2. Ders uygulaması %10 3. Ödev %10 4. Final sınavı %40 1. Hafta Giriş ve temel esaslar 2. Hafta Termodinamiğin 1. yasası 3. Hafta Isı, iş, enerji, entalpi, entropi, çevrim ve problem çözümü 4. Hafta Termodinamiğin 2. yasası, entropi, 1. ve 2. yasaların birleştirilmesi 5. Hafta Problem çözümleri 6. Hafta Temel termodinamik eşitlikler ve dönüşüm formülleri 7. Hafta Termodinamiğin 3. yasası ve örnek problem çözümleri, faz ve denge koşulları 8. Hafta 1.VİZE SINAVI (12-17Kasım 2007) 9. Hafta Gaz, katı-gaz ve katı-sıvı reaksiyonlarında denge oluşumu 10. Hafta Ellingahm diyağramı ve uygulamaları 11. Hafta Çözeltiler, aktivite, faz ve denge koşullarının belirlenmesi 12. Hafta Gibbs faz kuralı, serbest enerji ve denge koşulları 13. Hafta 2.VİZE SINAVI (10-15Aralık 2007) 14. Hafta Termodinamiğin 2. ve 3. yasalarının deneysel analizi 15. Hafta Elektrokimya, EMK, standart potansiyel ve metalurjik uygulamalar Giriş ve Termodinamik Terimlerin Tanımı Metalürji termodinamiğinin klasik termodinamikten farkı kimyasal reaksiyon sistemini incelemesidir. Reaksiyonu yapacak madde sistemde ve çevrede bir durum yada konumla tanımlanır. Basınç(P), sıcaklık(T) ve hacım(V) ancak sistemde maddenin tanımını yapabilir. Termodinamik olayları incelemek için sistem ve çevreyi birlikte ele almak gerekmektedir. Kutupsal koordinatlarda P,T,V nin oluşturduğu bir alanı ele alarak termodinamik özelliğin yoldan bağımsız olduğunu ispatlayalım; V a b d c T P1 P2 P T1 T2 V = V (P,T) V P1 P dP T1 dV = Vc – Va diferansiyelini ele alalım ve TERMODİNAMİĞİN SON DURUM İLE İLK DURUM ARASINDAKİ kuralını uygulayarak ve bu değişimin abc yolu ile gidildiği kabul edersek; dV = Vc – Va = (Vb – Va) + (Vc – Vb) matematiksel ispatı gerçekleştirebiliriz. ab yolu T= sabit, bc yolu P=sabit olduğundan; P2 (Vb-Va) = V T 1 T dT P2 T2 ve (Vc-Vb) = eşitlikleri ile tanımlanarak , V P1 P dP T1 P2 dV = V + dT T 1 T P 2 T2 bulunur. adc yolunu dikkate alınırsa da benzer eşitlik elde edilir. V dV = dT + T P1 T 1 T2 V P1 P dP olur. T2 P2 Hacım değişimini; V dT + ΔV = T 1 T P1 T2 V P1 P dP T2 P2 Veya; dV = V V dP + dT P T T P şeklinde ifade edilebilir, V = V ( P, T) fonksiyonunun diferansiyelinin matematiksel değerine eşittir. ÇEVRE İŞ W SİSTEM U=İç enerji SİSTEMİN ALDIĞI (+) Q SİSTEM VERDİĞİ (-) Q Bir gümüş klorit (AgCl O2) kimyasal reaksiyonunda, ΔH = 0 olduğunda, AgClO2 (k) → Ag (k) + 1/2 Cl2 (g) + O2 (g) Isı etkisi ile element yavaşça ayrışır ve değişime eğilim göstermez. Yine de ΔH = 0 ‘a yakın olması tamamen raslantısal meydana gelmiştir. Ekzotermiklikten başka gücü kullanan başka kuvvetler de vardır. Bozulan her mol gümüş klorit başına yarım mol gaz oluşur. Eğer bir miktar dietil eteri açık bir tabağın içine konursa doğal buharlaşma meydana gelir ve bu sabit bir sıcaklığı sürdürmesi için ısı enerjisine ihtiyaç gösterir, sonuçta serinletici bir etki gösterir. Bu etkiden faydalanılarak tıpta lokal anestezi yöntemi bulunmuştur. Etil bromid’in buharlaşma sıcaklığı 38.4°C ‘dir. Bu sıcaklık normal vücut sıcaklığına çok yakındır, bu nedenle buharlaşması çok hızlı olur. Bu oluşumun reaksiyonu ve dönüşüm entalpisi; C2H5Br (k) = C2H5Br (g), ve ΔH° = 27.36 kJ/ mol. Sıvı yüzeyinden bir miktar buharlaşma meydana gelir. Üstelik, bu buharlaşma olayı endotermiktir. Gümüş kloritin bozunması olayındaki gibi bu oluşum önemli hacim artışı göstermektedir. Bunlar kendiliğinden oluşan değişimlerdir fakat bazı endotermik kimyasal reaksiyonlar laboratuar sıcaklığının altında meydana gelmektedir. Tionil klorit kuru temizleyicilerde çok fazla işe yarar çünkü üretim tamamen gazlıdır ve kirlenme yok denecek kadar azdır. Suyla reaksiyona girerek (hem de billurlaşmış suyla) denkleme göre; SOCl2 (k) + H20 (s) = S02 (g) + 2HCl (g). Reaksiyon için entalpi değişimi ΔH = +50.02kJ/mol ve bu reaksiyon normal labaratuvar koşullarının altında önemli soğutma etkisi oluşturur. Bu ve bunun gibi endotermik kimyasal reaksiyonların gaz ürünleri yoğunlaşmış reaktanlardan ortaya çıkar. Şunu rahatlıkla söyleyebiliriz ki bu gaz oluşturma olayı entropinin yükselmesi veya reaksiyonun gelişigüzel birleşmesinden meydana gelmiştir. Bu uygun olmayan pozitif ΔH’a sahip reaksiyon oluşması, düzensiz birleşme olayına örnektir. KATI, SIVI, GAZ HALİNDE BULUNAN MADDE ÇEVRESİ İLE DENGE OLUŞTURUR. ATOMLARI VE MOLEKÜLLER ARASINDA HİÇ SÜRTÜNME YAPMAYAN MADDEYE İDEAL GAZ DENİR. İDEAL GAZLARIN P-V-T İLİŞKİSİ; 1660 ROBERT BOYLE: T = Sabitse P1/V 1787 CHARLES : P = Sabitse V T 1802 JOSEPH GAY-LUSSAC: α = 1 / VO (V /T)P v v P2 > P 1 T2 > T1 P1 P2 T2 T1 P T İDEAL GAZ İÇİN α = 1 / 273 OLUP MUTLAK SICAKLIK İLE SANTİGRAT ARASINDAKİ FARK 273,16 DIR. GENEL GAZ KANUNU: P. V = n R T OLUP R = ÜNİVERSAL GAZ SABİTİDİR. STANDART BASINÇ 1 ATMOSFER, STANDART SICAKLIK 0 K, STANDART HACIM 22,414 LİTRE ALINARAK; R = P V/ T = 1 atm. 22,414 lt / 273,16 K mol =0,082057 lt atm / K mol 1 atm = 760 mm civa sütunudur ; = Yükseklik x Yoğunluk x Yerçekimi = 0,760 (m) x 1,3595 x 104 (kg/cm ) x 9,80665 (kg. m.s ) = 1,0132 x 105 (N/m2) Bu eşitliğin her iki tarafını (1lt=1dm3=10-3 m3) ile çarparsak 1 lt.atm = 1,0132 x 102 Nm = 1,0132 x 102 joul (J) bulunur. R=0,082057 lt.atm /K mol = 8,3144 J / K mol = 1,96 cal / K mol 3 -2 H2O nun faz diyagramının şematik çizimi P SIVI 1 atm KATI GAZ 0 Co 100 Co T VE GAZ BUHAR KARIŞIMLARI İdeal gazlar için genel gaz kanunu; P.V = n.R.T = Sabit olup, burada n mol miktarıdır. Bu denklem P-V sisteminde her noktaya uygulanabilir. Gazlar sabit sıcaklıkta (İzoterm), sabit basınçta (izobar) ve sabit hacımda bulundukları konumdan bir başka konuma durum değiştirebilirler. Bir diğer durum da adyabatik durum değiştirmedir, burada çevre ile ısı değişimi olmaz. Adyabatik durum değiştirmede; P V = Sabit olur, burada = cp/cv olup cp; sabit basınçtaki ısı kapasitesi, cv ise sabit hacımdaki ısı kapasitesidir. İdeal gazlarda tek atomlu gazlarda cp=5/2R, iki atomlu gazlarda 7/2R ve çok atomlu gazlarda 4 R dır. Tek atomlu gazlarda ( Ar,He,vb) cv=3/2R, iki atomlu gazlarda (H2,O2,CO,vb) 5/2R ve çok atomlu gazlarda 3 R dır. Cp = ncp ve Cv = ncv dır. Genel olarak; Cp = (dq /dT)p = (dH /dT)p ve Cv = (dq/dT)v = (dU /dT)v olup U; iç enerji ve H; entalpidir. Isı kapasiteleri arasındaki fark üniversal gaz sabitine eşittir (CpCv = P(V /T)P = R. Sıvılarda ve katılarda sıcaklık değişirken ısının bununla olan bağıntısı:Q = m c ΔT şeklinde olup, gazlarda da aynı denklem;Q = n C ΔT dir. Hangi tür termodinamik işlem uygulandığına bağlı olarak iki çeşit ısı kapasitesinden biri seçilir, Cp > Cv olduğu görülür , çünkü sabit hacimde alınan bütün ısı sıcaklığı değiştirmez, bir kısmı da iş yapar. MUTLAK NEM, BAĞIL NEM, ÇİĞ NOKTASI: Havadaki nemin incelendiği bilime psikrometri denir. Mutlak nem belli bir hacimdeki su buharı ağırlığının aynı hacimdeki kuru hava ağırlığına oranıdır (w). Su buharı çok düşük basınçlarda gaz olarak kabul edilebilir . Gazlar için tanımlanan eşitlikler su buharına da uygulanır. Psikrometride hava bir gaz karışımı olarak kabul edirse, bunun içindeki nem, buharlaşmış su olduğu sonucuna varırız. Dalton – Gibbs yasasına göre; karışımda bulunan iki gazın birbirlerine ağırlık oranları : Bileşiminde su buharı bulunduran nemli hava (s) ile su buharı bulundurmayan kuru hava karışımını da (k) ile gösterirsek; genel gaz denkleminden; P=Basınç, V=Hacım, m=kütle, ρ=Yoğunluk için; Ps.Vs =PkVk (T=Sabit) Ps/Pk = Vk/Vs= mk /ρk / ms /ρs = mk ρs / ms ρk Ps mk ρs Vk —— = —— = —— Pk ms ρk Vs Eşitliği elde edilir. Burada : w = Gaz karışımındaki mutlak nem, P s = Gaz karışımındaki su buharının kısmi basıncı P k = Gaz karışımındaki kuru havanın kısmi basıncı m s = Gaz karışımdaki suyun ağırlığı m k = Gaz karışımdaki kuru havanın ağırlığı Toplam gaz karışımı hacmindeki su kitlesinin kuru hava kitlesine oranı hesaplamak istersek; W = mk / ms = Ps ρk / Pk ρs Kuru havanın yoğunluğu 29,27 Kg/m3 ve çok düşük basınçta su buharının yoğunluğunu 47,1 Kg / m3 alırsak, W = 29,27 / 47,1 Ps / Pk W = 0,622 Ps / Pk Bulunur. Bağıl nem Bağıl nem birim karışım hacmindeki su buharı kitlesinin karışım sıcaklığındaki doymuş buhar yoğunluğuna oranıdır. Yerçekimi ivmesini sabit kabul ederek bağıl nemi, birim karışım hacmindeki su buharı ağırlığının karışım sıcaklığındaki doymuş buharın özgül ağırlığına oranı olarak tarif edebiliriz. Bu oran genel olarak ile gösterilir. γs = Karışım sıcaklığında kendi kısmi basıncına uyan buharın özgül ağırlığı (kg/m3 ), γg = Karışım sıcaklığına uyan doyma basıncındaki özgül ağırlığı (kg/m3) olup, γs Vg = —— = —— γg Vs Genel gaz denkleminden, PV=mRT eşitliğini gaz ve nem için uygularsak, karışımın sıcaklığı sabit olacağından; Ps Vs = ms RT ve Pg Vg = mg RT yazıp oranlanırsa; Φ = ms / mg = Ps Vs / Pg Vg olup, Vs = Vg olduğundan, Φ = Ps / Pg Olur. Burada s indisleri karışımdaki su buharını g indisleri karışım sıcaklığındaki doymuş durum özelliklerini göstermektedir. Bağıl nem, havadaki su buharı kısmi basıncının aynı sıcaklıktaki doymuş durum basıncına oranı olarak tarif edilebilir. Bu sıcaklık kuru hazneli termometre sıcaklığıdır. Bir çok kaynak kitapta bağıl nem Ps/Pg ile ifade edilir. s =g olursa, karışıma doymuş denir, bu konumda = 1 olur. Bağıl nem mutlak nem ile de ifade edilebilir. TERMODİNAMİĞİN 1. KANUNU KÜTLESİ SABİT OLAN SOYUT BİR SİSTEMİN TOPLAM ENERJİSİ SABİTTİR. SİSTEMİN TOPLAM ENERJİSİ TERMODİNAMİK DURUMA BAĞLIDIR. SİSTEMMİN KÜTLESİ SABİT OLDUĞUNDA, ENERJİ DEĞİŞİMİ OLUR, ANCAK ENERJİ YOK EDİLEMEZ VE ARTIRILAMAZ Yani, enerjinin korunumu ve enerjinin işe ve ısıya aktarım süresi ele alınır. Bu kanuna göre; enerji bir fonksiyonla tanımlanır. Yani, sistemin enerji değişimi, sistemin ilk ve son durumuna bağlıdır, enerji, alınan yoldan bağımsızdır. James Joule’ün yaptığı deneyler sonucu ısı ve iş arasındaki ilişki sağlam temeller üzerine oturtuldu. Joule, deneylerinde adyabatik olarak sınırladığı suyun belli miktarının ısı artışını gözlemledi ve yapılan iş ve ısı arasında bir doğru orantı olduğunu gördü. Bu orantısallığın anlaşılması ile ısının mekanik eşiti hakkında fikir artışı meydana geldi.1 kalori 1gram suyun sıcaklığını 1 santigrat derece artıran ısı enerjisi diye tanımlandı. Joule ısının mekanik eşitinin değerini joule başına 0,241 kalori olarak belirledi, çok geçmeden bu değer joule başına 0,2389 kalori olarak kabul edildi. Bu da yuvarlanmış olarak joule başına 0,239 kaloridir. (termokimyasal kalori diye adlandırılır) Gaz sabiti, R=8,3144 joule/K mol böylece 8,3144x0,239=1,987 dir. İÇ ENERJİ VE TERMODİNAMİĞİN 1. YASASI Joule tarafından yapılan deneyler şu demeçle sonuçlandı: ‘kapalı adyabatik bir sistemde bir cismin ilk konumundan son konumuna gelmesi için aynı iş miktarı gerektir. Bu durum termodinamiğin ilk yasasının formüle edilmesi için bir başlangıçtır ve cismin veya sistemin iç durumuna bağlı fonksiyonların tanımlanabilmesi için gereklidir. iç enerji U’yu fizikten bilinen kavramları kullanılarak açıklayacak olursak yerçekimi etkisinde kütlesi “m” olan bir cisim h1 yüksekliğinden h2 yüksekliğine çıkarıldığında yapılan iş (W); İş= W = kuvvet x yol = m g x (h2-h1) =m g h2-m g h1 yerçekimi etkisinde verilen m kütleli cismin potansiyel enerjisi cismin son durumu ve ilk durumu arasındaki farka bağlıdır, ikisi arasında alınan yoldan bağımsızdır. Newton’un yasalarına göre m kütleli cisme uygulanan kuvvet cismin hızlanmasına neden olur. F = m x a = m x (du/dt) (burada a=ivme) δW = F x dl (l = yol) δW = m x (du/dt)x dl =m x (dl/dt) x du =m x u x du Her iki tafaın Integrali alınınca W=(1/2) m u22-(1/2) m u12 = cismin u2 hızındaki kinetik enerjisi-cismin u1 hızındaki kinetik enerjisi Böylece tekrar görüldüğü gibi, yapılan iş konum fonksiyonlarının arasındaki farklılıktandır ve iki konum arasında alınan yoldan bağımsızdır. Adyabatik olarak sınırlanmış cisim üzerinde yapılan iş , cismin iç enerjisindeki değişime eşittir. Yani son durumdaki iç enerji ile ilk durumdakinin arasındaki farka eşittir. Dolayısıyla bir adyabatik işlemde cisme yapılan iş sonucu iç enerji A dan B ye hareket eder. W=-(UB-UA) Eğer iş cismin üzerinde yapıldıysa UB,UA dan büyük olurdu; cisim kendi kendine iş üretirse UB,UA dan küçüktür. Joule’ün deneylerinde adyabatik olarak sınırlanmış suyun durumundaki değişiklik sıcaklığındaki artış olarak ölçüldü. Bir ısı kaynağı ve su içerisine akmasına izin verilen ısı ile termal temastaki suyun yer değiştirmesi vasıtasıyla aynı sıcaklık artışı ve dolayısıyla aynı durum değişimi elde edildi. Isı değişimlerini tanıtmada cisimden dışarıya ısı veren (ekzotermik) için negatif değer, cisme ısı alan (endotermik) için pozitif değer kullanılır. Dolayısıyla, q=(UB-UA) Böylelikle cisim ısı aldığında, q pozitiftir ve UB,UA dan büyüktür; eğer cisim ısı verirse UB,UA dan küçüktür ve q negatiftir. Bir cisim düşünelim ki ilk konumu A, son konumu B, yaptığı iş W, absorbe ettiği ısı q olsun. Absorbe edilen ısı (q) iç enerjiyi q kadar artırır ve cisim tarafından yapılan işin (W) performansı iç enerjiyi W miktarınca azaltır. Böylece cismin iç enerjisindeki toplam değişim; UB-UA = q – w Bu, termodinamiğin ilk yasasının bir ifadesidir. Durumun sonsuz değişimi için diferansiyel olarak dU = δq - δw Belirlenir. İki konum arasındaki dU integrasyonu konumlar arasında alınan yoldan bağımsız olarak bir değer verir. Isı ve işin etkileri iki konum arasında alınan yola bağlıdır. İki konum arasındaki yol bilinmezse δw ve δq’nun integralleri değerlendirilemez. Şekil ’de U2 -U1 değeri, konum 1 ve konum 2 arasında alınan yoldan bağımsızdır. Bununla beraber sistem tarafından yapılan iş V1 ve V2 arasındaki eğrinin altında kalan alandır ve bu da yola bağlı olarak değişiklik gösterebilir. Şekil’de 1 konumundan 2 konumuna a,b,c üzerinden yapılan işler arasında şöyle bir ilişki vardır: Wa > Wb > Wc. Yine şekilden anlaşıldığı gibi 1 konumundan 2 konumuna ‘a’ eğrisi üzerinden gidildiğinde ‘b’ üzerinden gidilenden daha fazla ısı absorbe edilir. ‘b’ üzerinden gidildiğinde absorbe edilen ısı da ‘c’ üzerinden gidildiğinde absorbe edilen ısıdan fazladır. P P1 1 a P2 b c 2 V V1 V2 İç enerji için verilen denklemden ‘d’ bir durum fonksiyonunun diferansiyelini belirtir ve integrali yoldan bağımsızdır. ‘d’ sembolü ise kısmi türev alınmasını işaret eder. Yola bağımlı iki niceliğin toplamının yoldan bağımsız bir niceliği verdiği fark edilebilir. Sistemin ilk konumuna döndüğü çevrim için sonuç olarak U’ daki değişim sıfırdır; dU = (U2-U1) + (U1-U2) = 0 Döngüsel integralin yok olması durum fonksiyonunun bir özelliğidir. Joule’ün deneylerinde işlem adyabatik (q=0) olduğunda U2-U1 = W işleminde yolun açıkça belirtildiği fark edildi. Eğer sıcaklık ve hacim bağımsız değişken olarak seçilirse U = U(V,T) kısmi türevler bakımından U’nun tam diferansiyelini verir. dU = (∂U/∂V)T dV+(∂U/∂T)V dT Sistemin durumu sabit iken iki bağımsız değişken sabittir. Bağımsız değişkenlerden birinin değeri korunur ve diğerinin değişmesine izin verilirse bu işlem meydana gelir. Böylece işlemde sıcaklığın (T) devamlı korunduğunu veya basıncın (P) devamlı korunduğunu veya hacmin (V) devamlı korunduğunu görebiliriz. q = 0 olan adyabatik sistemlerde de bunu inceleyebiliriz. TERMODİNAMİĞİN 1. YASASI İÇ ENERJİ (U) ENTALPİ (H) ISI ENERJİSİ (Q) YAPILAN İŞ (W) Enerji korunarak, Termodinamiğin 1. yasasına göre sistemden çevreye ısı akısı olurken toplam enerji değişmeyecek ve sistem ile çevre arasında iş meydana gelecektir. Termodinamik durum sonucu, toplam enerjide dU kadarlık enerji artışı olduğunda, sistem ile çevre arasında dq kadar ısı değişimi olur ve sistem ile çevre arasında dw kadar iş meydana gelir. İş P.dV olarak dış basınca karşı yapılır. Yerçekimi kuvveti de dış kuvvet etkisi yaptığından iş yapar. Su aşağı doğru akar; bir tabak yere düştüğünde kırılır ve parçaları her yere saçılır; petrol ürünü bir yakıt ve oksijenle kimyasal etki yapması nedeniyle küçük bir kıvılcımla bile tepkimeye girer. Kartopu yaparken her zaman ellerimiz soğur bunun nedeni ısı enerjinin her zaman soğuktan sıcağa hareket etmesidir. Hiçbir madde kendinden daha soğuk bir maddeden ısı enerjisi almaz. Enerji varsa alınır, bu basit örnekler termodinamiğin TEMELİDİR. Asıl kendimize sormamız gereken soru neden karşı değişimlerin meydana gelmediğidir? Su kendi kendine yukarı doğru akabilir mi? Eğer yeterince beklersek kırık tabak parçaları kendiliğinden tekrar organize olarak eski haline gelebilir mi? Karbon monoksit, karbondioksit ve su buharı bir araya gelip, tepkimeye girerek tekrar eski haline; petrol ürünü yakıt ve oksijen’e dönüşebilir mi? Herhangi bir madde buzdolabında sıcaklığını muhafaza ederek kalabilir mi? Bir çok örnekte enerjinin bir konumdan diğerine dönüşümü sırasında toplam enerjide kayıp olmadığı varsayılmaktadır. Teoride toplam enerji korunmaktadır (Birinci Yasa). Suyun düşerken, yerçekimi sayesinde kazandığı enerji bir kinetik enerjidir. Suyun buharlaşma sıcaklığı her 40 m yükseklik azalmasında yaklaşık 0.1 °C artar. Yeryüzüne yeni düşmüş kar topluluğu toz haldedir, hareket kabiliyeti yüksek ve kolayca şekil alabilir fakat bir haftalık bir zaman sonra koşullar değişir. Değişen oluşum koşulları ve moleküllerin iç içe girmesiyle düşük bir yapı kaybıyla büyük kristaller oluşur. Değeri bilinen bir kar kütlesi için yüzey alanı nedeniyle yüzey enerjisi küçük kristallere göre daha yüksektir bu nedenle büyük kristallerin buhar basıncı biraz daha yüksektir. Buz kristallerinin büyüklük değiştirmesiyle, sonuçta; potansiyel enerji termal enerjiye dönüşür. Dışarıdan herhangi bir etkinin olmadığı bir yüzme havuzundaki suyun dinlenmeye bırakıldığını varsayalım. Eğer bir damla güçlü bir boya çözeltisi dikkatlice suyun yüzeyine damlatmadan eklenirse, boyanın rengi hızlı bir şekilde yayılacak. Bu olay odanın bir köşesine dökülen bir parfüm şişesinin bir süre sonra odanın tüm noktalarına yayılmasına benzer. Yoğun bir maddenin başka bir madde içinde yayılımı. Aslında bizim günlük yaşantımız bildik hadiselerin kalabalığından ibarettir, neyin neyle bağıntılı olduğunu ve değişimlerin yönünü düşünmeden duramayız. Su aşağı doğru akar; bir tabak yere düştüğünde kırılır ve parçaları her yere saçılır; petrol buharı ve oksijen kimyasal yükümlülüklerinden dolayı küçük bir kıvılcımla bile tepkimeye girer ve bu tepkime yardımıyla bir araba motoru üretilebilir daha sonra tepkime sonucu oluşan egzoz gazları atmosfere yayılır Kartopu yaparken her zaman ellerimiz soğur bunun nedeni termal enerjinin her zaman soğuktan sıcağa hareket etmesidir. Hiçbir madde kendinden daha soğuk bir maddeden termal enerji almaz. Enerji varsa alınır, bu basit örnek termodinamiğin esasıdır. Böylece asıl büyük kütlenin küçük parçalara ayrılmasında kalori, uygun ısı olarak geliştirildi. Rumford kör bir delici kullanarak harcanan işin üretilen ısı ile aynı olduğunu kanıtladı. Bu durumda kalori teorisi ısı üretimini, işin performansı sırasında metal yüzeyleri üzerindeki hava hareketine bağladı. Kalori teorisi 1799’da Humphrey Davy’nin iki buz kalıbını boşlukta birbirine sürtüp eritmesiyle gözden düşürüldü. Buzun erimesi için gerekli ısı, buzların birbirine sürtmesi sırasında yapılan mekanik iş tarafından sağlandı. Kal / K mol oldu. Genel Olarak; U = U(V,T) dU=(U/V)T . dV + (U/T)V . dT dU=n c v d T cv= (dU /dT)V, cp = (dH /dT)P ΔU ab = ΔU ac +ΔU cd+ ΔU db ΔQ ab = ΔQ ac +ΔQ cd+ ΔQ db ΔH ab = ΔH ac +ΔH cd+ ΔH db ΔW ab = ΔW ac+ ΔWcd+ ΔWdb BİLİNMESİ GEREKEN ÖZET BİLGİ 1. Δ: Bir büyüklüğün İki farklı durumu arasındaki değeri, d:Termodinamik özelliği olmayan büyüklüğün diferansiyeli, d:Termodinamik özelliği olan büyüklüğün diferansiyeli, 2. 1. yasa tersinirdir. Çevrim tekrarlandıkça kayıp olma 3. U=(V,T), dU=Cv dT, dH = n Cp , Cp = n cp, Cv = n c v, 4.İzobar sistemde H = U + W 5.İzoterm sistemde V2 dW= PdV V1 4. Adyabatik Sistemde Q=0 dır ! 5. PV=nRT ideal gazlar için genel gaz denklemi P-V düzleminde her noktaya uygulanır ! Ancak Adyabatik sitem için = sabittir ! PVT – ÇEVRİMi(Döngüsü) P a c d T=Sabit T=Sabit b V Dersin Tatbikatı Öğrenci No: Adı Soyadı : Uygulama Tarihi: Ekim2007 Öğrencinin Notu : Hacmi 15 lt, basıncı 25 atm ve sıcaklığı 400 K olan iki atomlu bir miktar ideal gaz bulunduğu konumu iki farklı yolla termodinamik olarak değiştirerek bir çevrim yapmaktadır. Birinci yol; Sırasıyla 1o) önce sabit basınçta 1300 K sıcaklığa getirildikten sonra bu 1300 K sabit sıcaklıkta 5 atm basınca ve daha sonra bulunduğu hacım değiştirimeden1 atm basınca ve bu konumdan da başlangıç konumuna izoterm olarak getiriliyor. İkinci yol, 2o) Başlangıç koşulu(15lt hacım, 25 atm basınç ve 400K sıcaklık) aynı seçilerek izoterm olarak 1 atm basınca, bu konumda sabit hacimde basıncı yükseltilerek 5 atm basınca getirildikten sonra, sabit sıcaklıkta tekrar başlangıç konumuna getiriliyor. a)Her iki çevrimi P-V –T diyagramında çizerek gösteriniz. b)Her bir durum değiştirmedeki basınç, sıcaklık hacmi hesaplayıp diyağram üzerinde gösteriniz. c)15 lt hacım, 25 atm basınç ve 400K sıcaklıktan 1 atm basınç, …lt hacım ve …K sıcaklığa izoterm olarak ulaşıldığında ΔU, ΔQ, ΔH ve ΔW ne olur, d) 15 lt hacım, 25 atm basınç ve 400K sıcaklıktan 25 atm sabit basınç, …lt hacım ve …K sıcaklığa ve daha sonra bu konumdan izoterm olarak 5 atm basınca gelip sabit hacımda 1 atm basınca ulaşıldığında ΔU, ΔQ, ΔH ve ΔW ne olur, e) (a) ,(b),© ve (d) yolları arasındaki farklılık varmıdır,neden, sözel ve sayısal açıklayınız. CEVAPLAR